

3-烷基哌啶(吡啶)生物碱(又称manzamine生物碱)是一类具有广谱生物活性和新颖结构的生物碱,一些具有代表性的3-烷基哌啶(吡啶)生物碱包括manzamine,ingenamine,haliclonin以及今天所要介绍的halicyclamine生物碱等。它们拥有相似的生源合成途径,Baldwin和Whitehead以及Marazano分别提出过他们的生源合成假说。
Baldwin-Whitehead假说认为部分还原的双-3-烷基二氢吡啶大环化合物A可以发生分子内DA反应从而得到五环亚胺阳离子中间体B。B发生还原则可以得到keramaphdine类生物碱。若发生异构则可以得到新的亚胺阳离子C,C经水解,开环便可以得到manzamine生物碱。若B发生逆Manich反应,断裂桥头的C-C键则可以得到halicyclamine类生物碱。Baldwin在1998年也采取仿生的DA反应合成了keramaphdine B(收率为0.2-0.3%),尽管收率不高,证明了他们的生源合成假说的可行性。
而Marazano则认为大环胺基戊二烯醛衍生物G或者F是关键中间体,经跨环Micheal加成或插烯Mannich反应来形成四环或五环化合物。Marazano也在1999年采取仿生合成的方式合成了halicyclamine B的双哌啶骨架,一定程度上也证明了它们的生源合成假说的可行性。
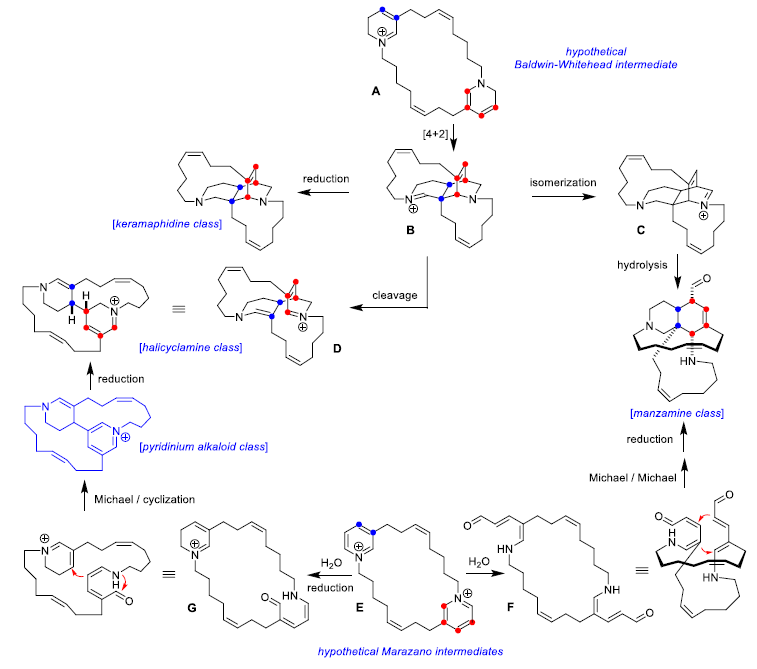
图1. 两种3-烷基哌啶生物碱的生源合成假说(图片来源:Angew. Chem. Int. Ed.)
Halicyclamine生物碱就是上述谱系中的一类生物碱。它们拥有广谱的生物活性,可以抗真菌,抗细菌,也可以作为细胞毒剂。例如halicylcamine A (1) 可以抑制结核分枝杆菌H37Ra的生长,这类生物碱是潜在的一类抗结核药物。但是这类四环生物碱还未有合成报道,合成上的挑战和化学生物学上的前景促使作者对epi-tetradehydrohalicyclamine进行了合成研究。
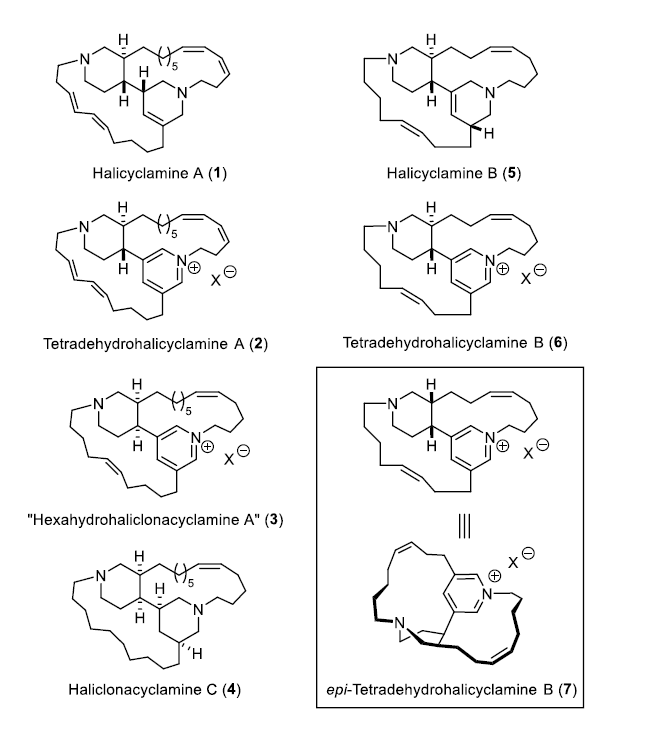
图2. 代表性的四环halicyclamine生物碱及相关的吡啶盐物种(图片来源:Angew. Chem. Int. Ed.)
作者以tetradehydrohalicyclamine B (6)和epi-tetradehydrohalicyclamine B (7)作为目标分子,提出了逆合成分析(图3)。由于目标天然产物etradehydrohalicyclamine B (6)和epi-tetradehydrohalicyclamine B (7)中存在吡啶盐结构,该结构很容易发生还原,水解,开环等反应,于是作者计划通过H的N-烷基化这种温和的反应来形成大环及吡啶盐。H则可以由I经酰胺的α-烷基化获得。I则可以追溯到两个简单的片段J和K,并通过RCAM(大环炔烃复分解反应)构建I中的大环。
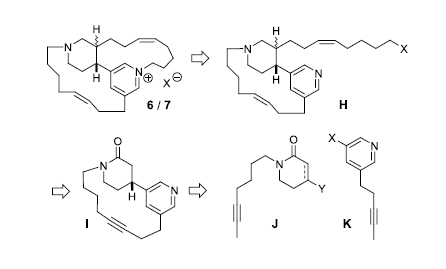
图3. 逆合成分析(图片来源:Angew. Chem. Int. Ed.)
作者首先从3,5-二溴吡啶 (8)出发尝试合成10。然而在钯、镍、铜或铁等催化作用下均不能得到目标产物10。吡啶毒化催化剂是一种可能的原因。随后使用3-溴吡啶11与锌试剂进行偶联可以顺利得到3-烷基吡啶12。但是对12进行吡啶C-5位的溴化和硼化都无法成功。由于吡啶-3位的偶联反应性较差,最终作者另辟蹊径,首先将3,5-二溴吡啶8制成格氏试剂13,与活性更高的烯丙基溴反应得到了烯丙基取代的吡啶15,再对15的末端烯烃进行官能团化,将其转变为了甲基炔片段,得到了片段10。
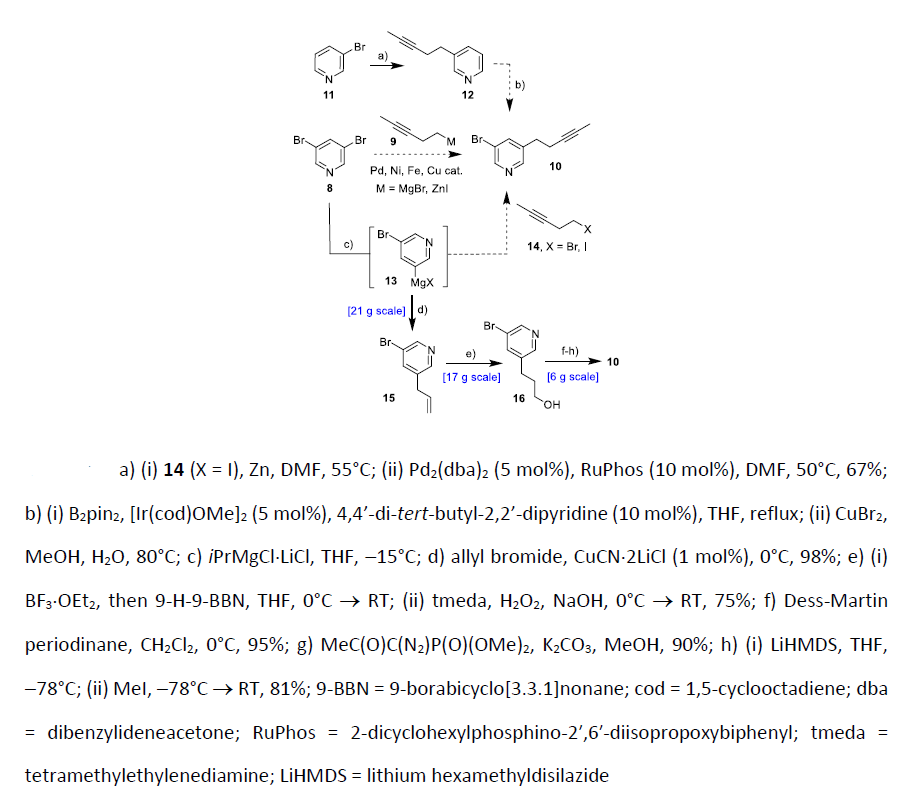
图4. 片段10的合成(图片来源:Angew. Chem. Int. Ed.)
随后作者对另外一个片段J进行合成,首先是尝试从2-哌啶酮出发,经3步简单转化,转化为了已知的Michael受体17。然而17与一系列的金属试剂,包括格氏试剂、锂试剂以及硼试剂的反应均不能得到目标产物21(图5)。于是,作者采取了极性反转的策略,将17转化为了硼试剂18,然而作者使用硼试剂18与10进行偶联时也失败了,无法得到目标产物21。最终作者将硼试剂18转化为了19,采取了最新的光催化的,Ni/Ir双金属催化的偶联反应,19在Ir催化剂作用下首先形成烷基自由基,10也与Ni催化剂发生氧化加成生成芳基Ni物种,随后芳基Ni物种与烷基自由基反应,再经过还原消除,最终以60%的收率顺利的得到了21。
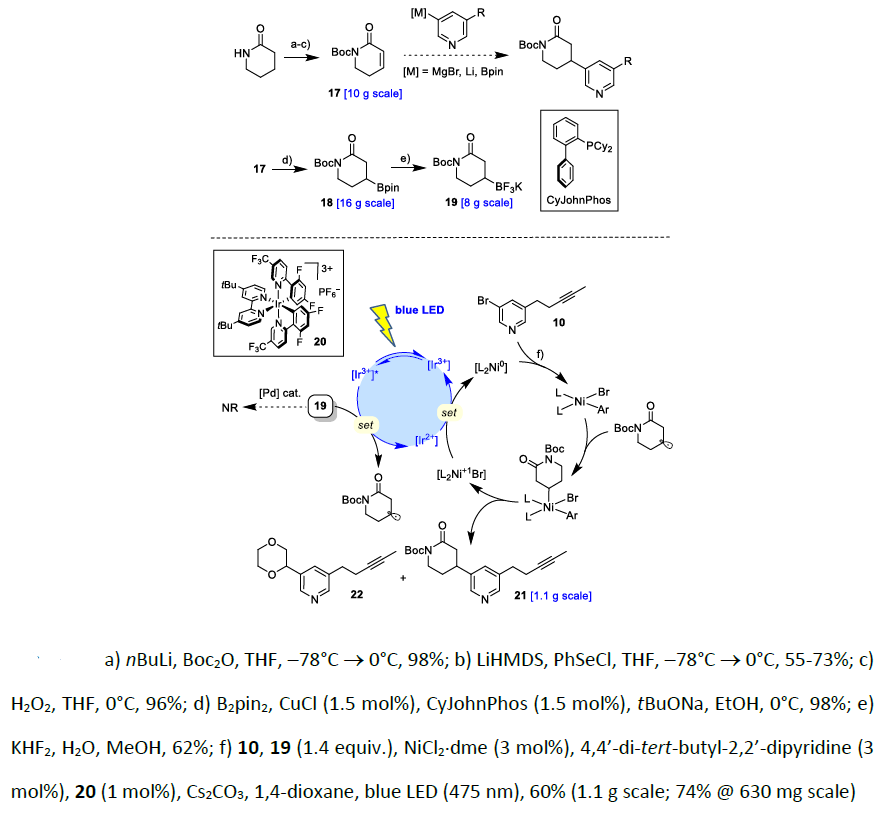
图5. 化合物21的合成(图片来源:Angew. Chem. Int. Ed.)
随后使用TFA脱除N-Boc,再通过N-烷基化可以顺利的得到二炔化合物23。Alois Fürstner教授课题组对RCAM(大环炔烃复分解反应)进行过很多的研究,发展了很多的催化剂以实现RCAM反应。在[Mo]催化剂29的作用下,23可以发生RCAM反应得到24,随后与28进行酰胺的α-烷基化得到25。23也可以先进行酰胺的α-烷基化反应生成26,再发生RCAM反应得到25。总的收率上,23先发生RCAM再进行酰胺的α-烷基化反应的收率会更高一些(图6)。
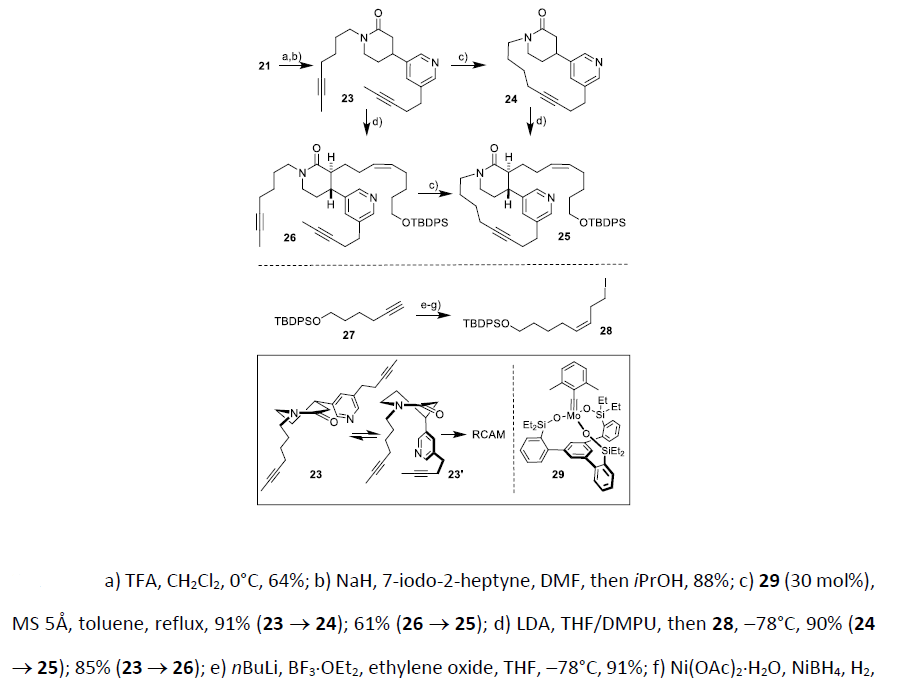
图6. 大环炔烃复分解反应合成25(图片来源:Angew. Chem. Int. Ed.)
作者也通过单晶X-衍射实验确定了24的结构(图7)。通过该单晶结构,可以知道内酰胺结构采取的半椅式的构象,由于内酰胺的刚性和平面性,RCAM反应前体化合物23中的内酰胺结构也必定是半椅式构象,才能满足大环化反应的构象。这也表明酰胺结构在对于23的RCAM反应是非常必要的。
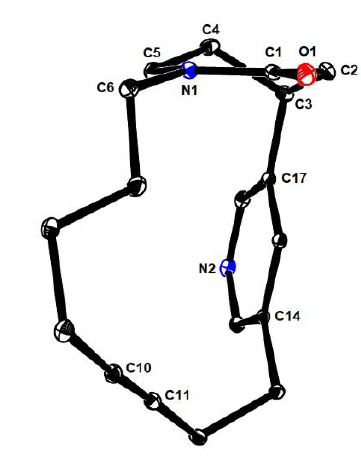
图7. 大环炔烃复分解反应产物24的单晶结构(图片来源:Angew. Chem. Int. Ed.)
随后作者开始了最后一个大环的合成工作,水和醋酸镍的催化作用下,可以顺利还原炔为顺式烯烃得到30。随后使用Vaska催化剂还原酰胺为烯胺,再使用氰基硼氢化钠还原烯胺便可以得到叔胺32。使用TBAF脱除硅基保护基再碘代,得到烷基碘物种33,最后在乙腈中回流便可以自发得到目标天然产物epi-tetradehydrohalicyclamine B (7),产率49%(图8)。
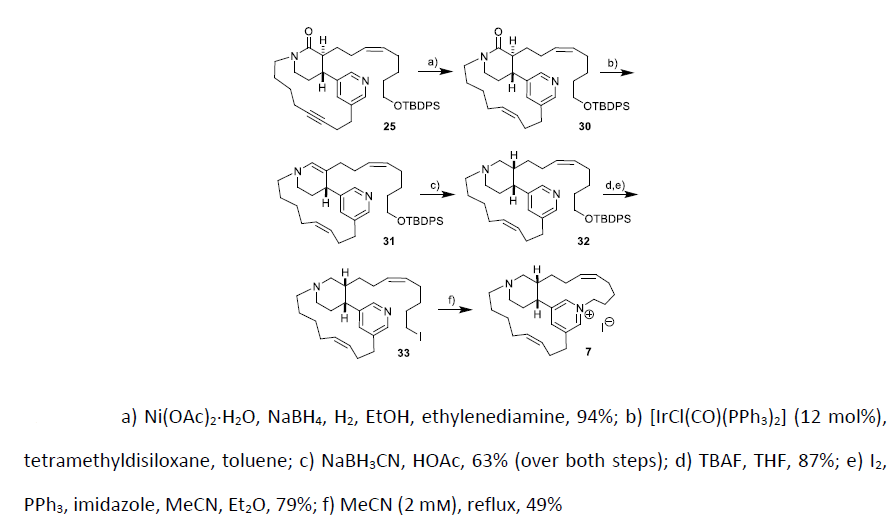
图8. epi-tetradehydrohalicyclamine B (7)的全合成(图片来源:Angew. Chem. Int. Ed.)
总结 Alois Fürstner教授课题组首先分别合成了两个六元环片段10和19,吡啶基团的存在往往会影响各种化学反应,然而作者采取了一系列方法以克服吡啶衍生物的活性过低的问题,更是采取光催化的偶联反应得到了21。作者采取了自己课题组发展的RCAM策略构建了大环,最后通过分子内大环亲核取代反应构建含吡啶盐的大环,最终首次合成了epi-tetradehydrohalicyclamine B (7),也为后续化学生物学的研究提供了物质基础。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn