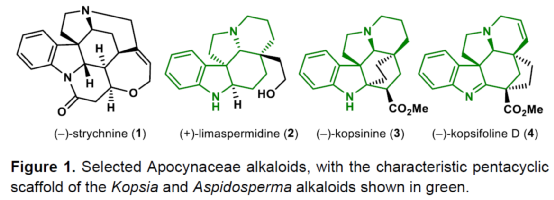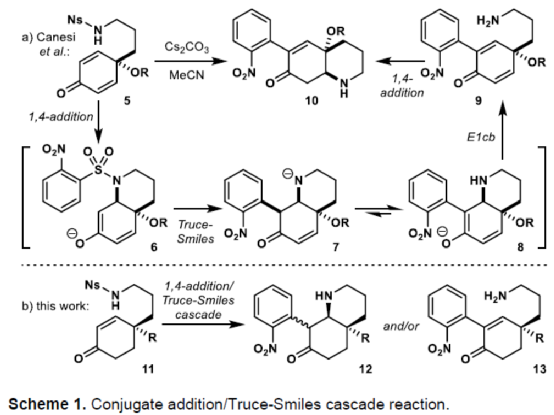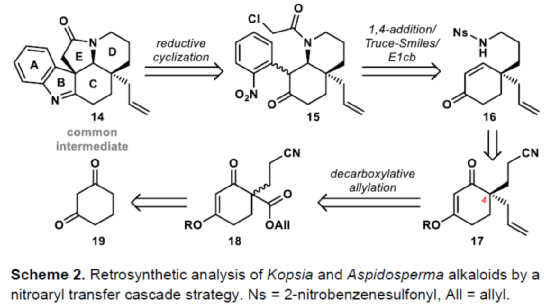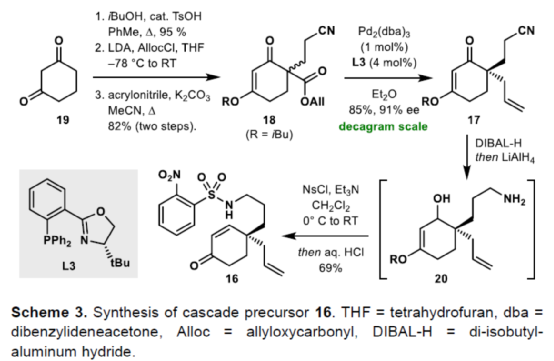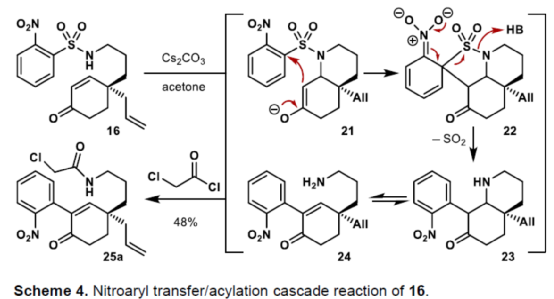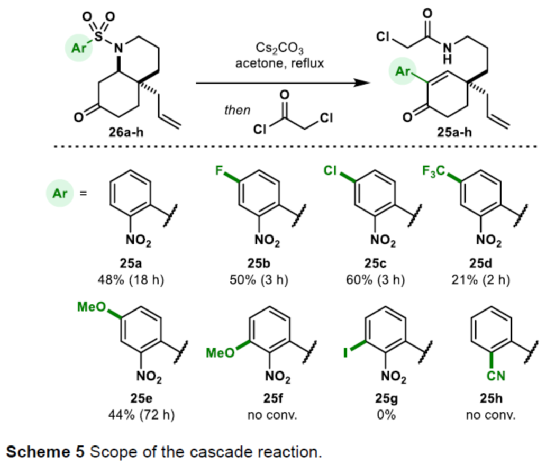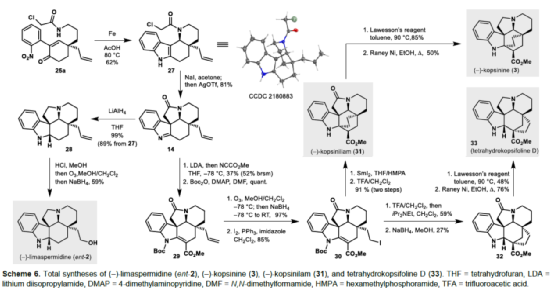
(图片来源:Angew. Chem. Int. Ed.)单萜吲哚生物碱(MIAs)是一大类从各种开花植物如Kopsia、Aspidosperma和Strychnos属中分离出来的天然产物(Fig. 1)。MIAs 通常具有复杂的多环骨架以及强大且多样的生物活性,已成为全合成的热点研究领域。早在1954年,Woodward课题组首次实现了(±)-strychnine的全合成。(+)-Limaspermidine(2)具有典型的Aspidosperma生物碱骨架,奇怪的是,与 Strychnos和Kopsia生物碱相比,它具有相反的五环核心绝对构型。1979年,Di Genova课题组首次从A. rhombeosignatum中分离出Limaspermidine。同时,在1976年,Ban课题组在对aspidofractinine的合成研究中无意中合成了Limaspermidine。从那时起,化学家们已开发了多种优雅的策略。1954年,Michael课题组首次从K. longiflora中分离出(-)-Kopsinine(3),具有高镇咳特性。其中,复杂的笼状骨架是Kopsia生物碱的特征。1985年,Magnus课题组首次实现了相应的不对称全合成。此外,kopsifolines(包括(-)-kopsifoline D,4)具有替代性的桥联骨架。(图片来源:Angew. Chem. Int. Ed.)在生物合成上,所有MIAs最终都来源于胡豆苷(strictosidine)、色胺的 Pictet-Spengler产物和萜类醛断马钱子苷(secologanin)。因此,大多数针对MIAs 的合成方法都以色胺(或相关的吲哚衍生物)为初始底物,通常以吲哚单元的去芳构化螺环化为关键的步骤。然而,吲哚的固有亲核性可能与合成中的其他关键步骤不相容,从而导致开发了用于后期引入吲哚或二氢吲哚单元的各种方法,如“中断性”Fischer吲哚合成和硝基芳烃的还原环化反应。尽管前一种方法为后期吲哚化提供了一种直接且有效的策略,但它可能会受到区域选择性问题或竞争性吲哚形成的影响。硝基芳烃的还原环化是Fischer吲哚化的一种替代性策略,但硝基芳基单元的区域选择性引入仍有待进一步探索。鉴于对合成吲哚碱和相关化合物的兴趣,Eelco Ruijter课题组开发了一种通过区域选择性引入硝基芳基单元的策略,实现了多环吲哚和吲哚啉骨架的构建。2016年,Canesi课题组报道了一种酪胺衍生的带有2-硝基苯磺酰胺单元的环己二烯酮5的串联反应,涉及磺酰胺单元与烯酮的共轭加成生成中间体6,中间体6经Truce-Smiles重排生成硝基苄基酮7,中间体7经快速质子转移、E1cb消除、共轭加成后生成(外消旋)四氢吲哚衍生物10(Scheme 1a)。作者认为,烯酮11可作为替代的底物,可通过1,4-加成与Truce-Smiles串联反应,生成“中断性”产物12或13(Scheme 1b)。此外,在关键串联反应中使用手性底物可实现Kopsia和Aspidosperma生物碱中绝对立体化学的控制。(图片来源:Angew. Chem. Int. Ed.)首先,通过逆合成分析发现,五环化合物14是合成Kopsia和Aspidosperma生物碱的关键中间体(Scheme 2)。中间体15经还原环化,可构建化合物14中的B和E环。16经1,4-共轭加成/Truce-Smiles/E1cb串联反应可生成中间体15。17经还原、nosylation以及Stork-Danheiser transposition可生成中间体16。17可由酮酯18经脱羧烯丙基化生成,而酮酯18可从1,3-环己二酮19合成。(图片来源:Angew. Chem. Int. Ed.)因此,作者以1,3-环己二酮19作为初始底物(Scheme 3)。1,3-环己二酮19经保护、酰化、Michael加成后,生成中间体18,三步总收率为78%。中间体18经钯催化的脱羧烯丙基化反应,生成中间体17,收率为85%,ee为91%。然而,将手性中间体17转为串联前体16,则具有难度。通过相关条件的优化后发现,使用DIBAL-H先将手性中间体17中的羰基还原后,再使用LiAlH4将腈基还原,随后在碱性条件下使用NsCl进行nosylation,并用HCl水溶液水解β-羟基烯醇醚,可生成串联前体16,收率为69%。(图片来源:Angew. Chem. Int. Ed.)紧接着,串联前体16在Cs2CO3/丙酮体系中进行硝基芳基转移,随后再使用氯乙酰氯进行酰化,可以48%的收率获得中间体25(Scheme 4)。(图片来源:Angew. Chem. Int. Ed.)紧接着,作者进一步扩展了该串联反应的底物范围(Scheme 5)。研究表明,当底物中的硝基芳烃4-位含有氟、氯、甲氧基或三氟甲基时,均可顺利进行反应,获得相应的产物25b-25e,收率为21-60%。其中,含有强吸电基团的底物,收率大幅降低,如25d。然而,当底物中的硝基芳烃3-位含有甲氧基(26f)和碘(26g)时,反应未能有效的进行。同时,含有2-氰基苯磺酰胺单元的底物(26h),也未能进行相应的反应。(图片来源:Angew. Chem. Int. Ed.)最后,作者对全合成进行了相应的研究(Scheme 6)。首先,25a在Fe/AcOH条件下进行还原/缩合反应,生成中间体27,收率为62%。中间体27经Finkelstein 卤化物交换以及AgOTf的活化过程,生成中间体14,收率为81%。中间体14使用LiAlH4进行还原,生成中间体28,收率为99%。值得注意的是,28可通过27经两步反应生成,总收率为89%,且无需对中间体14进行分离纯化。中间体28经成盐、臭氧分解以及还原后,可获得(-)-limaspermidine(ent-2),收率为59%。其次,中间体14在LDA/NCCO2Me条件下引入-CO2Me后(收率为37%),再对二氢吲哚的氮进行Boc保护,可获得几乎定量收率的中间体29。中间体29经臭氧分解(收率为97%)以及Appel反应(收率为85%),生成中间体30。中间体30经SmI2-介导的非对映选择性自由基环化/脱保护后,可获得(-)-kopsinilam(31),两步收率为91%。(-)-kopsinilam(31)通过进一步转化为硫内酰胺(收率为85%)后,再用雷尼镍还原(收率为50%),可获得(-)-kopsinine(3)。此外,中间体30通过去Boc保护/使用iPr2Net进行碘化物的保护(收率为59%)以及使用NaBH4进行还原(收率为27%)后,生成中间体32。中间体32通过进一步转化为硫内酰胺(收率为48%)后,再用雷尼镍还原(收率为76%),可获得tetrahydrokopsifoline D(33)。(图片来源:Angew. Chem. Int. Ed.)
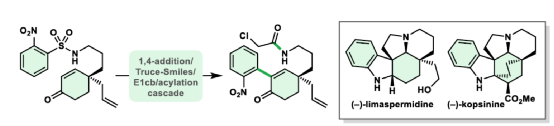
荷兰阿姆斯特丹大学Eelco Ruijter课题组开发了一种完全区域选择性硝基芳基转移的串联策略,合成了一种共同中间体,并可用于 (-)-limaspermidine、(-)-kopsinilam和(-)-kopsinine的不对称全合成,以及kopsifoline生物碱的骨架的构建。重要的是,这种串联方法还可通过使用不同取代的硝基芳磺酰胺前体进行合成后期修饰。
文献详情:
Brendan Horst, Daniël S. Verdoorn, Sven Hennig, Gydo van der Heijden, Eelco Ruijter*. Enantioselective Total Synthesis of (–)-Limaspermidine and (–)-Kopsinine by a Nitroaryl Transfer Cascade Strategy. Angew. Chem. Int. Ed. 2022, https://doi.org/10.1002/anie.202210592