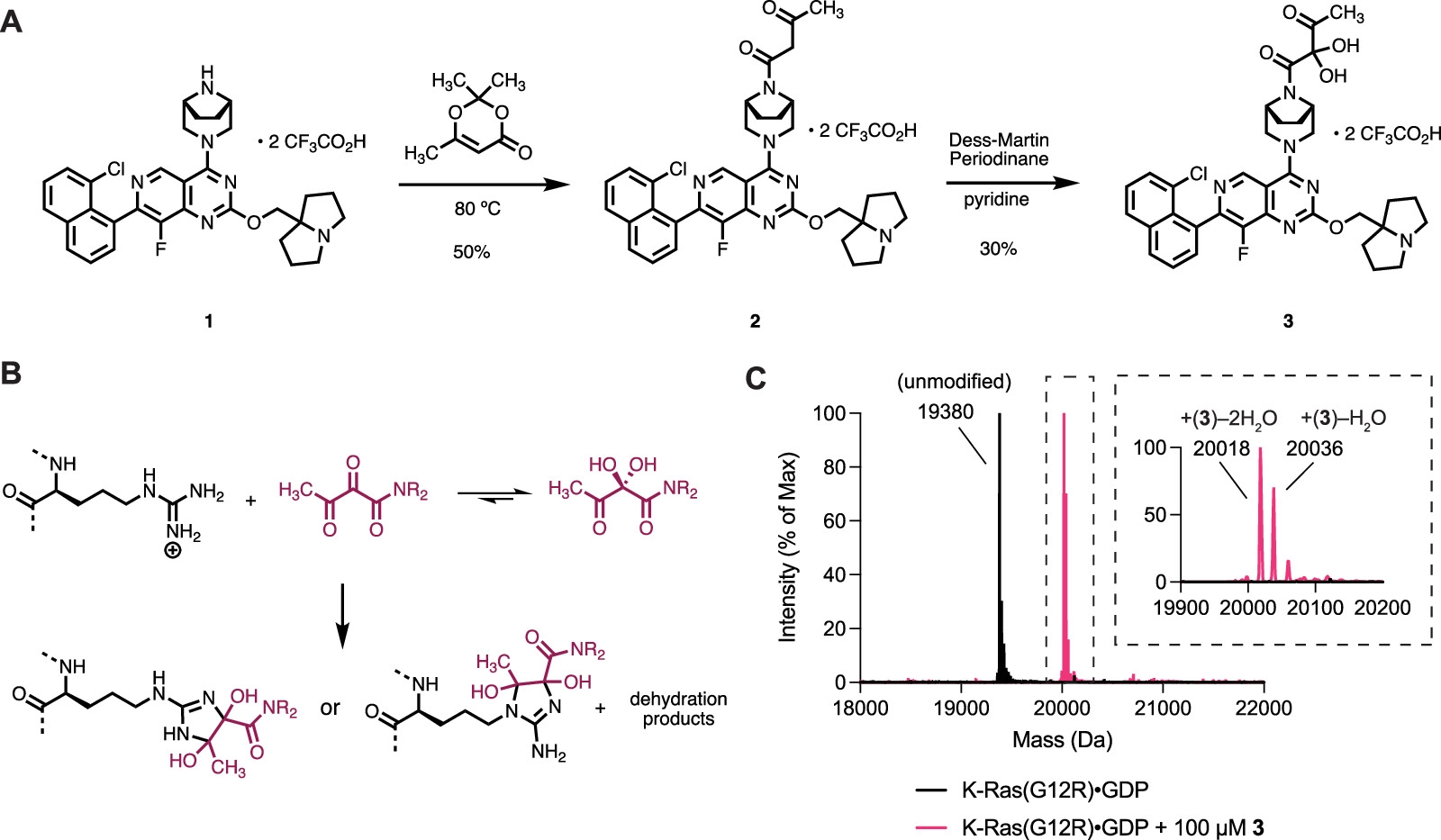
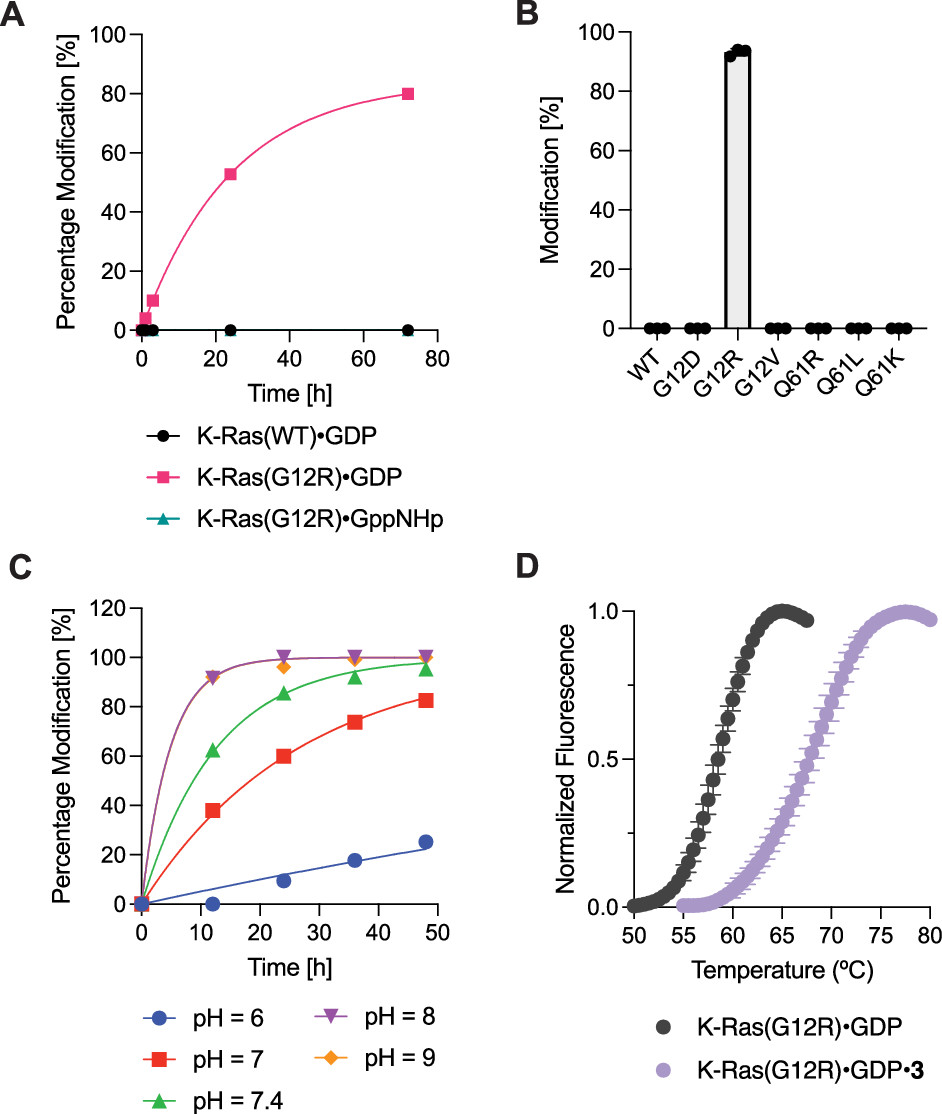
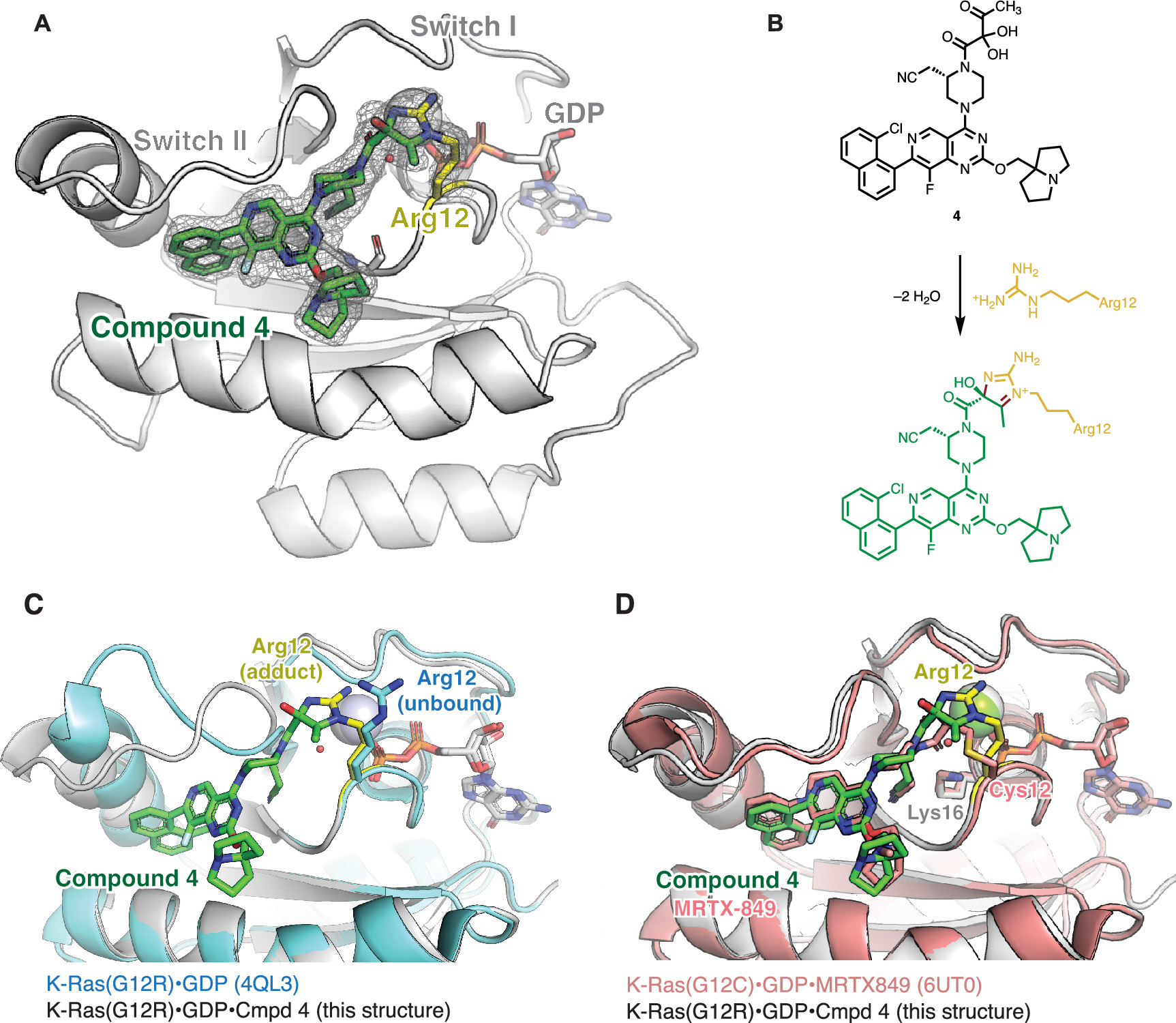
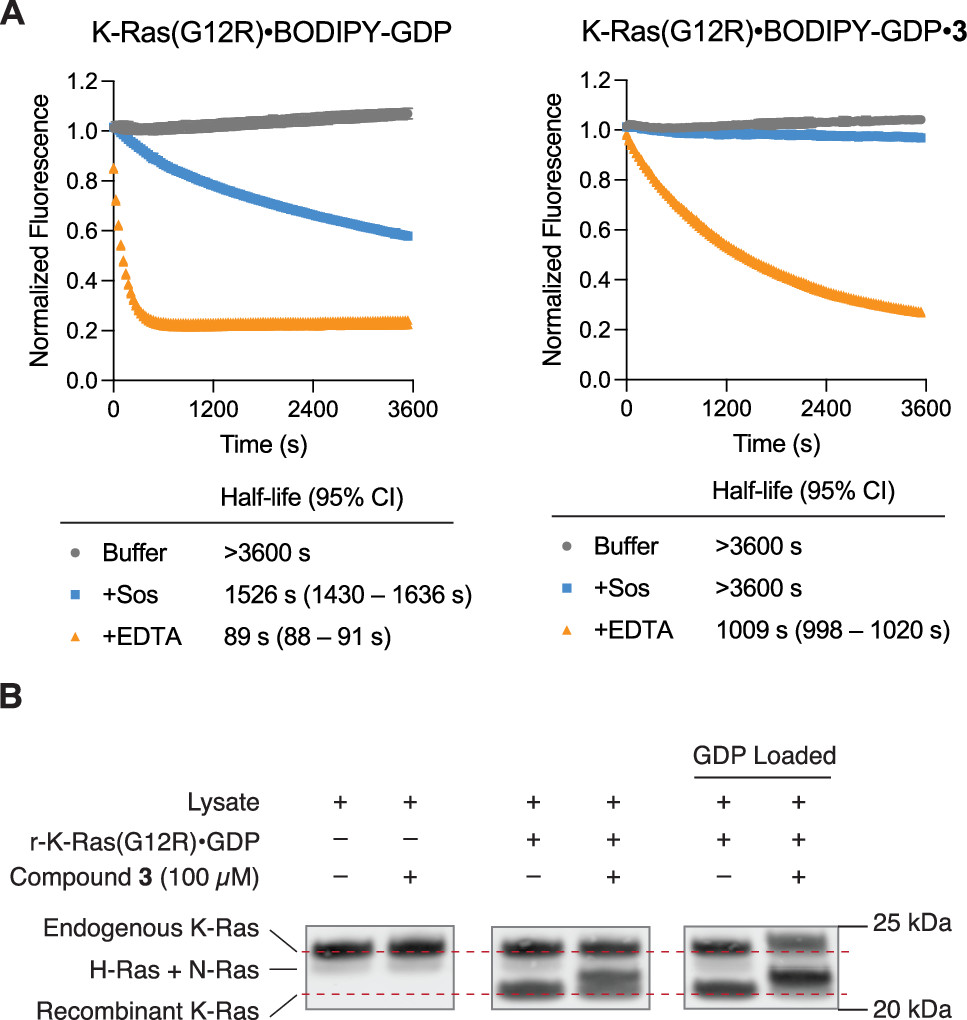
KRAS原癌基因的体细胞突变是人类癌症中主要的致癌病变。尽管KRAS在历史上被认为是“undruggable”的靶点,但最近成功开发的共价K-Ras(G12C)配体已经证明了直接、等位基因特异性的K-Ras抑制所带来的显著临床益处。这些K-Ras(G12C)抑制剂利用突变型半胱氨酸的强亲核性,不可逆地结合在K-Ras的Switch II区域。然而,K-Ras的许多频繁发生的体细胞突变不会产生半胱氨酸残基,而对这些突变体的选择性靶向仍然是一个未解决的挑战。但是,在17%的胰腺导管腺癌(PDAC)患者中发现了这种热点突变之一——KRAS p.G12R。因此,作者推断,对获得的精氨酸(Arg12)的共价结合可以赋予效力和选择性,并能够直接靶向K-Ras(G12R)。然而,在生理pH值(pKa3 = 12.5)下完全质子化的精氨酸的胍基团是弱亲核的。为了实现突变精氨酸的化学选择性靶向,作者首先考虑了优先与胍或脒反应的官能团。例如,已发现2,3-丁二酮,1,2-环己二酮可选择性地修饰蛋白质上的精氨酸残基。虽然这些试剂已被用于研究蛋白质糖基化,非特异性修饰蛋白质并进行生物偶联反应,但这种反应性尚未用于靶向共价配体。首先,作者合成得到具有α,β-二酮酰胺的化合物3。可能由于α-酮的强亲电性,化合物3只能作为水合物分离。化合物3在一定pH范围内的水性缓冲液中是稳定的,并且不与常见的含硫醇亲核试剂反应。然而,当将100 μM化合物3(分子量 = 674 Da)与重组K-Ras(G12R)GDP(GDP = 鸟苷二磷酸)在pH 7.5和23 °C下孵育并通过蛋白质质谱监测反应时,作者观察到两种新蛋白质种类的形成,其分子量与化学计量共价加合物一致,损失一或两个当量的水(分别为+ 656 Da和+ 638 Da,Fig. 1C)。确认K-Ras Switch-II配体在配备邻位二羰基系统时与K-Ras(G12R)中的Arg12的反应性。Fig. 1: α,β-二酮酰胺3的合成,与精氨酸残基反应机理以及K-Ras(G12R)GDP和K-Ras(G12R) GDP 3加合物的全蛋白质质谱。(图片来源:J. Am. Chem. Soc.)在pH 7.5下延长孵育后,化合物3未能对野生型(WT) K-Ras·GDP(Fig. 2A)或其它热点突变体产生修饰,包括G12D、G12V、Q61R、Q61K 和 Q61L(Fig. 2B),证实了其与Arg12的选择性修饰。此外,K-Ras含有几个表面暴露的精氨酸,它们没有被化合物3修饰,进一步支持了它对突变精氨酸的选择性。与该配体骨架对GDP结合状态的蛋白质偏好一致,化合物3与K-Ras(G12R)GppNHp的反应比较缓慢,72小时的修饰效率为<5%(Fig. 2A)。该反应依赖于pH值,在pH值6时反应速率大幅度降低,在在pH值8时反应速率达到最大值(Fig. 2C)。与未修饰的K-Ras(G12R)GDP相比,K-Ras(G12R)GDP·3加合物的热稳定性显著提高(Fig. 2D),熔融温度升高了9.1 °C,且这种加合物的形成也似乎是不可逆的。Fig. 2: 化合物3的选择性以及在不同pH条件下的反应速率。(图片来源:J. Am. Chem. Soc.)为了了解Arg12和α,β-二酮酰胺之间形成的加合物的化学性质,作者得到了K-Ras(G12R)·GDP和化合物4的共晶体(化合物3的结构类似物)。化合物4结合在K-Ras的Switch II口袋中,配体和蛋白质之间的共价键具有明确的电子密度(Fig. 3A)。其中,作者惊奇地观察到了一种咪唑鎓结构,Arg12以其ε和η氮参与“侧向”取向。这种咪唑加合物与全蛋白质质谱法揭示的两个水分子的损失一致(Fig. 1C)。来自η氮的亲核加成也似乎是立体选择性的,因为电子密度清楚地表明叔醇是S-构型(Fig. 3A,B)。与未配位的K-Ras(G12R)GDP相比,Arg12的侧链向Switch II区域靠拢,Cβ-Cγ-Cδ-Nε二面角由反向左转(Fig. 3C)。Fig. 3: K-Ras(G12R)GDP·4加合物的晶体结构。(图片来源:J. Am. Chem. Soc.)此外,为了进一步确认3和Arg12之间的反应是否会导致K-Ras(G12R)的功能性抑制。作者测试了K-Ras(G12R)与3结合前后核苷酸交换活性,发现荧光GDP类似物(BODIPY-GDP)在有Sos蛋白或乙二胺四乙酸(EDTA)的情况下交换未标记的GDP(Fig. 4A)。最后,作者利用K-Ras和3之间反应时分子量的增加在抗Ras免疫印迹上进行展示(Fig. 4B),验证了精氨酸靶向亲电试剂在复杂蛋白质组中对K-Ras的共价修饰。同时,作者也观察到化合物3仅能对外源重组蛋白K-Ras(G12R)·GDP实现完全修饰(Fig. 4B),表明了化合物3在细胞裂解物中保持活性,但不能与内源性K-Ras(G12R)结合。主要是由于与已被GDP状态选择性配体成功靶向的K-Ras(G12C)不同,K-Ras(G12R)严重损害了GTPase活性,从而阻止其转化为敏感的GDP结合状态。Fig. 4: (A)Sos蛋白或EDTA介导的K-Ras(G12R)和K-Ras(G12R)3加合物的核苷酸交换。(B)细胞裂解物中内源性和外源性K-Ras(G12R)的共价修饰。(图片来源:J. Am. Chem. Soc.)
Ziyang Zhang和Kevan M. Shokat团队使用α,β-二酮酰胺作为优先的精氨酸反应性官能团,确定了K-Ras(G12R)的第一个选择性突变共价配体。发现这些配体与K-Ras(G12R)产生稳定的咪唑鎓加合物,并使用X-射线晶体学直接观察到一种此类加合物的结构。作者成功地将其用于设计与复杂蛋白质组中的弱亲核精氨酸残基结合的靶向共价配体,其可以作为治疗靶向人类疾病中获得性精氨酸残基的基础。