


由于免疫测定具有高灵敏度和选择性,使它们对于检测不同应用中的不同生物分子特别有用。传统的免疫传感器基于三明治测定形式,将两种抗体结合到目标分析物的不同区域,并将特定识别抗体转换为物理上可检测的电子或光学信号。通常通过用化学试剂修饰换能器表面来实现捕获抗体受体与信号转导的结合。作者报道了一种新的生物电子亲和传感策略,该策略将天然细胞膜作为识别层,作为传统免疫测定中有吸引力的抗体受体替代品。细胞膜涂层技术构成了一种能够在合成材料或设备上复制细胞膜的丰富生物功能的强大策略。天然细胞膜涂层保留了细胞膜上膜蛋白和脂质,因此赋予涂层装置具有与生物系统交互的独特性能,包括捕获和分离生物靶标以及阻止非特异性吸附。
在这项工作中,作者衍生了巨噬细胞膜,将它们涂在电化学传感器上,并检查了它们在检测膜亲和性生物分子方面的性能(图1A)。由于肿瘤坏死因子-α (TNF-α) 在许多炎症性疾病中发挥着重要作用,因此作者选择其作为模型分析物。在该仿生平台中,TNF-α的特异性检测依赖于巨噬细胞膜识别层上的天然TNF-α受体和辣根过氧化物酶(HRP)标记的抗TNF-α检测抗体(HRP-Ab)。为了防止非特异性结合,作者进一步将巨噬细胞膜与红细胞膜融合,并使用混合膜对传感器进行功能化。具体来说,混合细胞膜功能化的金电极芯片用于基于单样品孵育的TNF-α亲和力测定,其中靶细胞因子被细胞膜上TNF-α受体选择性捕获,随后被HRP-Ab标记。这种三明治模式的细胞膜实验采用3,3',5,5'-四甲基联苯胺 (TMB)/H2O2作为介体/底物氧化还原检测系统。在靶标TNF-α存在下,被捕获的HRP酶在H2O2的支持下催化TMB氧化,随后被氧化的TMB通过电化学还原反应恢复到原始状态。实验得到的还原电流与传感器表面捕获的HRP-Ab量相关,同时还与目标TNF-α的水平成正比。为了区分空白与目标TNF-α,常用的TMB/HRP/ H2O2比色法需要几分钟氧化溶液中的TMB;然而,在电流分析中, 在施加恒定电位(-0.1 V)150秒后,氧化的TMB被选择性地还原。在这种检测过程中,结合在传感器表面的HRP-Ab会迅速氧化TMB,进而促进电化学信号变化。作者通过蛋白质印迹分析证实了巨噬细胞膜上存在TNF-α受体(图 1B )。如图C,传感器对10 nM的TNF-α具有超灵敏和选择性的检测,而对过量(300nM)的其它细胞因子的响应可忽略不计,并能够检测低至500 pM的TNF-α。
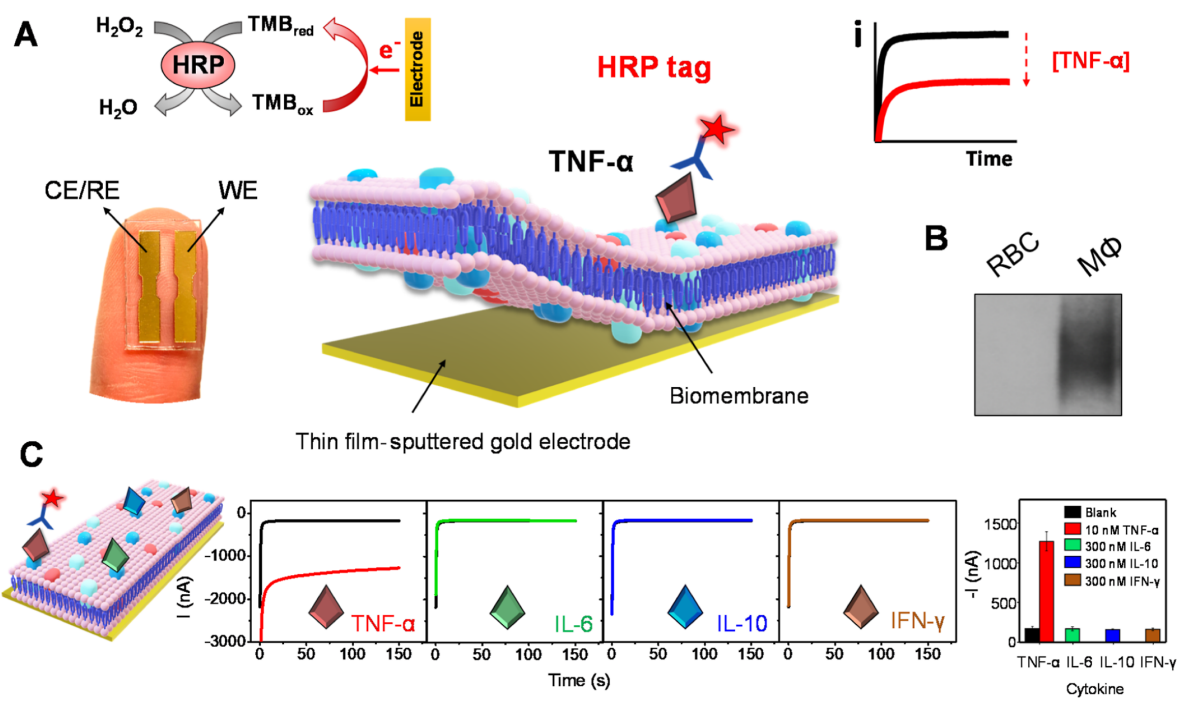
图1. 基于细胞膜的TNF-α 检测的生物电子亲和传感器。(图片来源:J. Am. Chem. Soc.)
作者通过三步制备了基于细胞膜的生物电子传感器芯片(图2A)。首先,将纯化的红细胞和巨噬细胞膜超声,并融合生成混合膜囊泡。随后,为了在工作电极区域产生均匀的生物膜涂层(不覆盖参考电极),将调整体积后的囊泡30 mL悬浮液滴铸到镀金电极上。此外,作者还通过调整囊泡负载和混合膜涂层组成,探索了巨噬细胞/红细胞混合膜的协同功能。考虑到包括TNF-α在内的许多血清蛋白都含有巯基,可以与传感器芯片表面进行非特异性结合,导致假阳性信号。为了抑制非特异性结合,作者使用红细胞膜衍生囊泡覆盖电极,并通过优化细胞膜负载有效实现抗生物污染的效果(图2B)。 在PBB(含有1%BSA的磷酸盐缓冲液)溶液中,用计时安培法评估金表面HRP-Ab和TNF-α蛋白的非特异性吸附水平。在没有和存在高浓度TNF-α的情况下,测试了未涂层和涂有不同RBC膜浓度的传感器芯片性能。结果显示,当金表面涂覆大量的膜,可以更好地防止不需要的蛋白质吸附。0.05 mg/mL(1.5μg)的膜负荷能够使最小附着量HRP Ab和TNF-α蛋白所产生的信号空白(S/B)比值变化到达平台。接下来,优化两种膜的混合比例,用于高灵敏度检测细胞因子(图2C)。具体来说,在没有和存在100 nM的TNF-α情况下,测量了生物传感器上混合膜涂层的中两种膜的比例从0:1(100%RBC)到1:0(100%巨噬细胞)时,S/B比率值的变化,这是由于巨噬细胞含有TNF-α受体,随着巨噬细胞的增加,更多的TNF-α/HRP-Ab结合物被捕捉到传感器表面上,导致其敏感性增加(图2C)。因此,作者选择巨噬细胞/红细胞膜比为3:1的混合细胞膜制备TNF-α生物传感器,该传感器包含足够数量的TNF-α受体用于检测,以及足够数量的红细胞膜用于防止非特异性吸附。
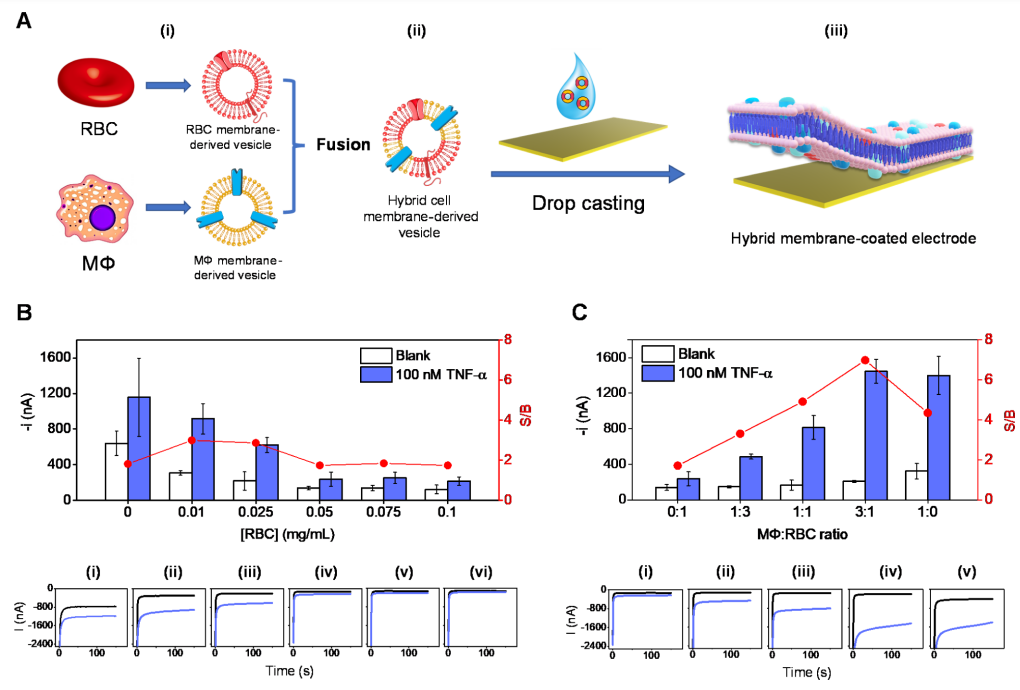
图2. MΦ/RBC混合膜涂层生物电子传感器芯片的制造和优化。(图片来源:J. Am. Chem. Soc.)
作者使用双荧光图像来验证金电极表面上的囊泡融合(图3A)。实验分别使用DiI和DiO标记巨噬细胞和红细胞膜,结果表明在金片上形成了高度均匀的混合细胞膜涂层。此外,SEM表征进一步验证裸金电极表面通过滴注法形成细胞膜涂层的稳定性(图3B)。结果表明,与粒状金表面相比,生物膜表面覆盖率更高。随后,对不同的细胞膜涂层方法进行检测,通过使用高电荷转移电阻值证实滴注法是最有效的方法(图3C)。在评估操作特性后,对生物电子芯片的制造及TNF-α的生物检测重复性通过比较五个独立测量5 nM TNF-α计时安培标准值进行评估(图3D)。为了调查细胞膜涂层芯片的物理特性,作者通过AFM分析研究了细胞膜涂层的形态(图3E),观察到混合膜涂层的平均厚度约为50 nm。
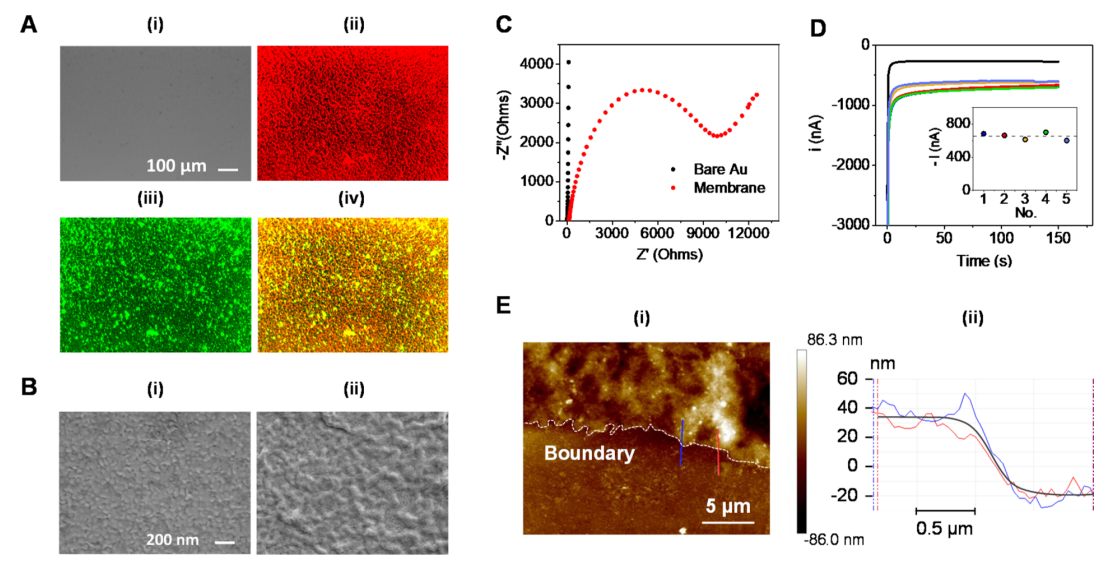
图3. 混合细胞膜生物电子传感器芯片的表征。(图片来源:J. Am. Chem. Soc.)
在优化生物膜组成后,作者测试了混合膜涂层生物电子传感器对不同的纳米级浓度TNF-α的检测能力。首先使用PBB培养基对生物传感器的灵敏度进行评估。实验检测了不同孵育时间下,不同浓度TNF-α的响应信号(图4A)。随后构建了TNF-α校准曲线(R2=0.9985),证实了基于细胞膜生物传感器可以在5分钟内快速捕获TNF-α并产生可测量的信号。作者还评估TNF-α检测传感器的选择性,研究了其他细胞因子对电流信号的影响。结果证实,修饰的生物膜有足够的TNF-α结合位点,因此,检测不受高IL-6浓度的影响。同时,作者证实了该传感器可以在多细胞因子样本矩阵中实现对TNF-β细胞因子的选择性检测(图4B)。
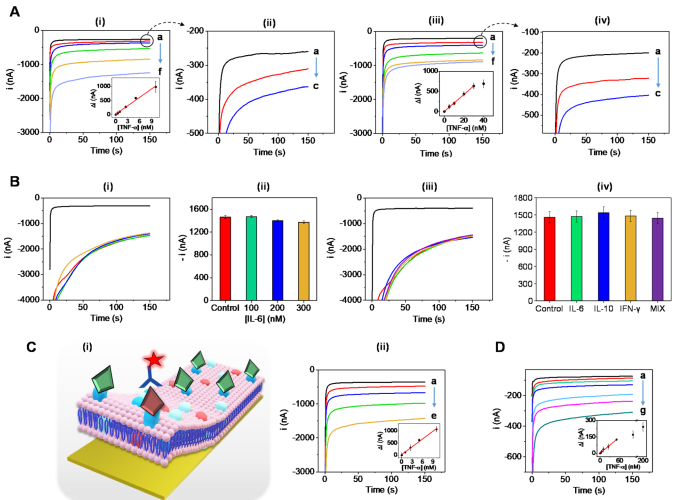
图4. 缓冲溶液中TNF-α的校正曲线。(图片来源:J. Am. Chem. Soc.)
总结 作者通过实验证明使用天然细胞膜作为识别层,构建的生物膜涂层电化学传感器能够对TNF-α细胞因子进行高度特异、灵敏和快速检测。该传感器在复杂体液或高浓度细胞因子环境中,对不同痕量的TNF-α具有良好的分析性能。实验表明,在传感器制备过程中,巨噬细胞膜上表达的TNF-α受体的完整性和功能性以及红细胞膜的抗生物污染性被很好的保留下来。不同细胞类型的多样性和独特功能为开发具有广泛应用的仿生传感平台提供了相当大的前景,为生物传感器的应用新领域铺平了道路。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn