- 首页
- 资讯
Angew:Bi(V)-介导吡啶酮的O-芳基化极性反转合成吡啶基醚
来源:化学加原创 2022-10-23
导读:近日,英国诺丁汉大学Liam T. Ball与美国科罗拉多州大学Robert S. Paton团队报道了一种2-/4-吡啶酮与芳基硼酸的O-选择性芳基化反应,合成了一系列吡啶基醚衍生物。同时,该策略是对SNAr或交叉偶联常规方法的重要补充。此外,通过对Ki6783和氟吡酰草胺(picolinafen)的简明合成以及卡博替尼(cabozantib)和戈伐替尼(golvatinib)的形式合成,进一步证明了反应的实用性。计算研究表明,O-芳基化是通过5-元过渡态的协同方式进行。O-芳基化的动力学控制的区域选择性(与之前Bi(V)-介导吡啶酮的N-芳基化相反),主要归因于双环骨架施加的几何约束(geometric constraints)。文章链接DOI:10.1002/anie.202212873
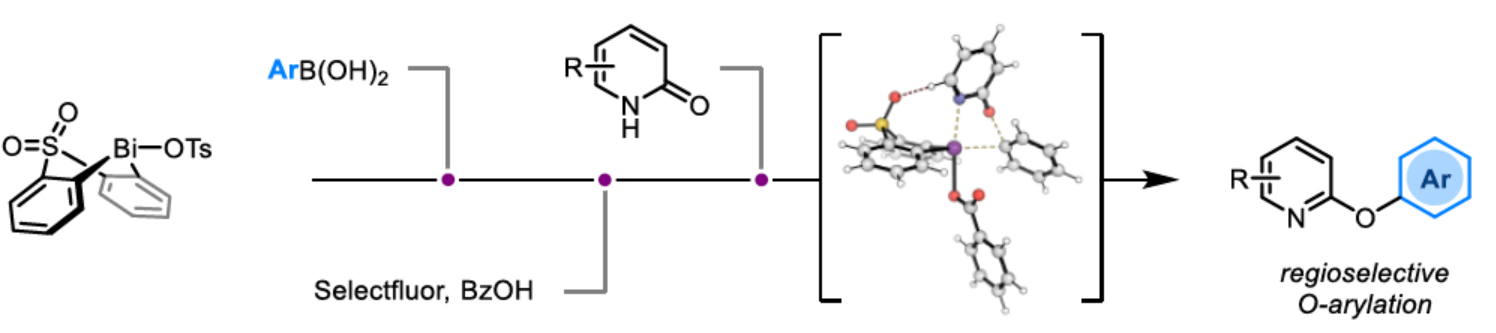
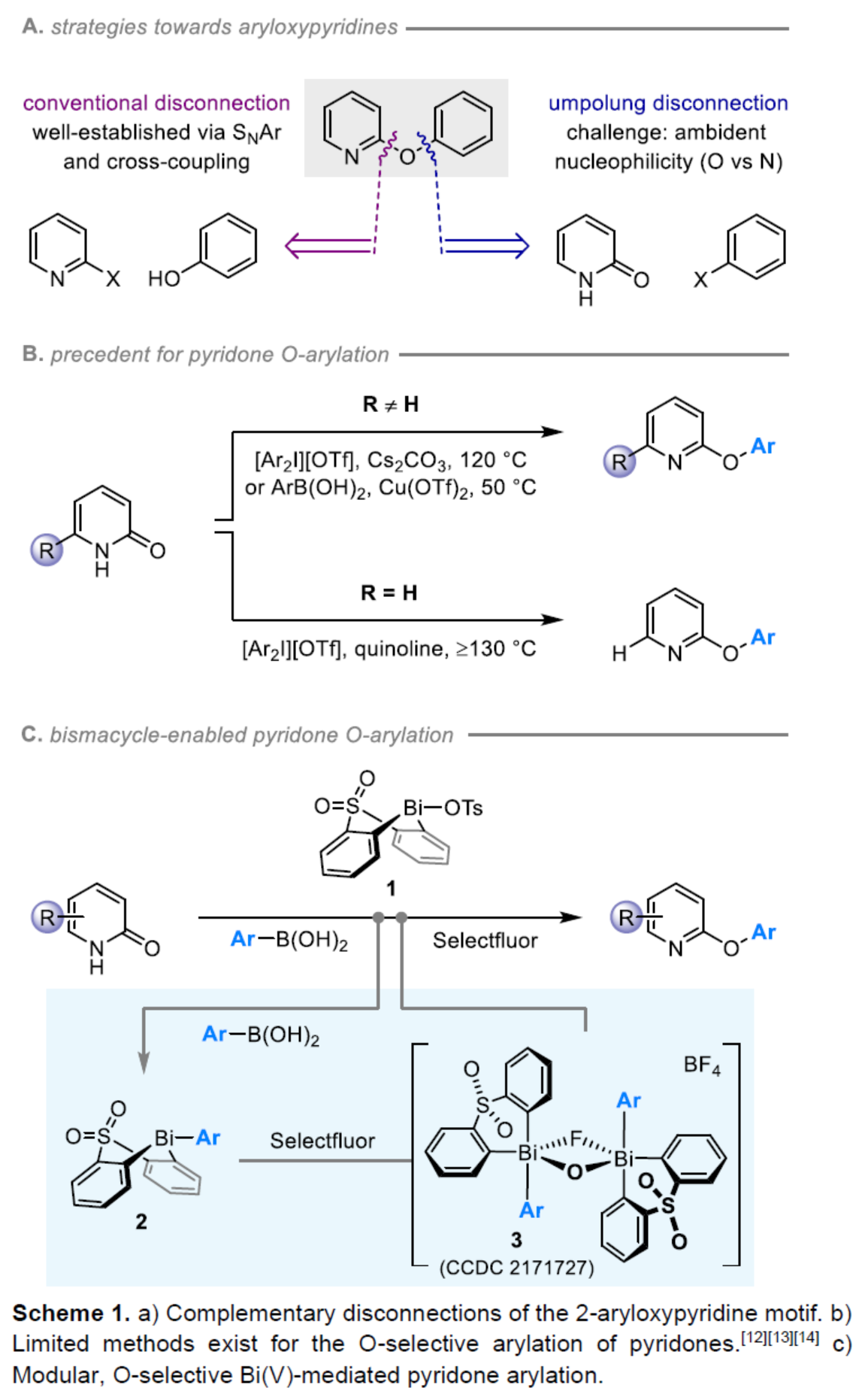
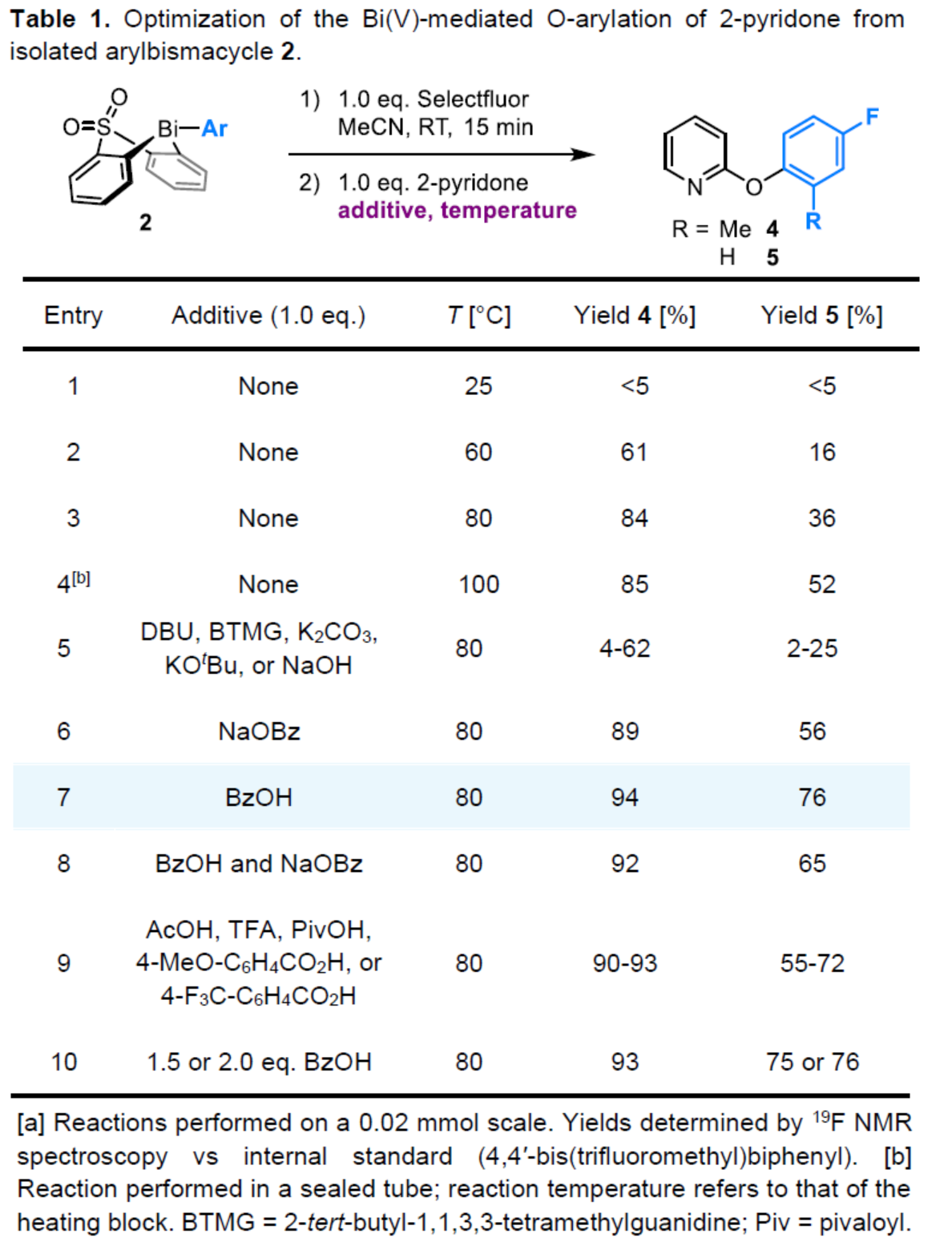
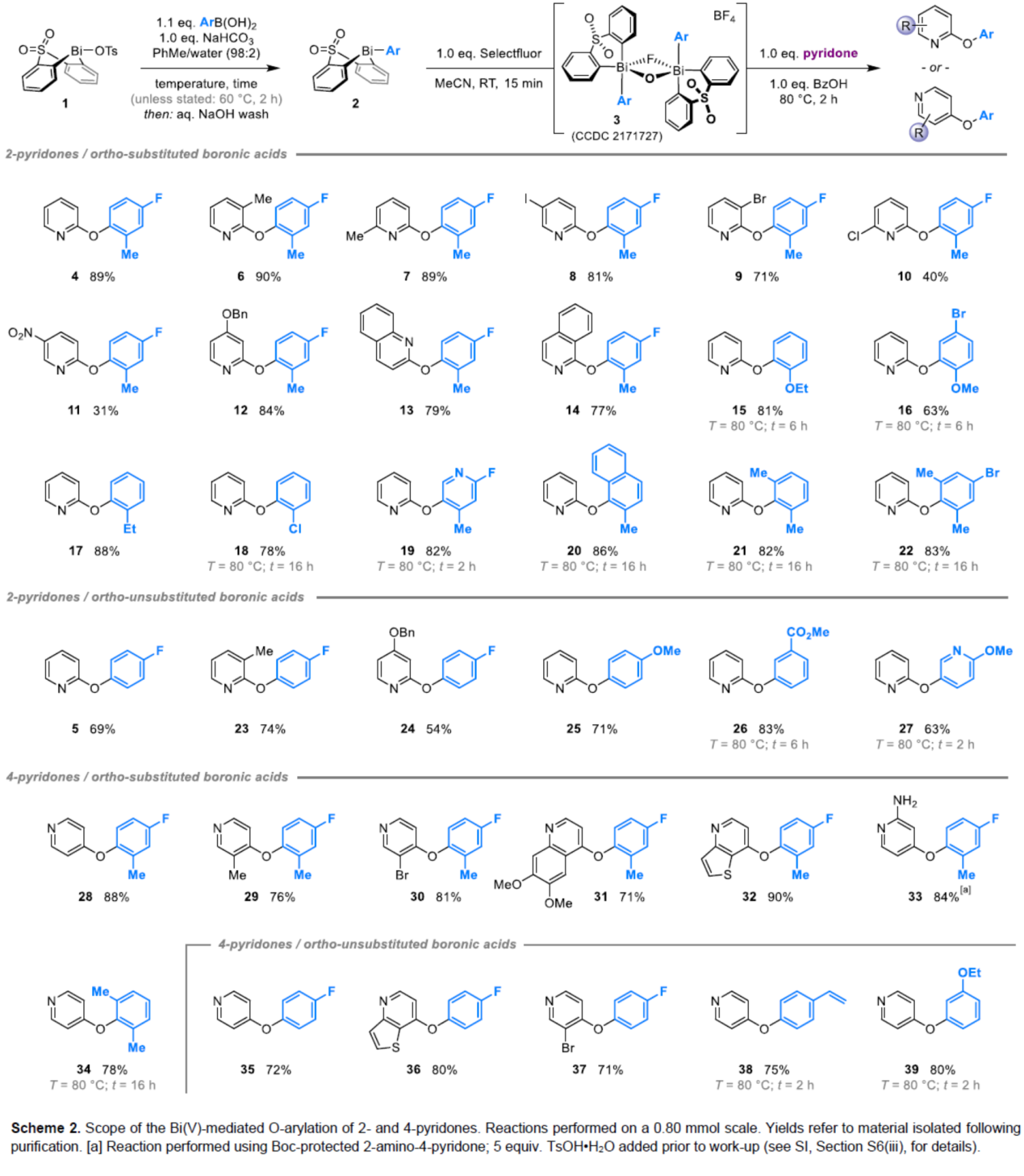
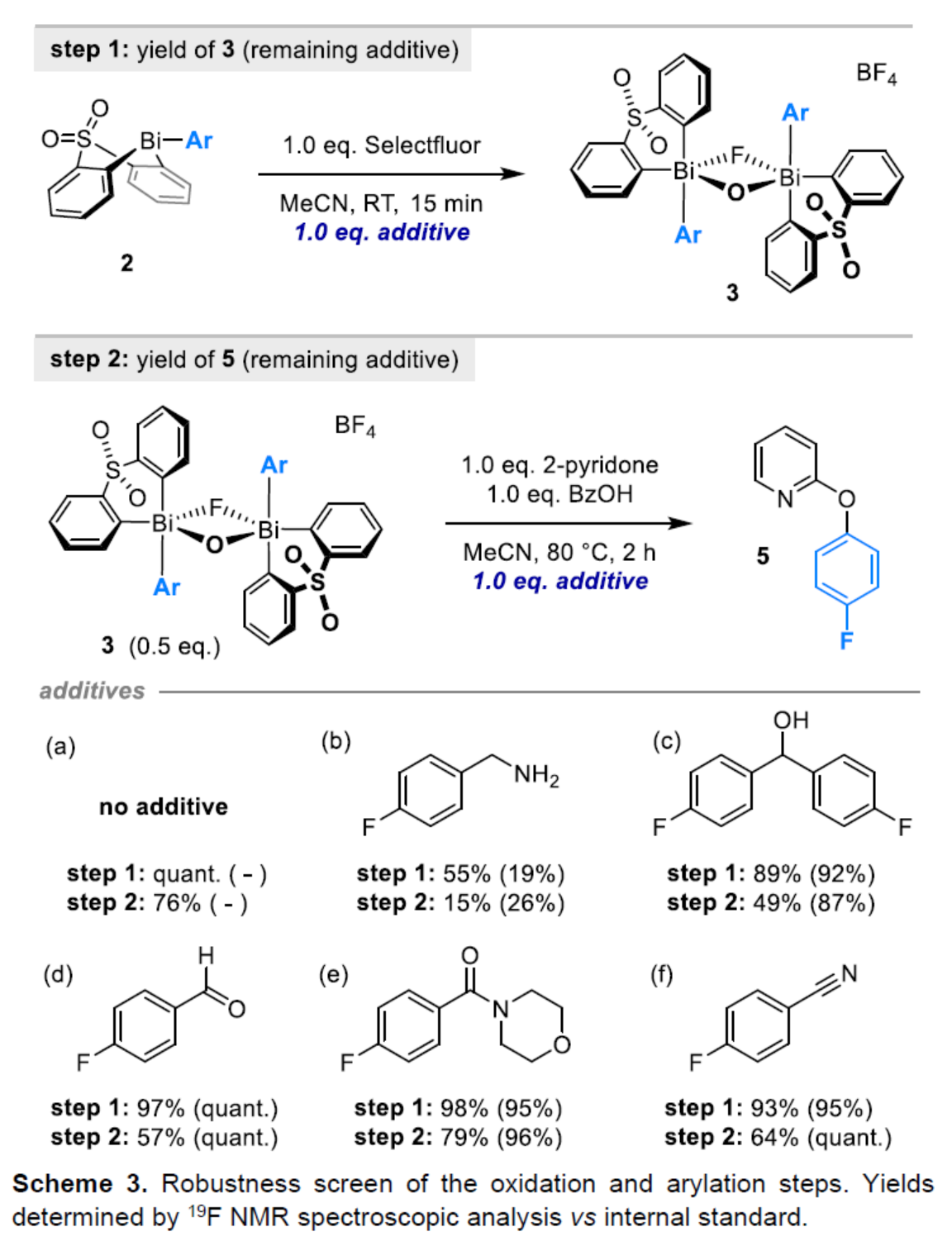
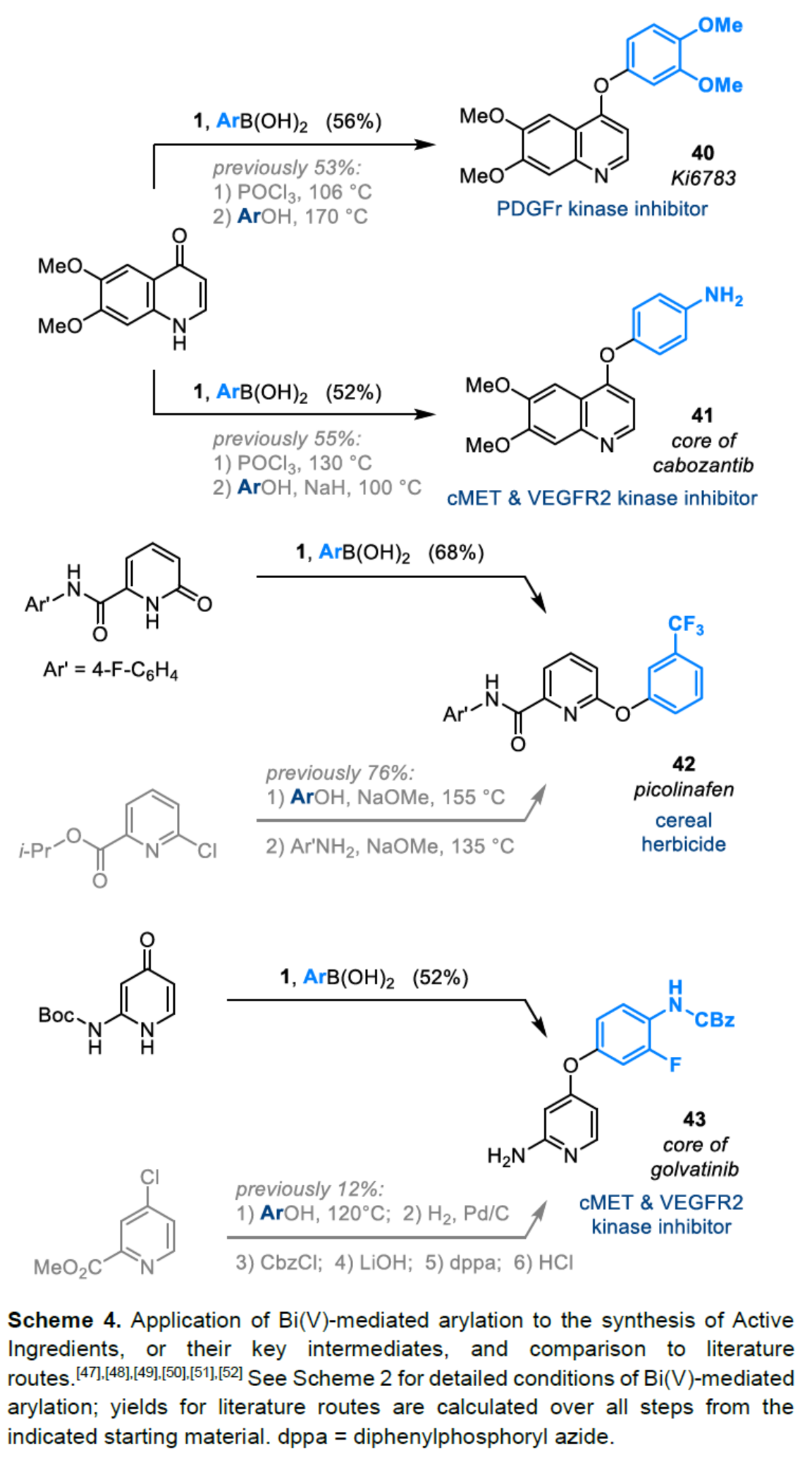
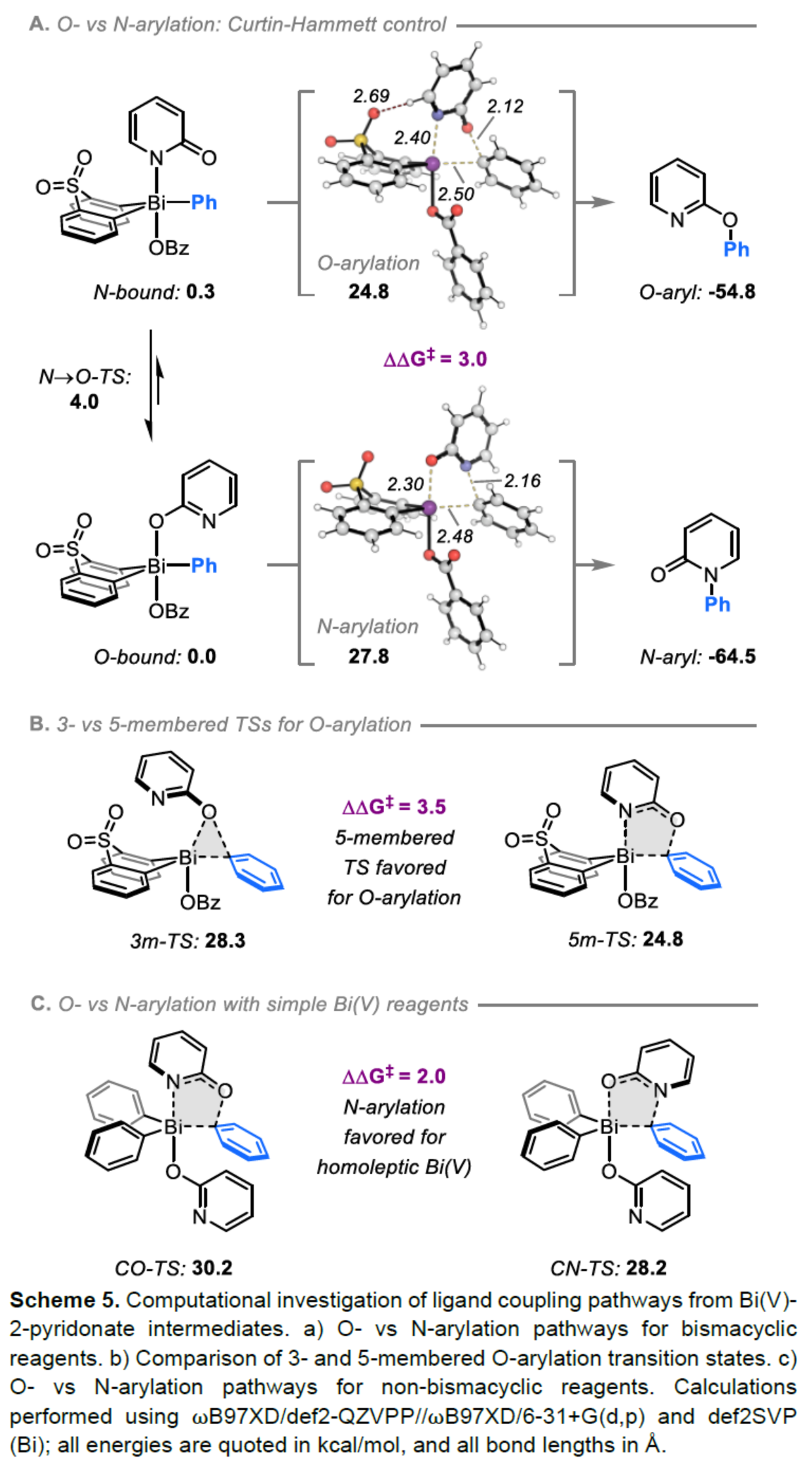
(图片来源:Angew. Chem. Int. Ed.)2-和4-芳氧基吡啶(aryloxypyridine)单元广泛存在于各种药物和农用化学品中,在过去十年中已批准的酪氨酸激酶抑制剂中有6种都含有2-和4-芳氧基吡啶(aryloxypyridine)单元。目前,SNAr反应是合成芳氧基吡啶的一种成熟的方法,但存在反应条件苟刻以及底物仅限于对缺电子吡啶和富电子苯酚。虽然交叉偶联反应可进一步扩展底物的范围,但对于C-O偶联的研究却相对较少。并且SNAr和交叉偶联反应的区域选择性对于聚卤代吡啶(polyhalopyridines)是不可预测或不可控制的(Scheme 1A,left)。此外,吡啶酮的O-芳基化反应是另一种有效的策略(Scheme 1A,right)。然而,由于吡啶酮的双亲核性,导致O-和N-芳基化反应具有竞争性,从而使该方法具有挑战。虽然化学家们已对吡啶酮的烷基化的区域选择性进行了深入的研究,但对于吡啶酮的芳基化仍有待进一步的探索。2-和4-吡啶酮的N-芳基化可使用基于I(III)-或Bi(V)-亲电芳基化试剂选择性地实现,通过与芳基卤化物、芳基硼酸或三芳基铋(III)试剂进行的铜催化偶联反应,或通过与适当活化芳基卤化物的SNAr反应。相比之下,O-芳基化反应的选择性则更具挑战(Scheme 1B)。例如,二芳基碘鎓盐或Chan-Lam偶联试剂通常获得N-芳基化的2-吡啶酮作为主要产物,只有当吡啶酮的6-位被取代时,才有利于O-芳基化反应。事实上,目前只有一种方法可用于2-吡啶酮的O-芳基化反应,该方法不具有6-取代基,但需高温(130-140 oC)。对于4-吡啶酮的O-选择性芳基化反应,仍有待进一步的研究。近日,英国诺丁汉大学Liam T. Ball与美国科罗拉多州大学Robert S. Paton团队报道了一种砜桥联的双环促进的2-/4-吡啶酮与芳基硼酸的O-选择性芳基化反应,合成了一系列吡啶基醚衍生物(Scheme 1C)。同时,该反应具有底物范围广泛、区域选择性高、反应条件温和、原子经济性高等特点。(图片来源:Angew. Chem. Int. Ed.)首先,作者以2与2-吡啶酮作为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:当以Selectfluor作为氧化剂,底物2先在MeCN溶剂中室温反应15 min。随后,以BzOH作为添加剂,上述的中间体可与2-吡啶酮在80 oC反应2 h,可以94%的收率得到产物4或以76%的收率得到产物5。(图片来源:Angew. Chem. Int. Ed.)在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 2)。首先,具有不同电性取代的2-吡啶酮与喹啉酮,均可与2-甲基-4-氟苯硼酸顺利反应,获得相应的产物4-14,收率为31-90%。其中,含有-NO2与-Cl取代的吡啶酮底物,收率偏低,如10和11。一系列邻位取代的苯硼酸、萘基硼酸以及吡啶硼酸,均可与2-吡啶酮顺利反应,获得相应的产物15-22,收率为63-88%。其次,一系列非邻位取代的苯硼酸与吡啶硼酸,也可与2-吡啶酮衍生物反应,获得相应的产物5和23-27,收率为54-83%。此外,4-吡啶酮衍生物也可与一系列邻位取代的苯硼酸反应,获得相应的产物28-34,收率为71-90%。4-吡啶酮衍生物还可与非邻位取代的苯硼酸反应,获得相应的产物35-39,收率为71-80%。(图片来源:Angew. Chem. Int. Ed.)紧接着,作者对氧化和芳基化步骤进行了Robustness筛选(Scheme 3)。研究表明,伯胺在氧化与芳基化过程中均不相容。二级苄醇,可耐受氧化条件,但不耐受芳基化条件。这种反应性的差异可反映在每种情况下形成的Bi(V)中心的不同形态。同时,苯甲醛、酰胺和腈衍生物在氧化与芳基化过程均可兼容。(图片来源:Angew. Chem. Int. Ed.)紧接着,作者对反应的实用性进行了研究(Scheme 4)。首先,通过该策略可以56%的收率得到Ki6783(40)和以52%的收率得到卡博替尼(41,cabozantib)的核心骨架,避免了原始文献中连续的氯代脱氧化以及高温SNAr的过程。其次,通过该策略可以68%的收率得到除草剂氟吡酰草胺(42,picolinafen),避免了在苛刻条件下进行的SNAr醚化和酰胺化反应。此外,通过该策略可以52%的收率得到戈伐替尼(43,golvatinib)的核心骨架,避免了文献中的6步合成过程。(图片来源:Angew. Chem. Int. Ed.)最后,作者对反应机理进行了相关的计算研究(Scheme 5)。首先,通过对比O-与N-芳基化的路径发现,在不可逆芳基化步骤中确定了区域选择性,并且O-芳基化在动力学上是有利的(Scheme 5A)。其次,通过对比3-和5-元O-芳基化过渡态发现,5-元过渡态有利于O-芳基化过程(Scheme 5B)。此外,使用简单的Bi(V)试剂进行O-与N-芳基化的对比发现,N-芳基化偏向于均配型Bi(V)试剂(Scheme 5C)。(图片来源:Angew. Chem. Int. Ed.)英国诺丁汉大学Liam T. Ball与美国科罗拉多州大学Robert S. Paton团队报道了一种Bi(V)-介导2-/4-吡啶酮与芳基硼酸的O-选择性芳基化反应,合成了一系列吡啶基醚衍生物。同时,该策略是对SNAr或交叉偶联常规方法的重要补充。此外,通过对Ki6783和氟吡酰草胺(picolinafen)的简明合成以及卡博替尼(cabozantib)和戈伐替尼(golvatinib)的形式合成,进一步证明了反应的实用性。机理研究表明,O-芳基化是通过5-元过渡态的协同方式进行。O-芳基化的区域选择性控制,主要归因于双环骨架施加的几何约束(geometric constraints)。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn