

(图片来源:Angew. Chem. Int. Ed.)
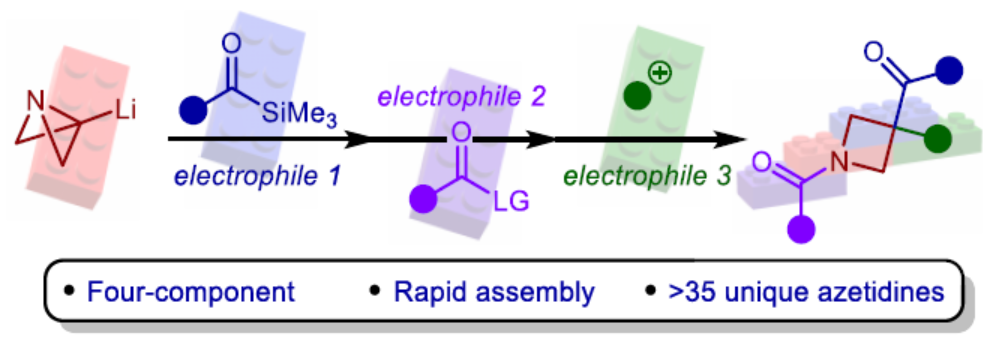
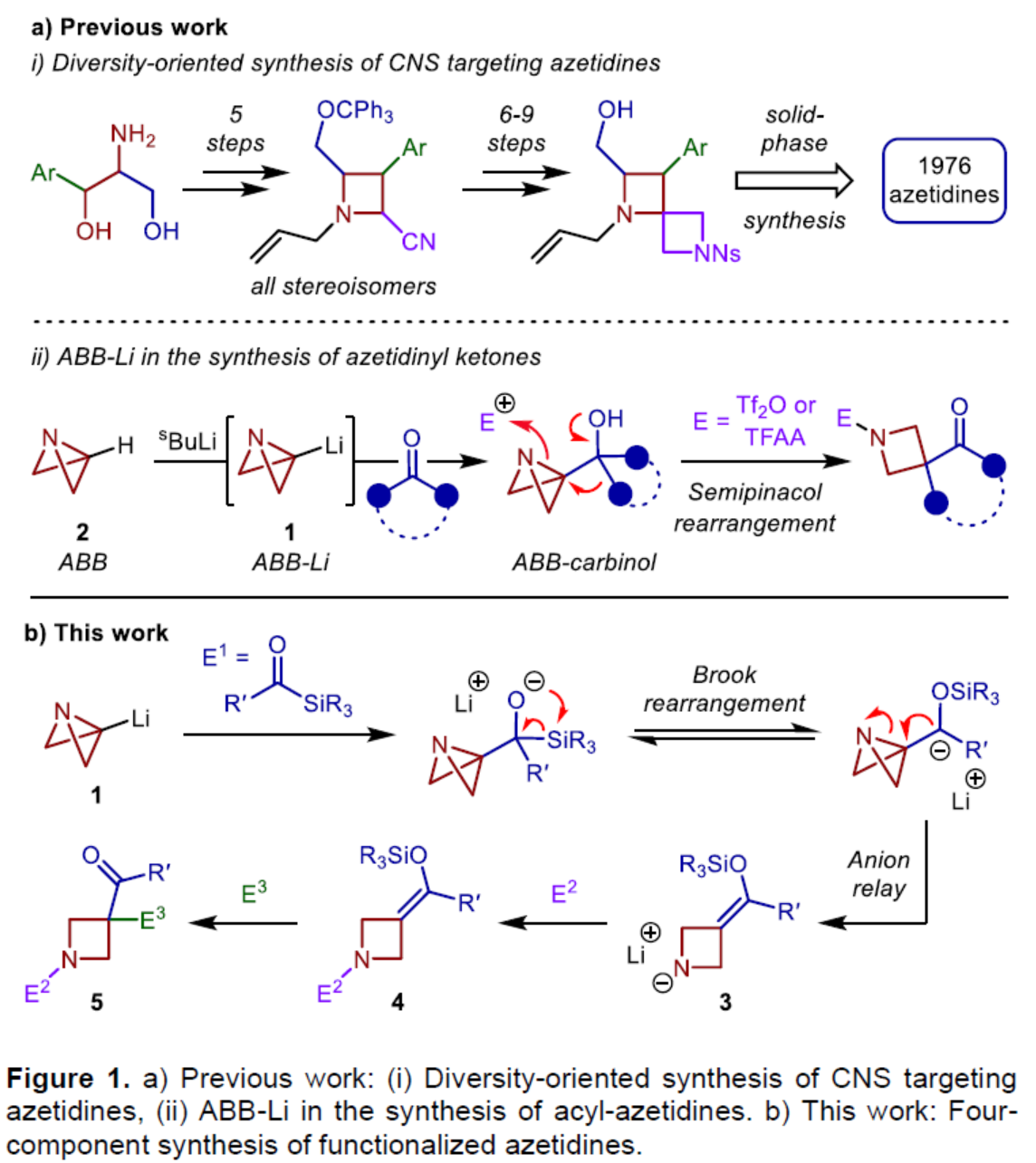
饱和N-杂环化合物是药物化学中最重要的组成部分之一,例如广泛存在于药物中的哌啶、哌嗪和吡咯烷环结构单元。同时,类似的四元N-杂环(氮杂环丁烷)具有一系列理想的特征,如结构刚性、改善的溶解度和对代谢降解的抵抗力,与较大的环类似物相比,这大大提高了临床成功的机会。虽然氮杂环丁烷单元在药物化合物上具有一定的价值,但对于氮杂环丁烷衍生物的模块化和发散性合成方法仍有待进一步的研究。2012年,Marcaurelle课题组报道了一种以β-氨基醇为底物,经5步反应,实现了氮杂环丁烷衍生物的合成,随后通过进一步的反应(6-9步),构建了螺环骨架(Figure 1ai)。前期,Aggarwal课题组开发了一种以ABB(2)为底物,通过去质子化过程,可生成ABB-Li(1)。1与酮化合物经偶联,可生成杂双环[1.1.0]丁基卡宾,随后经张力释放驱动的半频哪醇重排,可获得酰基-氮杂环丁烷(Figure 1aii)。虽然此策略代表了一种模块化的合成方法,但亲电试剂的种类取决于其活化氮杂双环的能力,使得酮化合物的选择成为唯一的变化点。
为了进一步扩展反应的范围,Aggarwal课题组设想了一种多组分的方法,通过利用ABB-Li与酰基硅烷偶联的反应性来合成多种1,3,3-三取代氮杂环丁烷衍生物(Figure 1b)。由1,2-加成生成的醇盐中间体经历[1,2]-Brook重排,生成碳负离子,该碳负离子应立即裂解(collapse),以打开氮杂双环[1.1.0]丁烷(ABB)单元的中心键。同时,根据Anderson和Duarte课题组的最近研究成果,开环具有低动力学能垒和强热力学驱动力,有利于氮杂环丁烷产物的生成。阴离子接力也应推动Brook重排向碳负离子的平衡,而在传统上需要阴离子稳定基团的存在。然后,酰胺锂3有可能在氮原子处与亲电试剂(E2)反应,并在新引入的硅基烯醇醚处与另一种基于碳或杂原子的亲电试剂(E3)反应,从而得到氮杂环丁烷(5)。近日,英国布里斯托大学Varinder K. Aggarwal课题组报道了一种多组分[1,2]-Brook重排/张力释放驱动的阴离子接力串联的策略,并成功应用于取代氮杂环丁烷的模块化合成。
(图片来源:Angew. Chem. Int. Ed.)
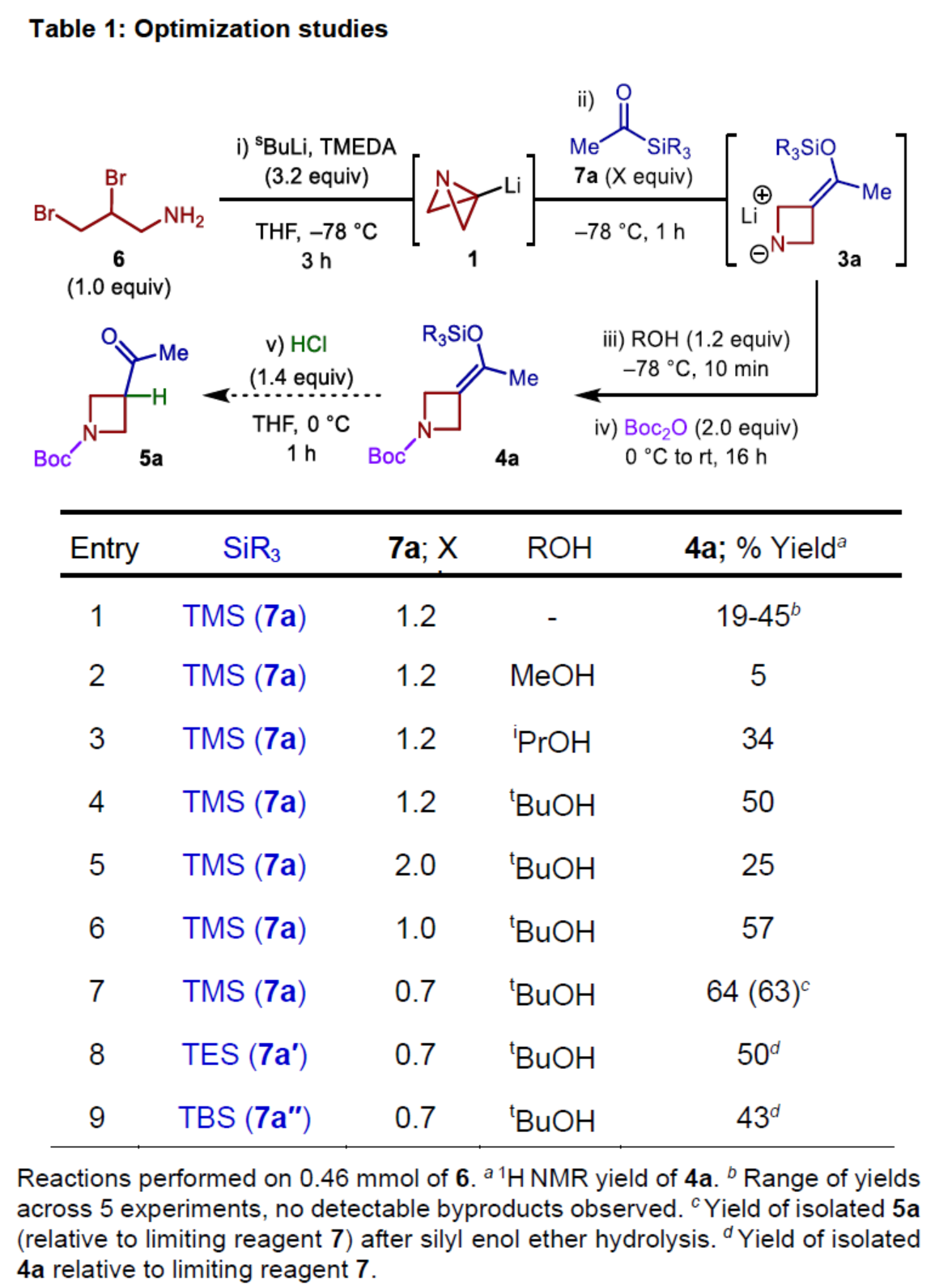
首先,作者以二溴胺衍生物6作为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:6在TMEDA/sBuLi条件下于THF溶剂中-78oC反应3 h,再加入7a继续于-78oC下反应1h。然后,加入ROH在-78 oC下继续反应10 min,再加入Boc2O在0 oC-室温下反应16 h,可以64%的收率得到氮杂环丁烷产物4a。
(图片来源:Angew. Chem. Int. Ed.)
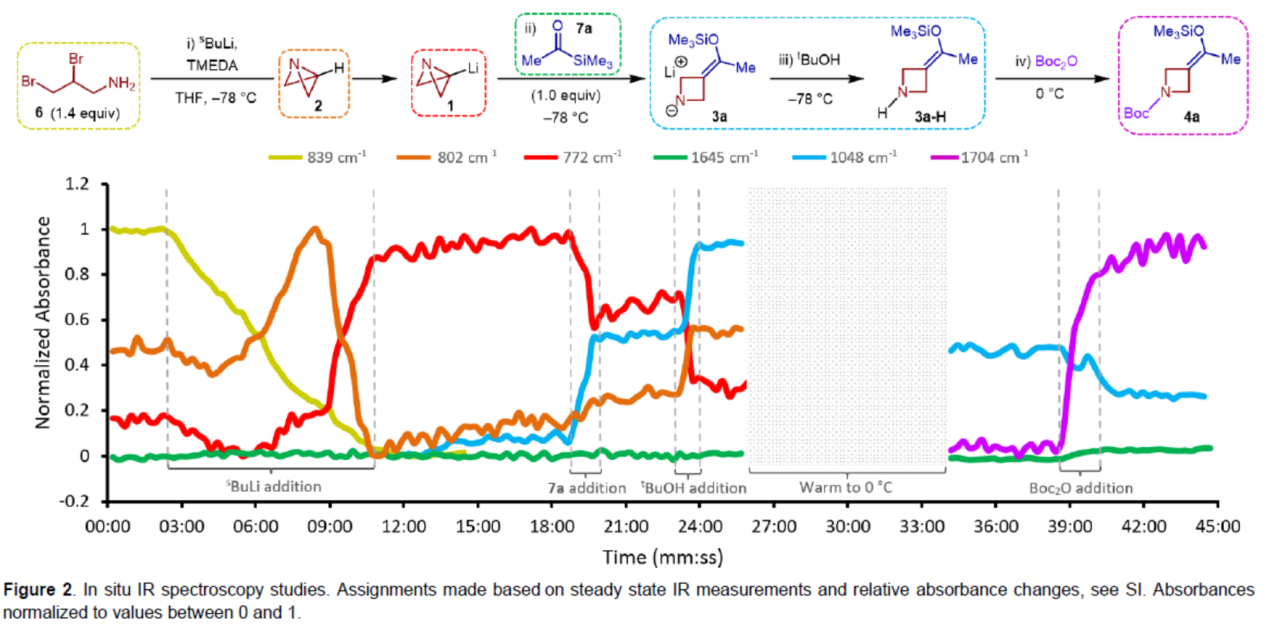
为了进一步了解反应的速率,作者进行了原位红外光谱法的研究(Figure 2)。首先,6与sBuLi反应可生成ABB-Li(1)。其中,在完全转化为1(772 cm-1)之前,6(839 cm-1)的消耗伴随着802 cm-1处(2)瞬态峰的出现。1(772 cm-1)的吸收表明,在加入酰基硅烷7a时,出现部分信号消失,同时在1048 cm-1处生成新的信号峰,归因于3a。有趣的是,7a反应如此迅速,以至于在实验的时间上没有观察到羰基伸缩峰(1645 cm-1)。一旦7a添加完成,就达到稳定状态,表明[1,2]-Brook重排/张力释放驱动的阴离子接力串联以及ABB的开环是一个几乎无障碍的过程。tBuOH的加入导致1048 cm-1的吸收强度增加,表明3a质子化形成3a-H,过量的1(772 cm-1)淬灭以再生2(802 cm-1)。在升温至0 oC(在此期间所有波数的相对吸收都受到固有影响)后,加入Boc2O,导致1048 cm-1处的峰强度降低。这与产物羰基伸缩峰(1704 cm-1)的增加同时发生,在3分钟内达到最大强度。综上所述,本研究清楚地证明了反应的快速性,表明了反应发生的总时间几乎完全取决于试剂的添加速率。
(图片来源:Angew. Chem. Int. Ed.)
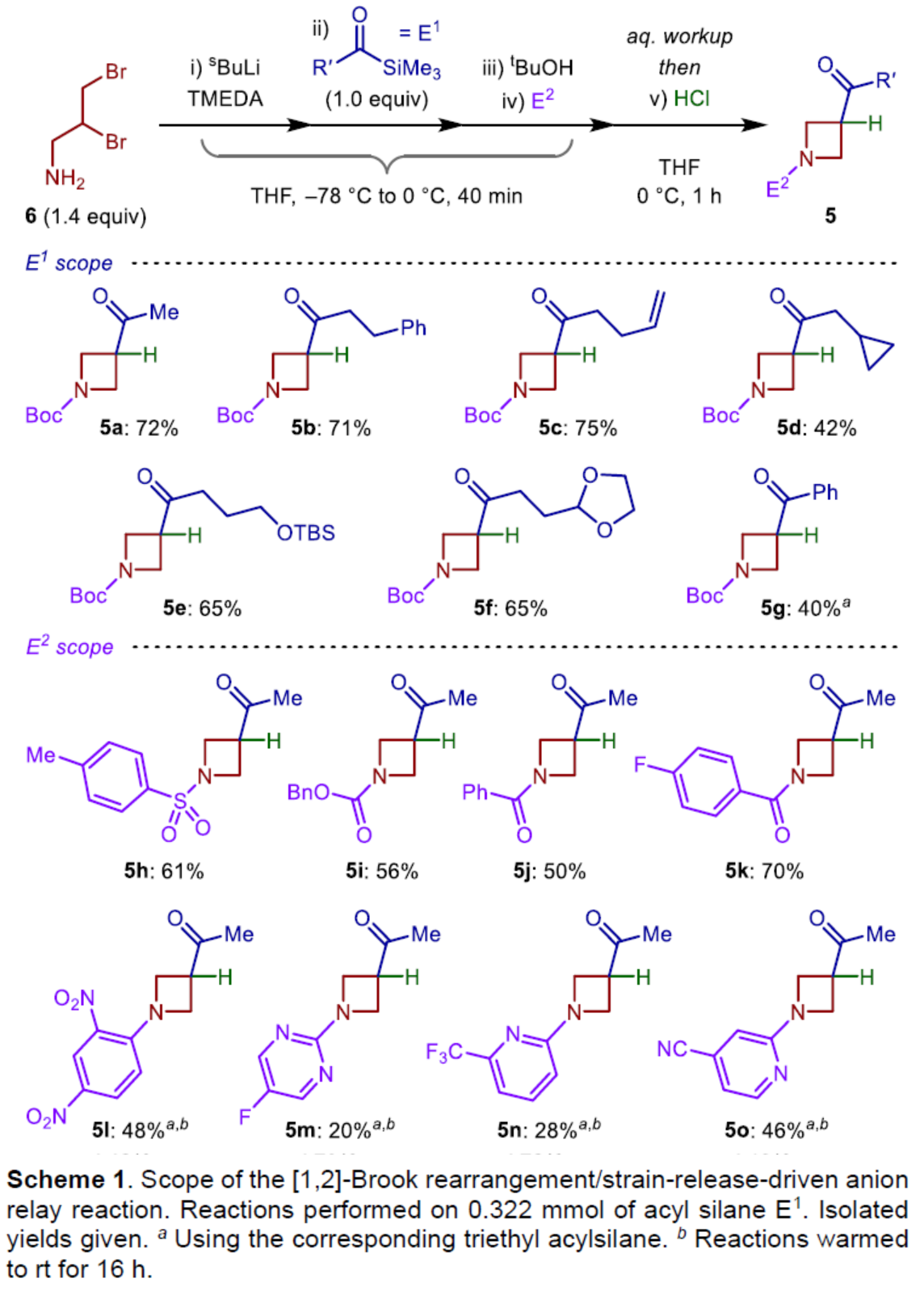
在获得上述最佳反应条件后,作者对E1和E2底物范围进行了扩展(Scheme 1)。首先,当底物E1中的R’为烷基与苯基时,均可顺利反应,获得相应的产物5a-5g,收率为40-75%。其次,当E2为TsCl、CbzCl、苯甲酰氯、芳基卤化物时,均与体系兼容,获得相应的产物5h-5o,收率为20-70%。
(图片来源:Angew. Chem. Int. Ed.)
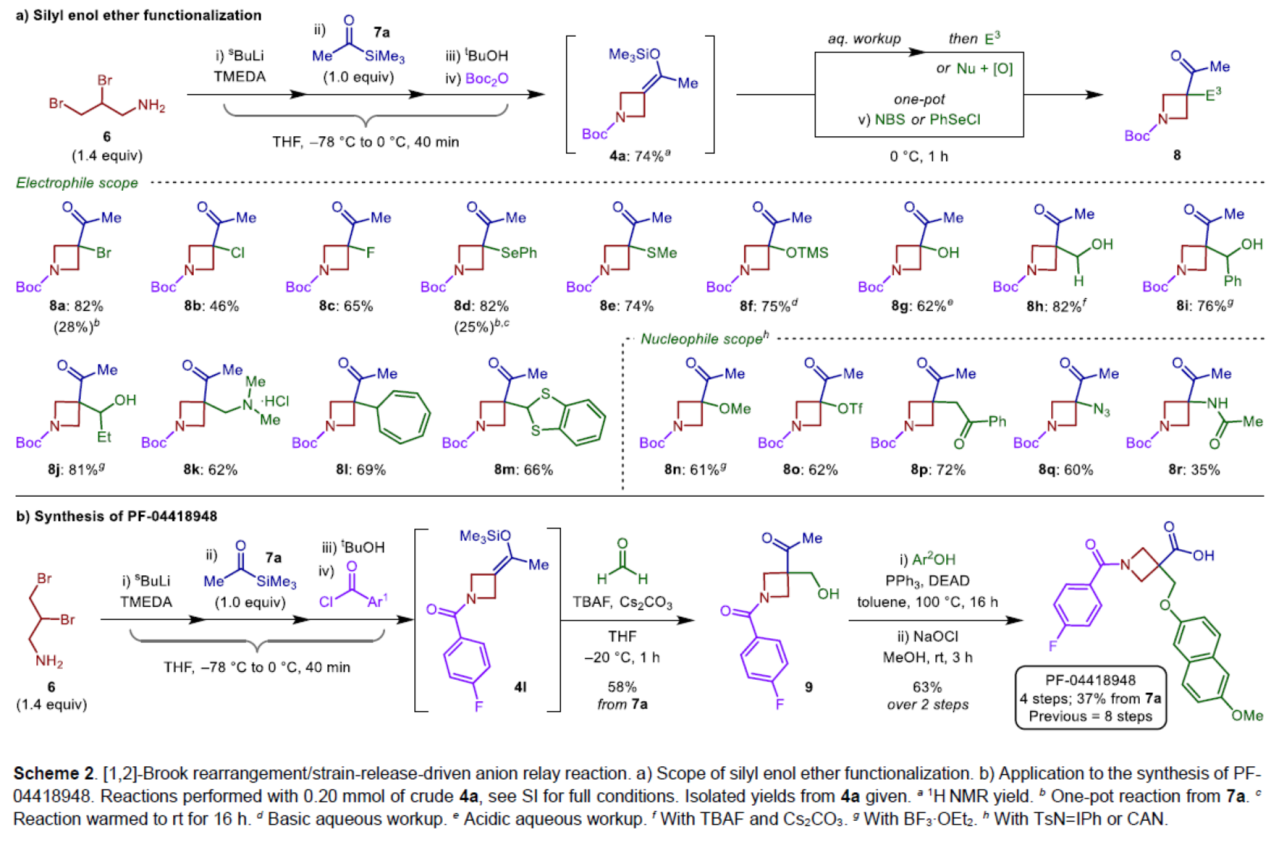
紧接着,作者对亲电与亲核试剂的底物范围进行了扩展(Scheme 2a)。首先,一系列不同取代的亲电试剂,均可顺利进行反应,获得相应的产物8a-8m,收率为46-82%。同时,该反应具有良好的官能团兼容性。其次,一系列不同的亲核试剂,也与体系兼容,得相应的产物8n-8r,收率为35-72%。
最后,作者通过对靶向口服活性和选择性EP2受体拮抗剂PF-04418948的合成,进一步证明了反应的实用性(Scheme 2b)。以二溴胺衍生物6为初始底物,在上述的四组分[1,2]-Brook重排/张力释放驱动的阴离子接力的串联过程后,可以58%的收率得到关键的氮杂环丁烷化合物9。9与6-甲氧基-2-萘酚进行Mitsunobu偶联反应,再通过卤化反应,可将甲基酮转化为相应的羧酸,经过4步反应(文献中需8步反应),总收率为37%,只需要2次色谱纯化。
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn