

(图片来源:J. Am. Chem. Soc.)
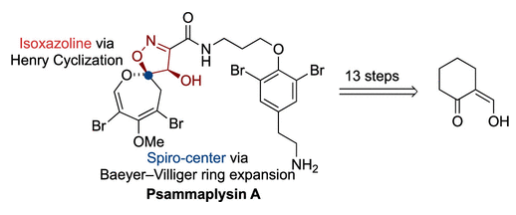
二氢噁庚英螺异噁唑啉(DOSI)类天然产物是一种结构独特的海洋生物碱,如Psammaplysins、Ceratinamides、Ceratinadins和Frondoplysins。在这其中,Psammaplysins是最大的一类(>35个成员),其展现出较强的抗癌、抗疟疾、抗艾滋病毒或抗生素活性。1982年,Kashman 等人首次从海洋海绵Psammaplysilla purpurea中分离得到Psammaplysins家族的第一个成员Psammaplysin A (1)(Scheme 1A)。由于Psammaplysin A (1)具有独特的生物学特性及其特殊的分子结构骨架,使得1成为了有机化学家们的重要合成靶标。然而,尽管Clardy课题组的早期研究以及近期Vanderwal 和杨震课题组的研究工作均实现了二氢噁庚英骨架的构建,但是DOSI天然产物的全合成还未实现。最近,奥地利因斯布鲁克大学Thomas Magauer课题组发展了一种DOSI类天然产物的通用合成策略并首次利用简单易得的起始原料通过13步实现了Psammaplysin A的全合成。
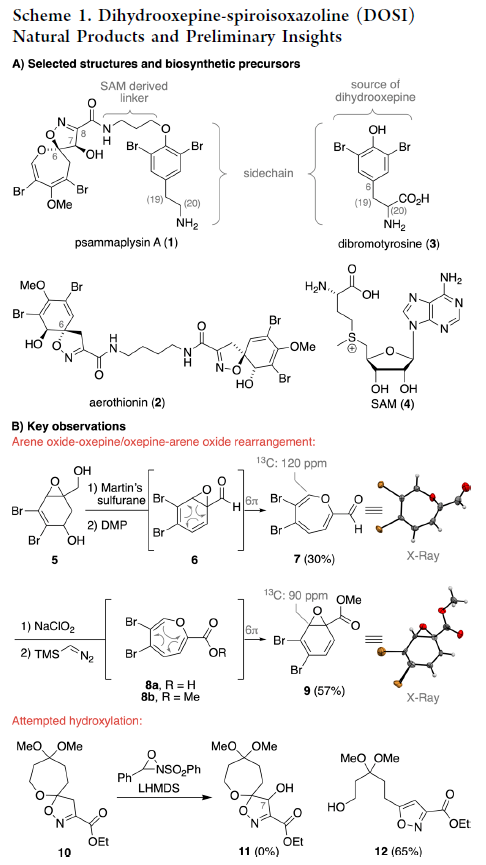
在初始研究中,作者发现两个关键点(Scheme 1B)。首先,由二醇经历脱水和氧化得到的醛6可以经历自发的重排过程以30%的产率得到噁庚英7。作者最初认为7可以作为有价值的前体实现Psammaplysin A (1)的合成。但是由于7极其不稳定,在储存过程中会发生缓慢分解得到一些不能确认的芳香副产物。而当作者尝试利用7合成8b时却仅观察到芳香氧化物9生成。其次,当作者尝试探索异噁唑啉10的羟基化过程时发现并未得到相应的羟基化产物11,仅以65%的产率得到异噁唑产物12。以上发现为Psammaplysin A的合成路线设计以及逆合成分析提供了重要的启发。
(图片来源:J. Am. Chem. Soc.)
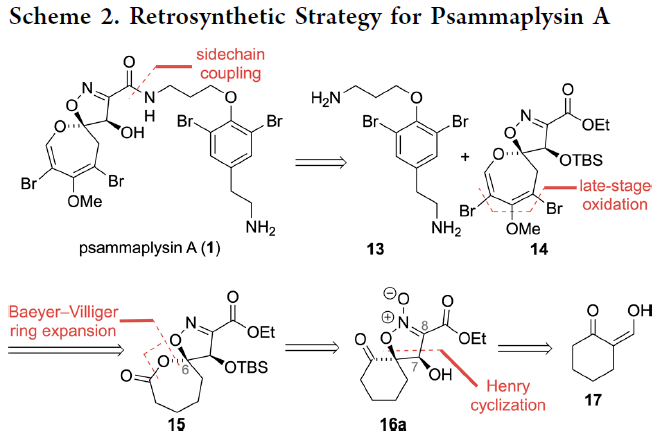
Psammaplysin A的逆合成分析如Scheme 2所示,作者认为其可以通过酰胺键的断裂分解成已知的胺片段13和DOSI骨架14。而DOSI骨架14则可以由15通过后期修饰得到。并且15可以通过16a发生Baeyer-Villiger氧化构建。16a则可以利用商业可得的2-(羟基亚甲基)环己酮17通过非对映选择性Henry反应/环化策略合成。
(图片来源:J. Am. Chem. Soc.)
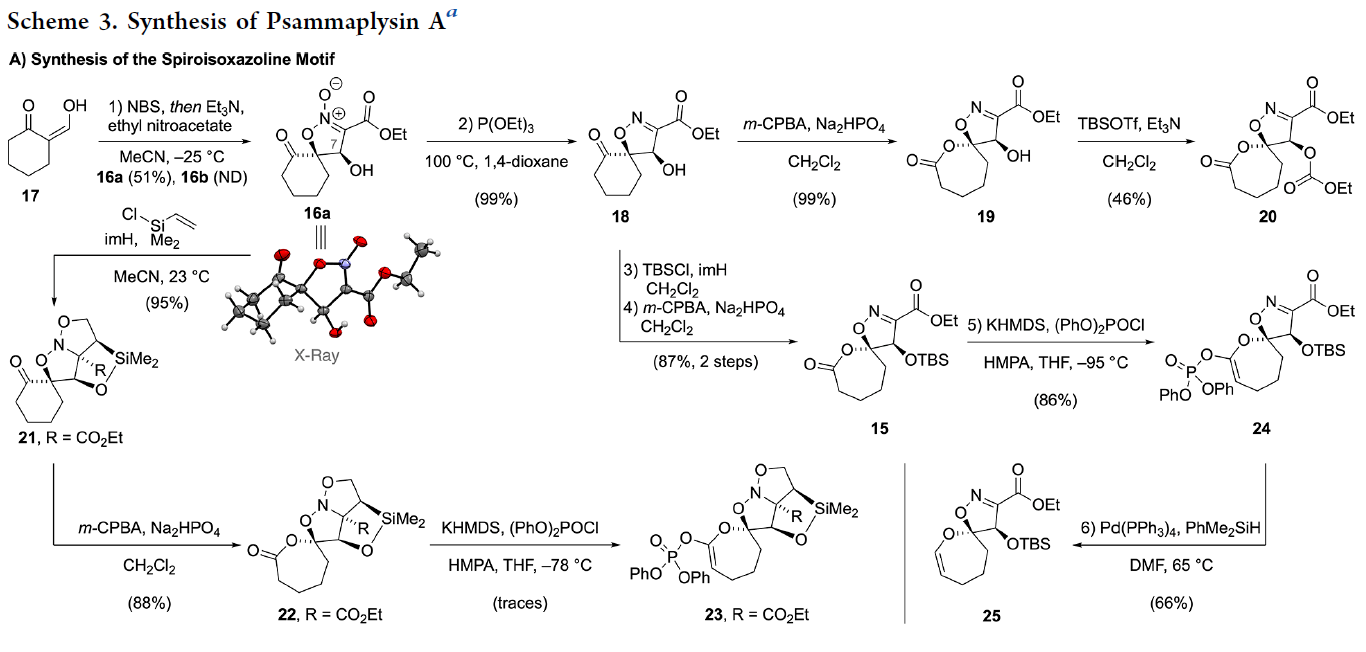
接下来,作者进行天然产物Psammaplysin A的全合成(Scheme 3)。首先,作者使用17通过NBS溴化得到α-溴化产物,随后作者发现产物对空气较敏感。于是作者通过一锅两步(1)NBS溴化;(2)硝基乙酸乙酯环化,直接以51%的分离实现了氮酸酯16a的合成,且16a的绝对构型通过单晶衍射得到确证。接下来,作者利用氮酸酯16a的脱氧过程以99%的产率实现了螺环异噁唑啉18的合成(Scheme 3A)。
在实现了4-羟基异噁唑啉骨架的合成后,作者探索通过Baeyer-Villiger氧化实现DOSI骨架的构建。首先,作者利用18与m-CPBA反应可以以定量的产率得到相应的内酯产物19。而当作者利用19与TBSOTf反应时并没有得到目标的硅醚产物,仅观察到了碳酸酯20的形成。于是作者变换思路,通过利用16a C7羟基的硅基化和分子内1,3-偶极环加成以95%的产率实现三环产物21的合成。利用此方法可以一步实现羟基的保护以及异噁唑啉骨架的构建。接下来,21通过Baeyer-Villiger氧化以88%的产率得到了内酯产物22(单一的区域异构体)。遗憾的是,当作者利用K.C. Nicolaou课题组报道的反应条件((PhO)2POCl, KHMDS, THF, HMPA, -78 °C)实现22到膦基产物23的转化时产率很低,可能是由于在分离过程中产物发生降解(Scheme 3A)。
基于上述原因,作者再次转变思路,并先对异噁唑啉18的羟基进行保护(imH, TBSCl)后,再利用Baeyer-Villiger氧化以两步87%的产率得到目标内酯产物15(6 g规模)。随后作者通过条件筛选,发现在-95 oC下缓慢加入KHMDS的THF溶液可以有效的促进原料的消耗,以86%的产率得到膦基产物24。接下来,作者通过钯催化的偶联反应,使用PhMe2SiH作还原剂以66%的产率得到烯醇化物25(Scheme 3A)。
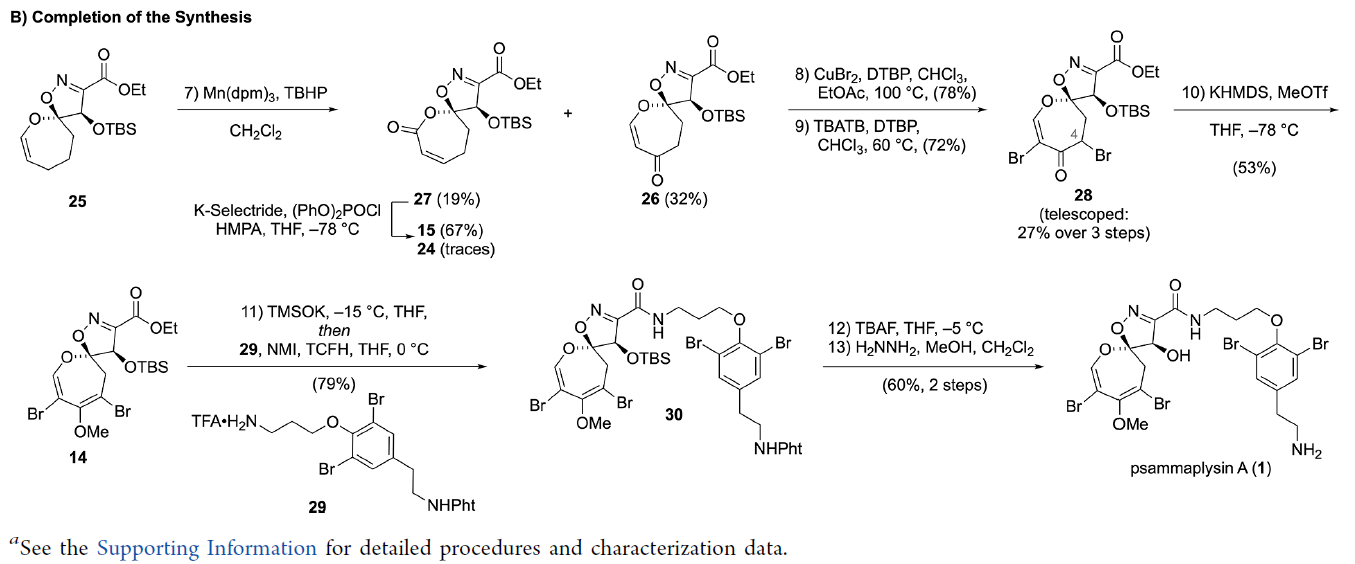
在规模化实现了DOSI骨架25的构建后,作者在TBHP和过渡金属结合的氧化条件下进行筛选。结果发现在大多数反应条件下得到目标烯基内酯26的同时会伴随着α,β-不饱和内酯27的生成。当使用Mn(dpm)3并缓慢滴加TBHP可以以32%分离收率得到26。而得到的非目标区域异构体产物27(19%)则可以成功的以67%的产率转化为内酯15。随后,26通过α-溴化(CuBr2,DTBP)以78%的产率得到C4溴化产物。接下来,利用TBATB和DTBP可以发生二次溴化以72%的产率得到烯基内酯产物28。此外,作者发现当从25至28的三步氧化过程在不经历中间体分离可以直接以三步27%的总产率实现28的合成。最后,作者利用28与KHMDS和MeOTf反应实现甲基化以53%的产率得到全取代的DOSI产物14。
接下来,作者以酪胺为起始原料,通过四步合成制备出保护的胺(moloka’iamine)29。并利用14在-15 oC下与TMSOK反应后直接加入29,可以一锅两步以79%的产率实现酰胺30的合成。最后,30经历两步脱保护(60%)得到最终产物Psammaplysin A。至此,作者利用简单易得的起始原料,通过13步高效实现了Psammaplysin A(1)的合成。
(图片来源:J. Am. Chem. Soc.)
总结 奥地利因斯布鲁克大学Thomas Magauer课题组在天然产物Psammaplysin A首次分离40年后首次实现了其全合成过程。使用Henry加成/O-烷基化代替腈氧化物的[3+2]环加成是这一策略成功的关键,使其可以一步实现全取代的C7羟基化杂环骨架的构建。对于七元环体系的构建,高效的Baeyer-Villiger氧化法被证明是最佳的方法,由此可以避免重排的发生。利用此方法可以实现一系列结构相关及深度结构修饰类似物的合成,从而促进其未来的生物活性研究。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn