

(图片来源:Nat. Chem.)
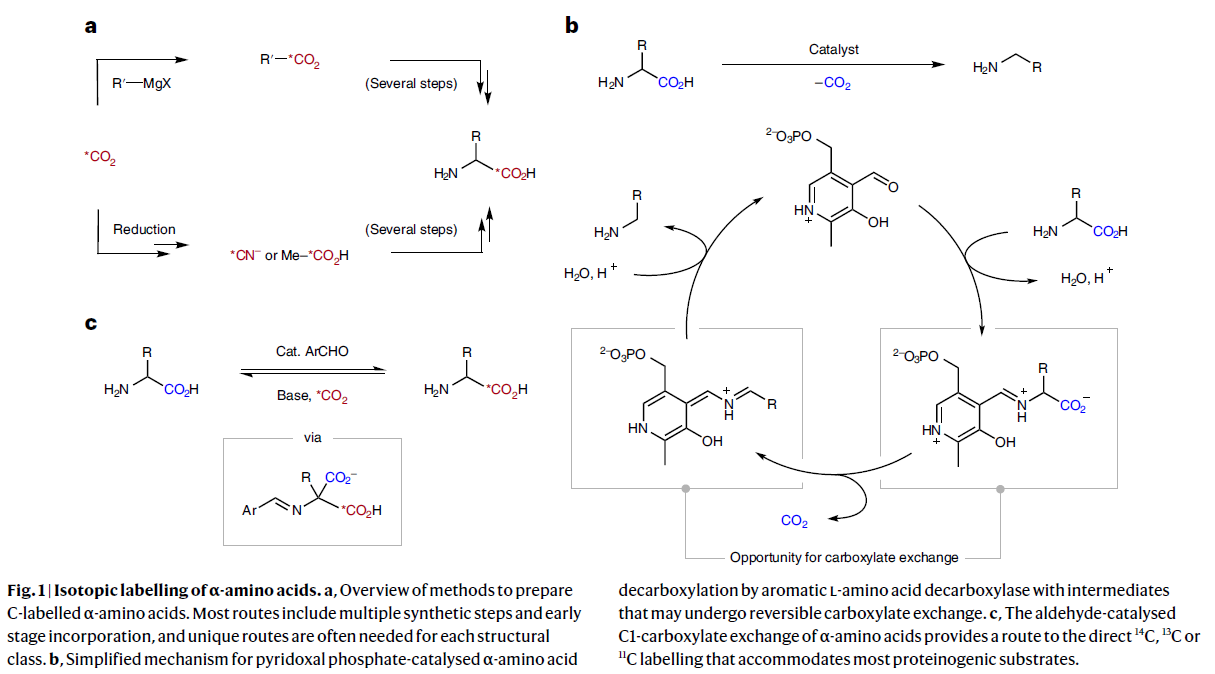
α-氨基酸是构成生命体的基本化学物质之一。同位素标记的α-氨基酸及其衍生物广泛应用于生物化学、定量蛋白质组学、吸收分布代谢和排泄(ADME)分析中。此外,其还可以作为正电子发射断层扫描(PET)技术的显像剂。因此,发展简洁高效的同位素标记方法来快速实现α-氨基酸的标记具有重要意义。而在同位素标记中,通常会更倾向于使用碳同位素标记而不是氢同位素(2H或3H),因为碳同位素不容易消除,也不会引起代谢转移。此外,碳同位素标记分子的固有结构也不会像18F标记那样发生改变。尽管经过了70多年的研究,含有碳同位素α-氨基酸的合成仍然具有很大的挑战性。其通常涉及将*C引入到分子前体中,然后进行多步合成来实现(Fig. 1a)。
二氧化碳是所有碳同位素标记试剂的主要来源。目前由于缺乏有效的*CO2捕获方法,因此现阶段很难在分子后期标记应用过程中使用*CO2来进行标记。
自然界通常利用脱羧酶来促使α-氨基酸释放CO2,其通过与磷酸吡哆醛缩合可以将氨基酸转化为希夫碱(亚胺)(Fig. 1b)。而利用小分子催化α-氨基酸的脱羧过程也是可以进行的,但其通常仅在高温(150 °C)下发生,因此制约了其与*CO2的羧基交换反应的发展。因此,发展在温和条件下,利用*CO2实现α-氨基酸的C1标记具有重要意义。
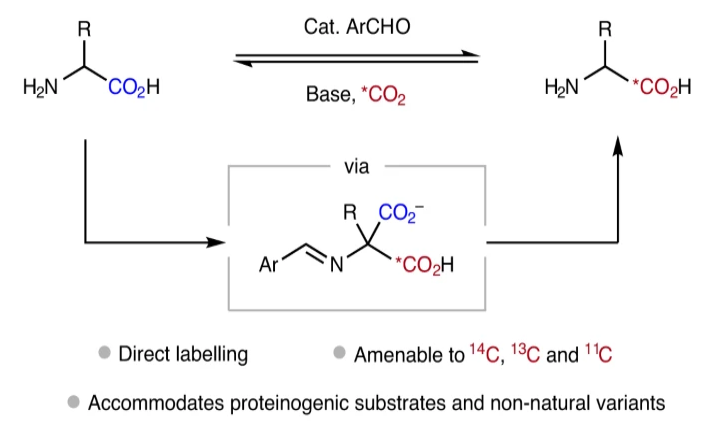
基于由α-氨基酸衍生的亚氨基羧酸会在D2O存在时倾向发生α-H/D交换过程,以及在多种情况下会发生可逆的脱羧过程。最近,加拿大渥太华大学(University of Ottawa)Benjamin H. Rotstein和阿尔伯塔大学(University of Alberta)Rylan J. Lundgren课题组发展了在简单的芳基醛催化下,利用*CO2实现了α-氨基酸的C1标记过程。反应对大多数蛋白质氨基酸以及非天然氨基酸底物均可兼容。值得注意的是,利用此方法可以有效实现14C,13C或11C的标记(Fig. 1c)。
(图片来源:Nat. Chem.)
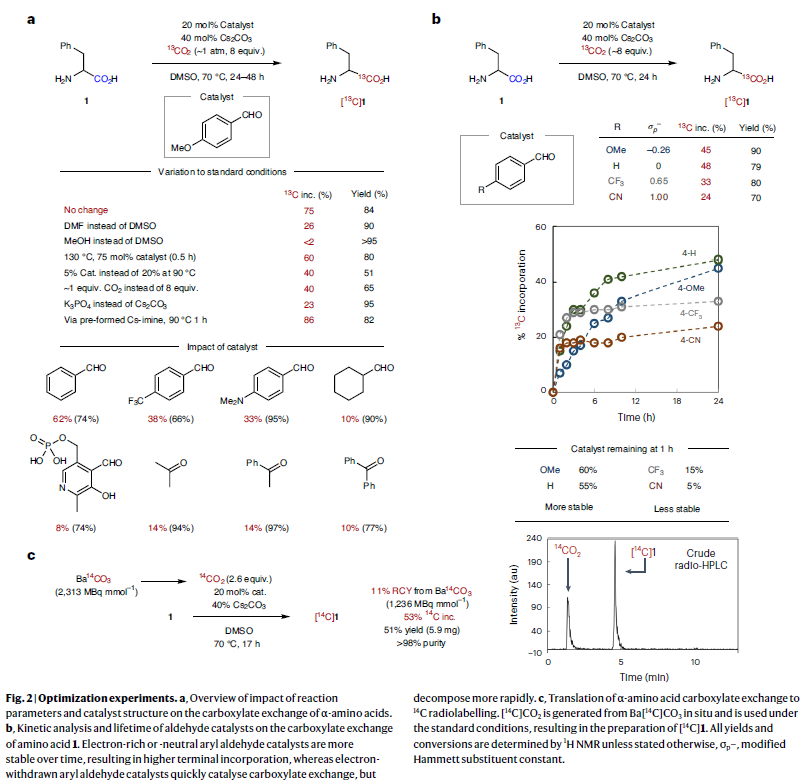
作者首先利用(±)-苯丙氨酸1作为模板底物进行反应尝试,通过对催化剂、溶剂、碱、温度等一系列参数进行筛选,作者发现当使用4-甲氧基苯甲醛(20 mol%),Cs2CO3(40 mol%),13CO2(1 atm,8 equiv),在DMSO中,70 ℃下反应24 h可以以84 %的分离产率实现13C标记的(±)-苯丙氨酸产物[13C]1的合成,且13C的标记比例可以达到75%(Fig. 2a)。此外,作者对不同醛催化剂实现氨基酸羧基交换过程进行动力学分析。实验结果表明富电子或中性的芳基醛催化剂随着时间的推移展现出更好的稳定性,从而可以更好的实现羧基交换过程,而缺电子芳基醛催化剂虽然可以快速催化羧基交换过程,但其分解更快(Fig. 2b)。
值得注意的是,作者利用此方法还可以实现14C标记过程,选用Ba[14C]CO3在标准条件下原位生成[14C]CO2,从而实现了14C标记的(±)-苯丙氨酸产物[14C]1的合成(Fig. 2c)。
(图片来源:Nat. Chem.)
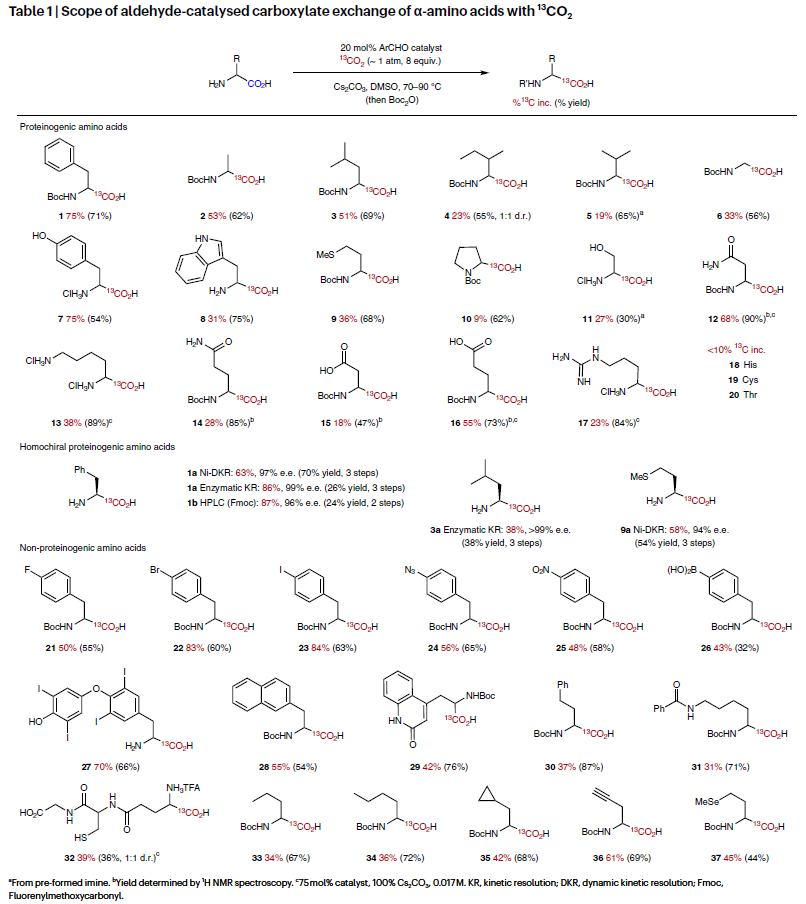
接下来,作者对此转化的底物范围进行了考察(Table 1)。整体来讲,利用此方法可以有效实现一系列蛋白质氨基酸以及非天然氨基酸的13C标记(1-37)。例如,烷基或芳基取代的α-氨基酸(苯丙氨酸,丙氨酸,亮氨酸,甘氨酸,酪氨酸,色氨酸,蛋氨酸)均可以以>50%的产率,31-75% 13C-标记率实现13C标记产物的合成(1-3, 6-9)。具有酸性或碱性侧链取代的底物同样可以顺利实现转化,以23-68%的13C-标记率实现产物(12-14, 16-17)的合成。值得注意的是,利用此方法可以方便的实现药物ADME研究过程中同位素分子的合成。此外,该反应具有良好的官能团兼容性,包括卤素(21-23),叠氮基(24),硝基(25),硼酸(26)等官能团均可兼容,且芳基卤化物的兼容性为后续的官能团转化提供了多种可能性。
(图片来源:Nat. Chem.)
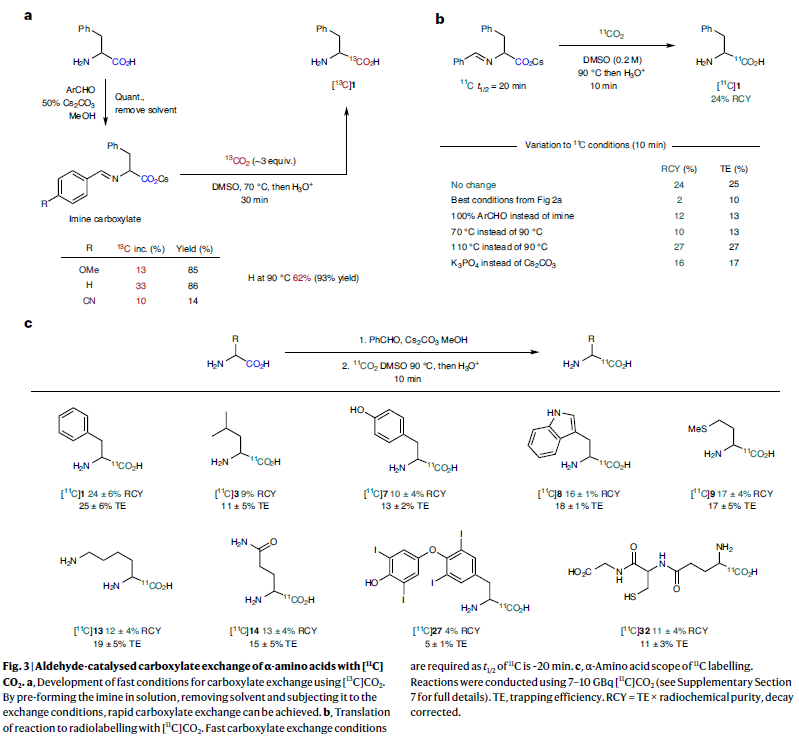
接下来,作者通过稍微改变反应条件,可以利用此策略,通过使用[11C]CO2直接实现α-氨基酸的11C标记(Fig. 3)。由于11C原子的半衰期仅为20分钟,因此需要在合成过程中事先生成亚胺羧酸盐来实现11C的同位素标记过程。利用此方法可以有效实现烷基、芳基以及含有极性侧链取代的α-氨基酸((±)酪氨酸,
色氨酸,亮氨酸,蛋氨酸,赖氨酸和谷氨酰胺,以及(±)-甲状腺素和谷胱甘肽)的11C标记过程。
(图片来源:Nat. Chem.)
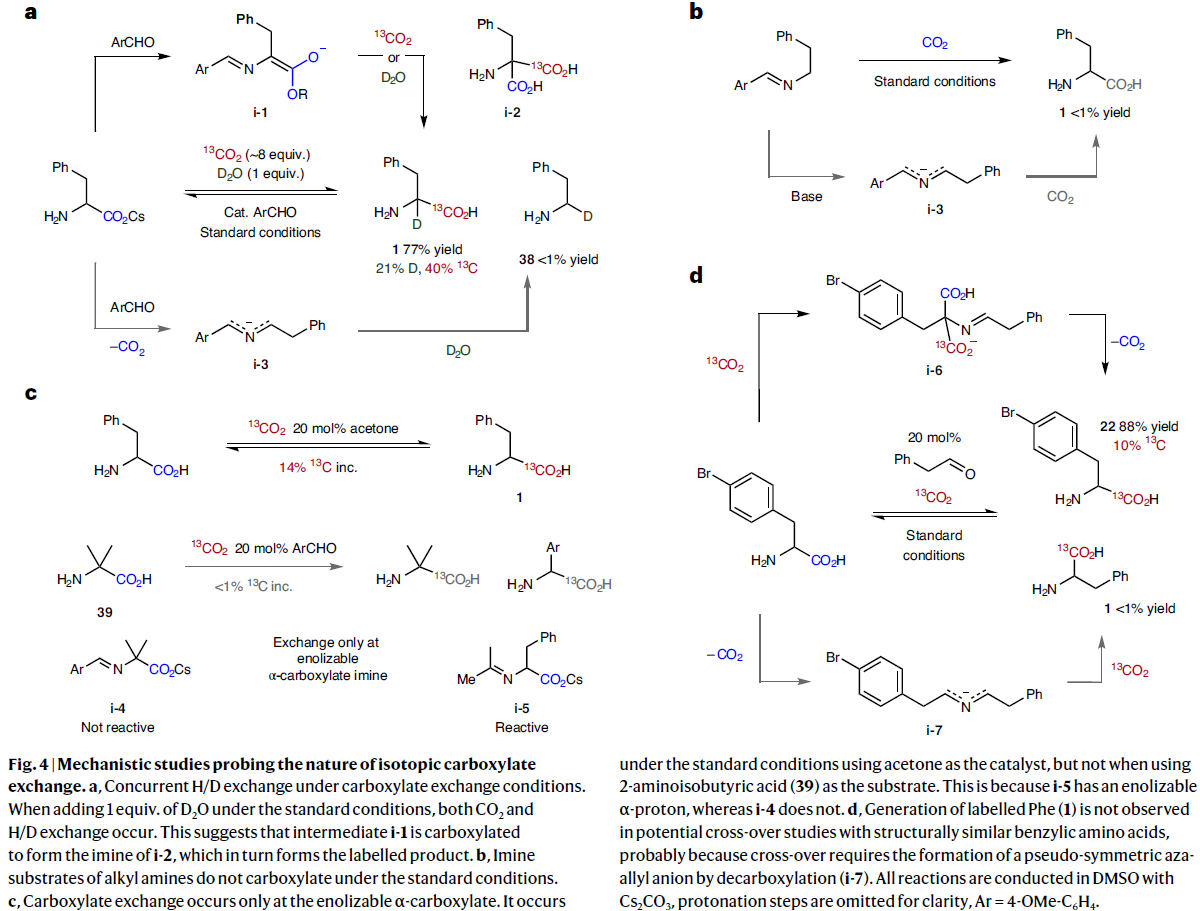
为了深入理解反应机理,作者进行了一系列控制实验(Fig. 4)。首先,作者在H/D交换与羧基交换共存的条件下发现两个过程均可发生。由此表明中间体i-1通过羧基化形成i-2的亚胺结构,而i-2则会形成标记产物(Fig. 4a)。随后,作者发现烷基胺的亚胺底物在标准条件下是不能发生羧酸化过程的(Fig. 4b)。接下来,作者证实了羧酸的交换只能在可烯醇化的α-羧酸上发生(Fig. 4c)。最后,作者在4-溴苯丙氨酸22与苯乙醛缩合后的羧基交换过程中观察到了[13C]22而未观察到1。由此表明反应中形成了丙二酸盐中间体i-6而非氮杂烯丙基中间体i-7(Fig. 4d)。
(图片来源:Nat. Chem.)
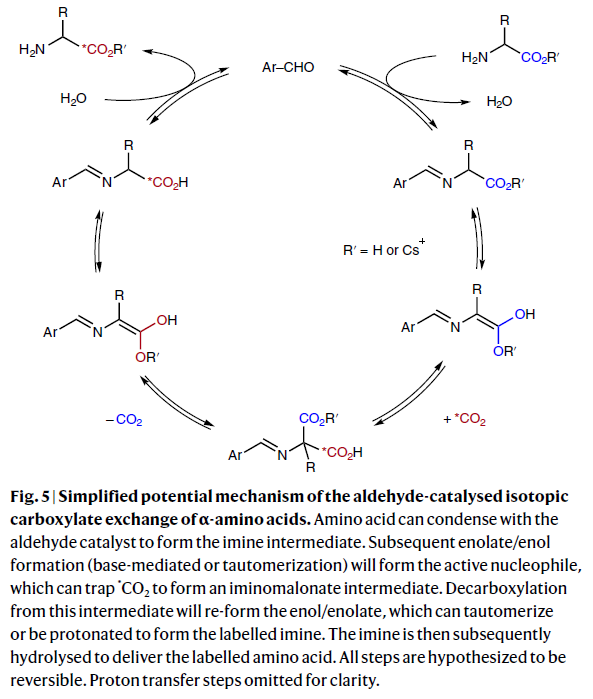
基于上述实验结果,作者提出了此转化可能的反应机理(Fig. 5)。首先,氨基酸可与醛催化剂缩合形成亚胺中间体。随后通过碱促进或互变异构形成烯醇从而形成活性亲核试剂,其可捕获*CO2形成亚氨基戊酸酯中间体。此中间体可以通过脱羧重新形成烯醇中间体,其可以通过互变异构或质子化形成同位素标记的亚胺。最后,亚胺可以被水解从而得到标记的氨基酸产物。此外,作者认为在整个催化循环中每个步骤均具有可逆性,因此与*CO2的交换效率应该是热力学控制的。而如果催化剂分解的速率比羧基交换的速率低的时候则会发生同位素标记率低的现象。
(图片来源:Nat. Chem.)
总结 加拿大渥太华大学Benjamin H. Rotstein和阿尔伯塔大学Rylan J. Lundgren课题组发展了在简单的芳基醛催化下,利用*CO2实现了α-氨基酸的14C,13C或11C标记过程。反应对大多数蛋白质氨基酸以及非天然氨基酸底物均可兼容。利用此方法,无需对羧酸进行预活化或在分子上预先安装官能团,即可实现α-氨基酸碳同位素标记,这在药物研发和医疗领域中具有重要的应用价值。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn