

(图片来源:Angew. Chem. Int. Ed.)
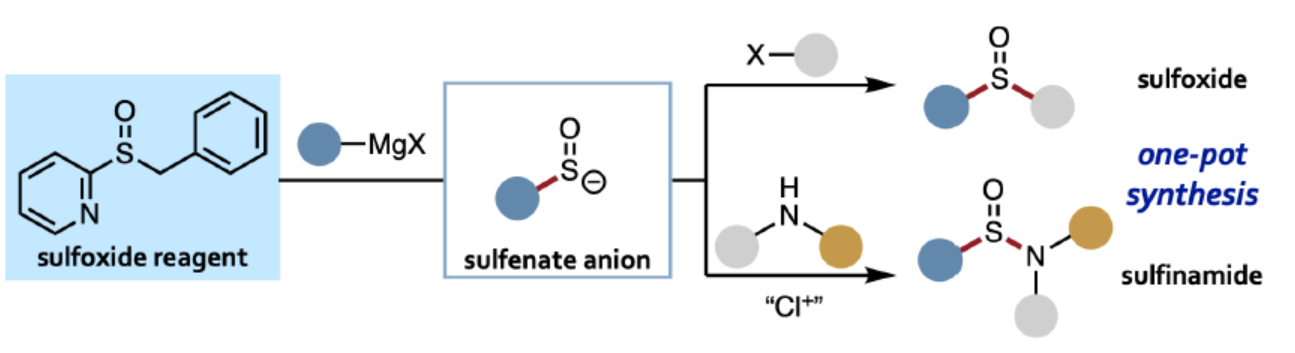
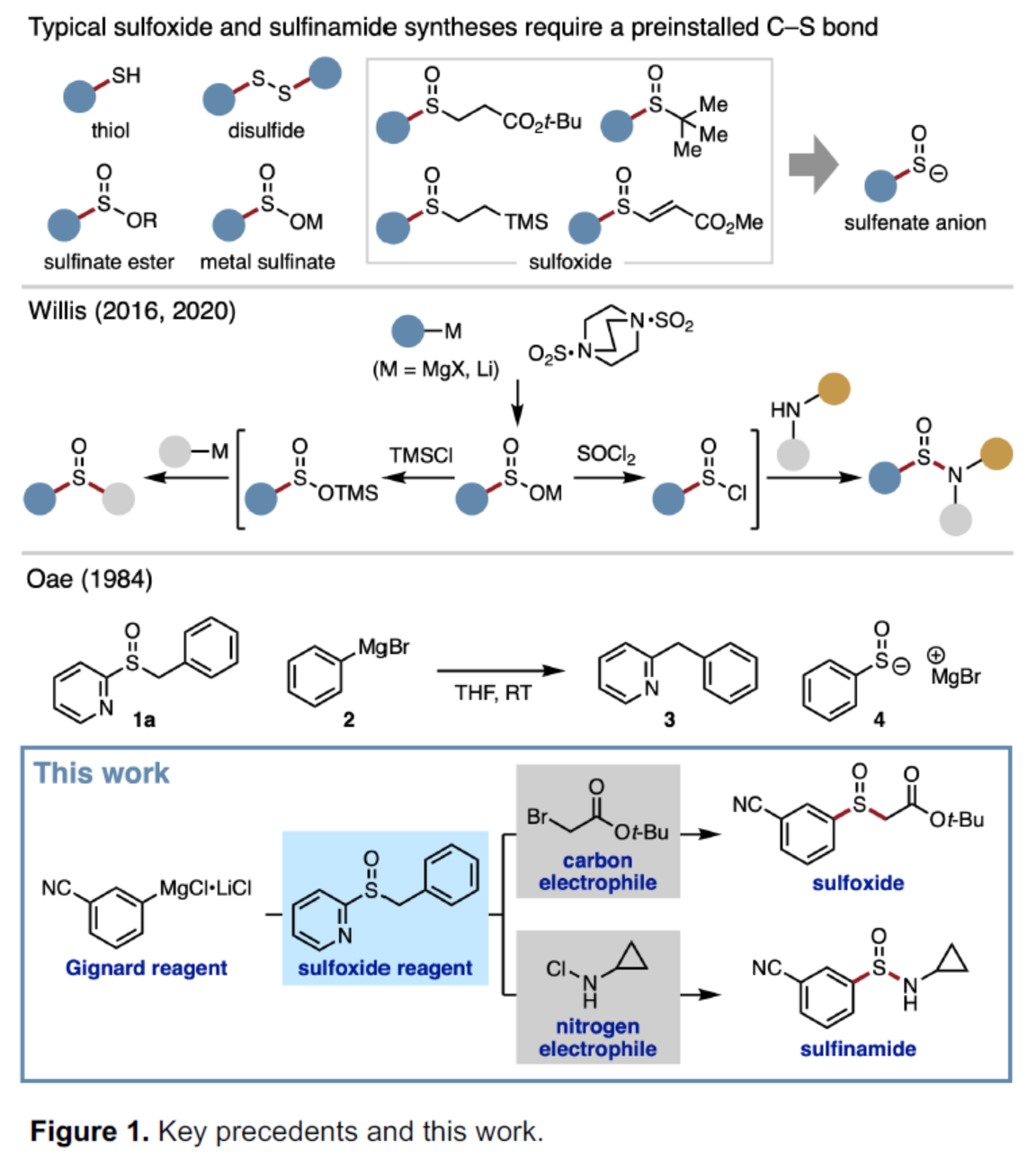
亚砜和亚磺酰胺是一种具有多种用途的含硫单元,可用作过渡金属催化中的配体、手性助剂以及硫官能团的前体,例如亚砜亚胺(sulfoximines)和磺酰亚胺酰胺(sulfonimidamides)。对于亚砜和亚磺酰胺的合成方法,通常需在底物中预先引入硫官能团。例如,在合成亚磺酰胺的已知底物中,如硫醇、二硫化物、亚硫酸酯、金属亚硫酸酯等,商业可用性均有限(Figure 1)。此外,这些策略具有有限的结构模块性,因为在关键的C-S或N-S键形成步骤中只能引入两个取代基中的一个。对于快速合成亚砜和亚磺酰胺衍生物的理想方法是三组分偶联反应,其中两个取代基可在一步(或一锅)操作中连接到中心SO单元。在此背景下,Willis课题组报道了一种一锅三组分合成亚砜和亚磺酰胺衍生物的方法,其中使用DABSO作为SO源。中间体亚磺酸盐(RSO2–)是合成不同产物的关键点。受此启发,Saito课题组认为使用次磺酸阴离子(RSO–)作为关键的中间体,可用于亚砜的合成。虽然次磺酸阴离子可通过一氧化硫与有机金属试剂加成而形式获得,但实际上该反应却不适用,因为一氧化硫在环境条件下是一种不稳定的气体。此外,已知的次磺酸阴离子前体合成需预先引入碳-硫键,从而不适合实现三组分偶联反应。近日,德国慕尼黑大学Fumito Saito课题组开发了一种通过Grignard试剂合成的稳定的亚砜试剂,并可分别与碳亲电试剂和氮亲电试剂反应,分别获得相应的亚砜和亚磺酰胺衍生物。
(图片来源:Angew. Chem. Int. Ed.)
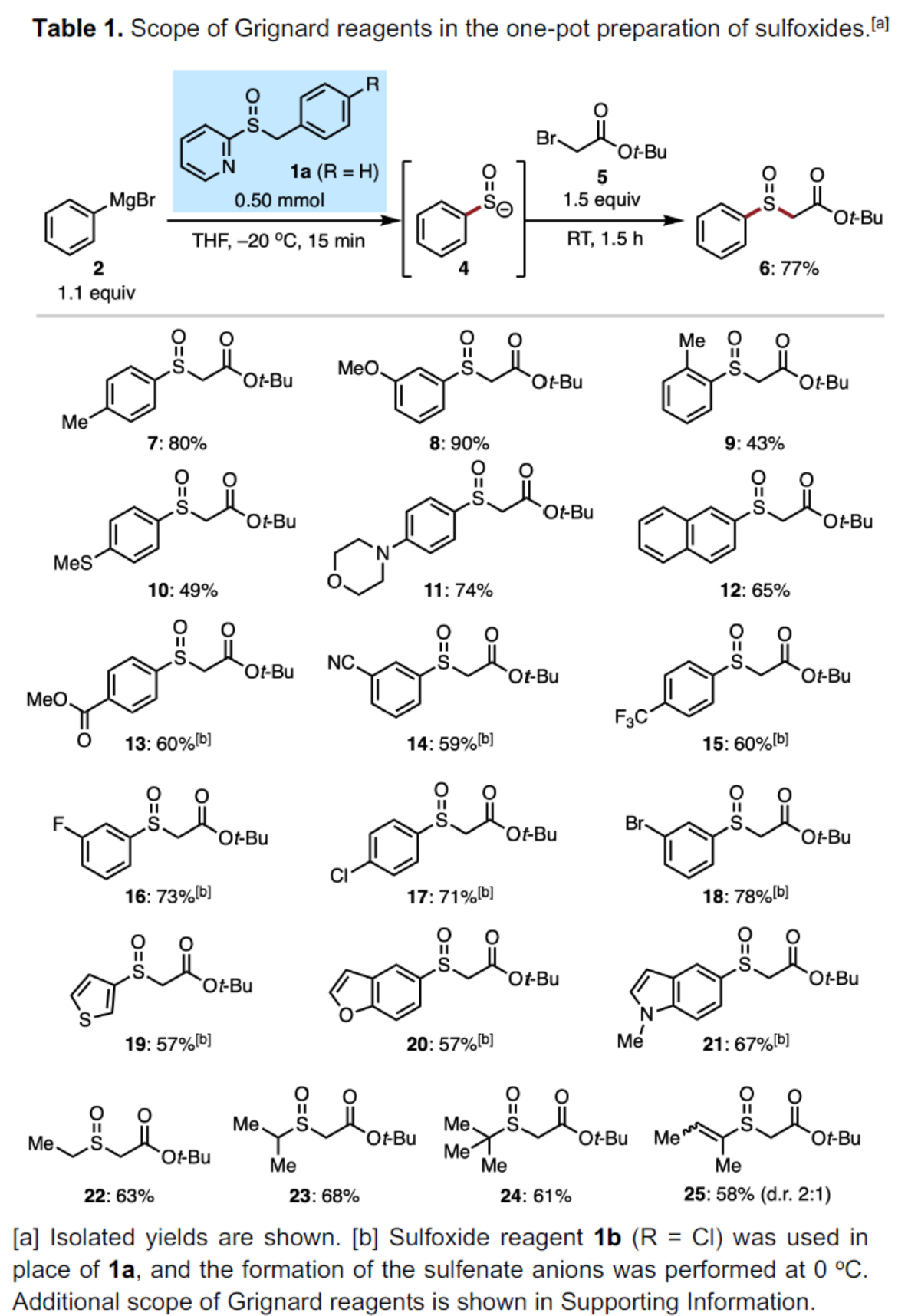
首先,作者对Grignard试剂的底物范围进行了扩展(Table 1)。一系列具有不同电性取代的芳基、萘基、杂芳基Grignard试剂,均可顺利进行反应,获得相应的产物7-21,收率为43-90%。值得注意的是,通过该策略可合成传统硫醚氧化方法不易制备的亚砜产物,如10。烷基和烯基Grignard试剂,也能够顺利反应,获得相应的产物22-25,收率为58-68%。
(图片来源:Angew. Chem. Int. Ed.)
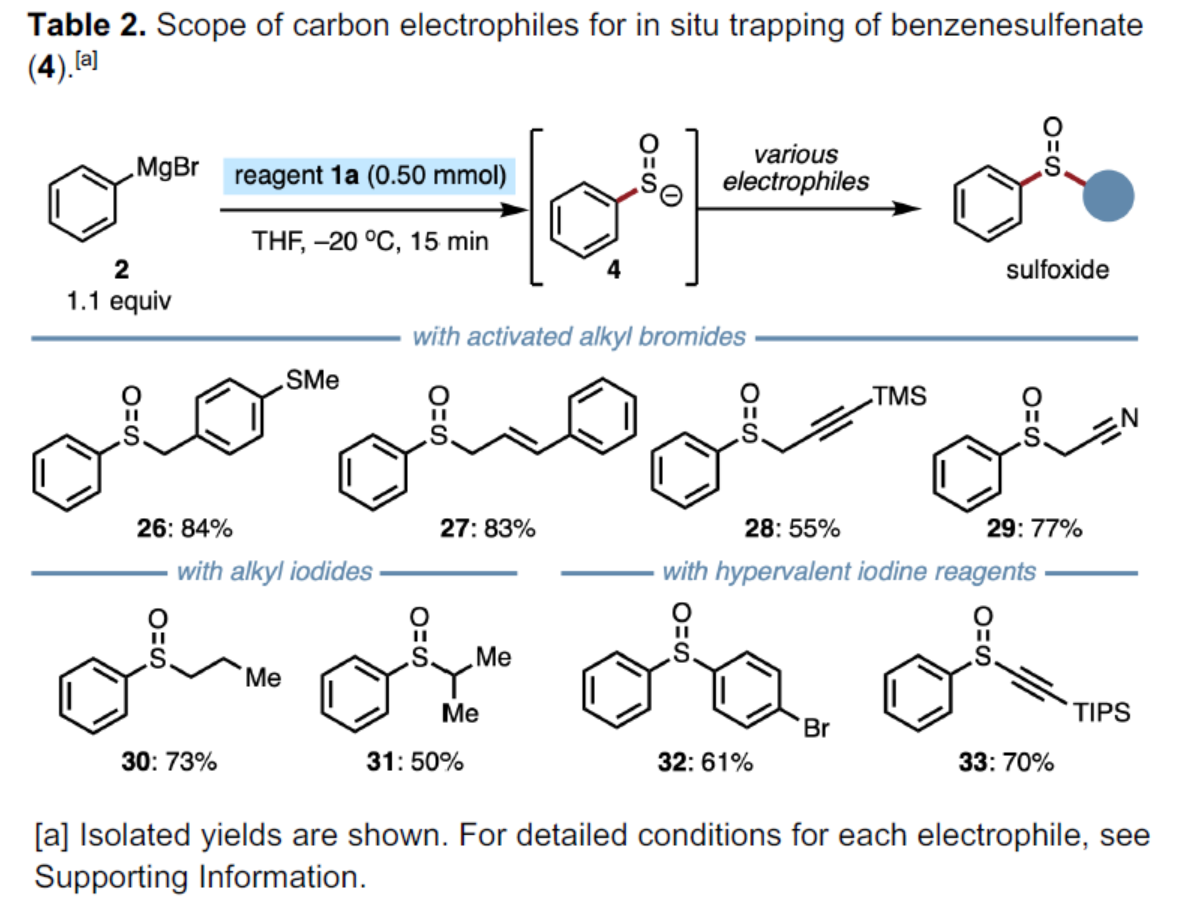
紧接着,作者对碳亲电试剂的底物范围进行了扩展(Table 2)。研究表明,一系列活化的烷基溴、烷基碘以及高价碘试剂,均可顺利进行反应,获得相应的产物26-33,收率为50-84%。同时,一系列活性的基团,如烯基、炔基等,均与体系兼容。
(图片来源:Angew. Chem. Int. Ed.)
接下来,作者对一锅法合成亚磺酰胺的反应进行了研究。虽然化学家们已开发多种通过次磺酸合成亚砜的反应,但对于通过次磺酸合成亚磺酰胺的反应仅有一例报道。2018年,张俊良课题组(Adv. Synth. Catal. 2018, 360, 1123.)报道了一种铜催化次磺酸阴离子的亲电酰胺化反应,直接合成了亚磺酰胺,但此反应需要使用羟胺衍生物(需要额外的合成步骤),并且仅适用于三级亚磺酰胺的合成。作者认为,次磺酸阴离子可与亲电胺发生简单的取代反应,且无需使用过渡金属催化剂和特定的胺化试剂。因此,作者对氮亲电试剂的底物范围进行了扩展(Table 3)。首先,一系列环状和非环状二级胺(如吗啉、哌嗪、吡咯烷等),均可顺利进行反应,获得相应的三级亚磺酰胺产物34-48,收率为33-90%。其次,一系列一级胺(如含有苄基、苯乙基、环丙基、环丁基、环己基胺,甚至空间受阻的金刚烷胺),均与体系兼容,获得相应的二级亚磺酰胺产物49-60,收率为41-77%。同时,苯胺以及其它烷基取代的胺,也是合适的底物,获得相应的二级亚磺酰胺产物61-64,收率为34-74%。此外,当使用二苯基膦酰羟胺(DPPH)作为胺亲电试剂时,可合成一系列一级亚磺酰胺产物65-80,收率为41-77%。
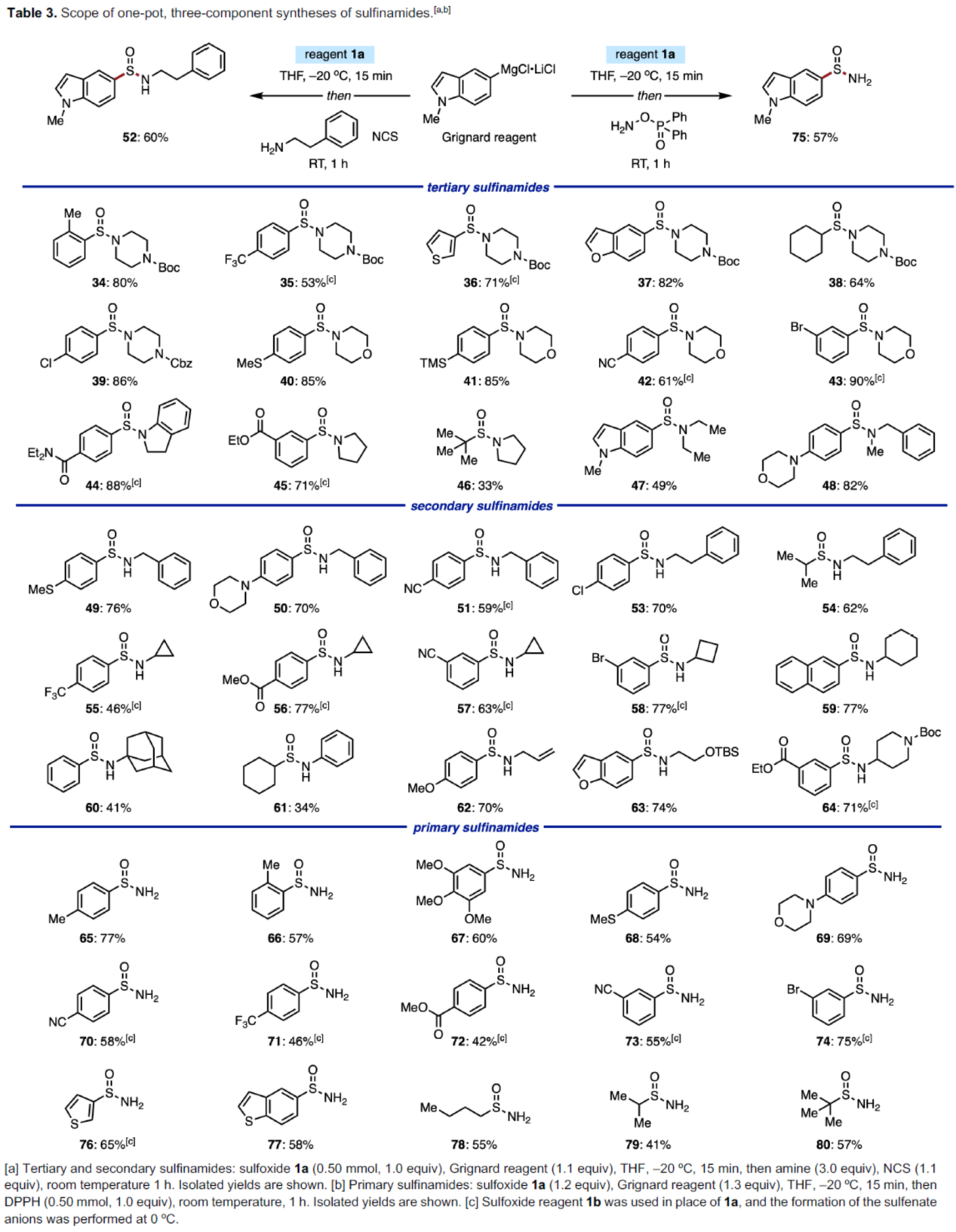
(图片来源:Angew. Chem. Int. Ed.)
紧接着,作者对反应的实用性进行了研究(Scheme 1)。首先,亚砜试剂1a和3,4,5-三甲氧基苯基溴化镁(81)反应生成次磺酸阴离子后,再与原位生成的N-氯吗啉进行取代反应,可以90%的收率获得产物82,这是镇静剂曲美托嗪(Trimetozine)的亚磺酰胺类似物。通过类似的途径,还可以84%的收率获得产物83,这是抗抑郁药Trocimine的亚磺酰胺类似物。其次,84与亚砜试剂1b反应生成次磺酸阴离子后,再进行取代反应,可以85%的收率获得产物85。85在KOTMS条件下,可将甲酯转化为羧酸,可以78%的收率得到羧酸产物86,这是用于治疗痛风和高尿酸血症的丙磺舒(Probenecid)的亚磺酰胺类似物。
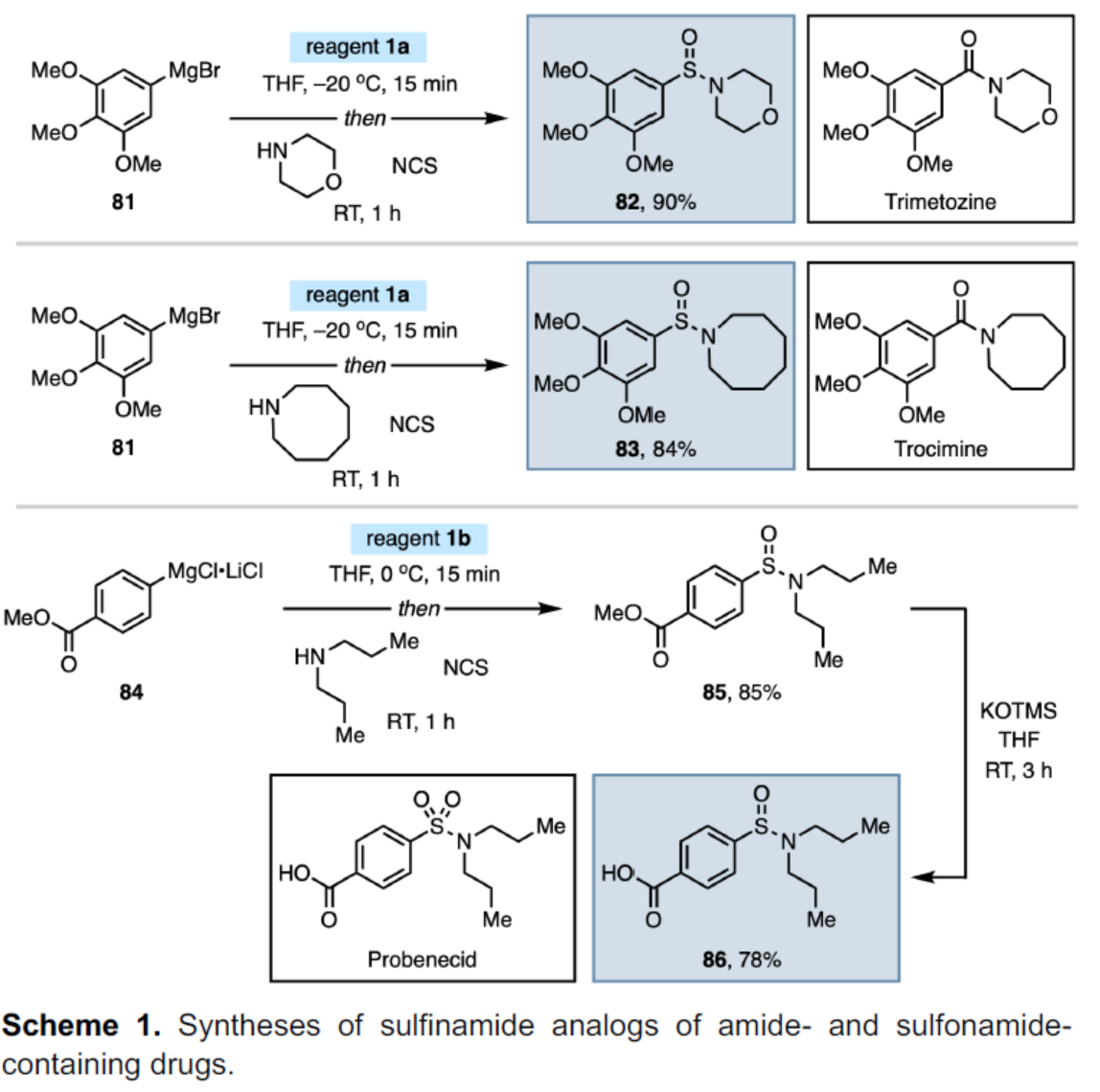
(图片来源:Angew. Chem. Int. Ed.)
此外,作者发现,烯丙基溴化镁(87)、亚砜试剂1a和亲电试剂5在标准条件下反应时,可分别以76%的收率得到亚砜化合物88和以69%的收率得到2-烯丙基吡啶89(Scheme 2)。这些产物可通过1a和87之间直接SNAr反应直接形成(path a),或者通过烯丙基和2-吡啶基之间的简单分子内偶联(涉及中间体90)形成(path b)。
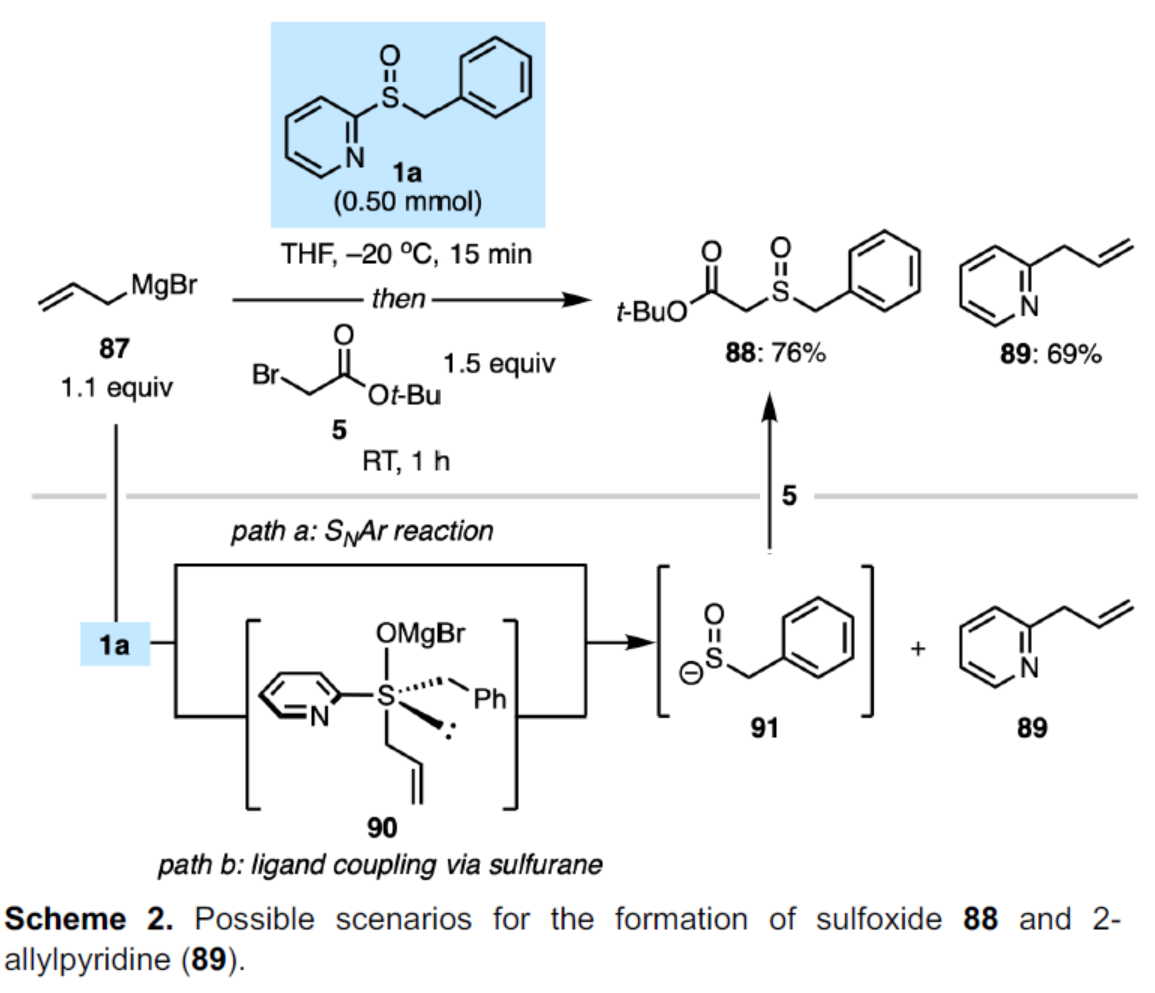
(图片来源:Angew. Chem. Int. Ed.)
总结 德国慕尼黑大学Fumito Saito课题组报道了一种易于制备且稳定的亚砜试剂,并成功应用于一锅三组分亚砜和亚磺酰胺的合成中。其中,一系列Grignard试剂可用于生成相应的次磺酸阴离子,可用作合成亚砜的关键中间体。次磺酸阴离子还可与多种氮亲电试剂发生取代反应,合成了一系列一级、二级和三级亚磺酰胺衍生物。此外,通过对相关药物分子类似物的合成,进一步证明了反应的实用性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn