

光动力疗法(PDT)已成为一种很有前途的抗癌方法,与传统的癌症治疗方式相比,PDT具有相对无创性,而且由于其独特的光生物学机制,可以重复应用,没有耐药问题。为了增强肿瘤的定位,光敏剂通常与肿瘤靶向配体结合,如抗体、多肽、适配体和叶酸。虽然这种主动靶向方法可以使光敏剂靶向传递,但正常细胞意外摄取这些偶联物仍然是不可避免的,因为大多数癌症相关受体并不只在癌细胞中表达。此外,一些靶受体的缓慢转运很容易导致饱和,限制了受体介导的偶联物的内吞作用。
为了规避这些问题,双受体靶向策略已被探索,以促进光敏药物的靶向传递。由于癌细胞经常过表达不止一个表面受体,这种双受体靶向策略可以增加配体-受体相互作用的概率,与单一受体靶向方法相比,这增强了癌细胞的摄取和更精确的靶向。然而,在目前的设计中,两个靶向配体通常被合并在一个单一的实体中,这就导致生物偶联物仍然可以内化到只有两种受体中的一种的细胞中,从而降低了对特定类型癌细胞的特异性。此外,由于这些生物偶联物大多数是““always-on”的荧光团,因此不可避免地会有显著的荧光背景信号。为了降低背景信号的干扰,生物正交开启探针得到了积极的探索。生物正交探针在与相应的化合物进行生物正交偶联后,可以恢复荧光发射,从而产生更高的信噪比。虽然这种方法已被用于生物成像,但使用生物正交化学来激活PDT的报道很少。鉴于此,Dennis K. P. Ng教授课题组基于前期工作设计的生物正交激活四嗪取代BODIPY光敏剂和高效的逆电子需求的Diels-Alder(IEDDA)反应,提出了一种双受体介导的生物正交激活策略,以增强光动力作用的肿瘤特异性,降低对正常组织的毒副作用(图1)。
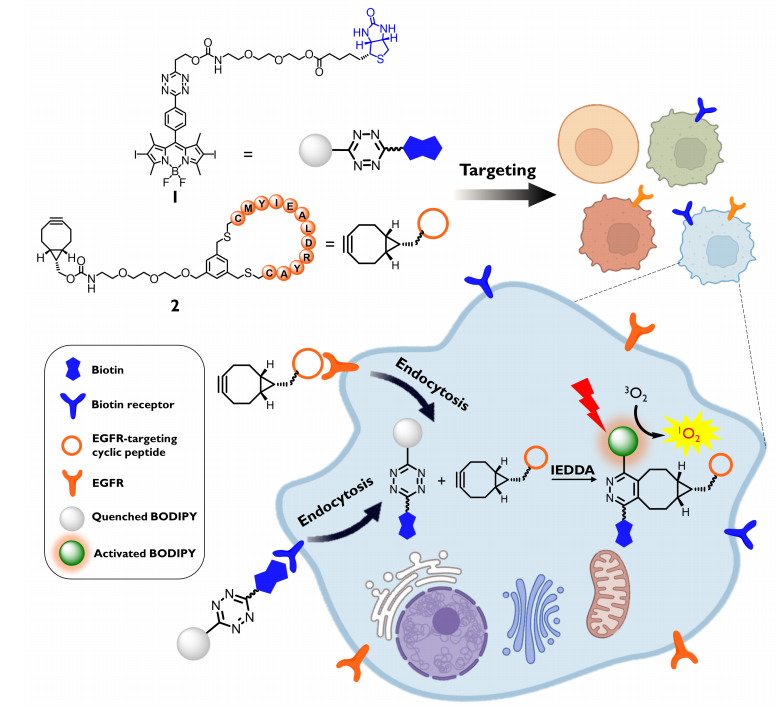
图 1. 双受体介导的生物正交激活光敏剂的设计示意图(图片来源:Angew. Chem. Int. Ed.)
在该设计策略中,四嗪取代的BODIPY染料用作光敏剂,其中四嗪取代基既抑制了染料的发光和光敏活性,同时也是进行生物正交反应的单元。为了实现主动靶向,作者将广泛使用的肿瘤靶向生物素配体引入到BODIPY上,从而得到了一种生物素受体靶向和可激活的双功能光敏剂化合物1。对于另一种生物正交成分化合物2,BCN与线性肽CMYIEALDRYAC的环状形式偶联,该肽被发现对EGFR过表达的癌细胞具有很强的结合亲和力。为了研究亲二烯试剂对1活化的影响,作者将2的BCN-CH2基团替换为TCO部分得到化合物3进行比较。首先,为了确定BCN或TCO偶联物对1的生物正交激活效果,作者研究了1与非肽偶联的BCN-CH2OH和TCO-OH的IEDDA反应(图2)。结果表明,与TCO相比,BCN可以在IEDDA反应后容易地生成具有明确立体化学性质的高荧光哒嗪产物。因此,BCN衍生物2表现为更好的亲二烯试剂,并被选择用于后续研究。
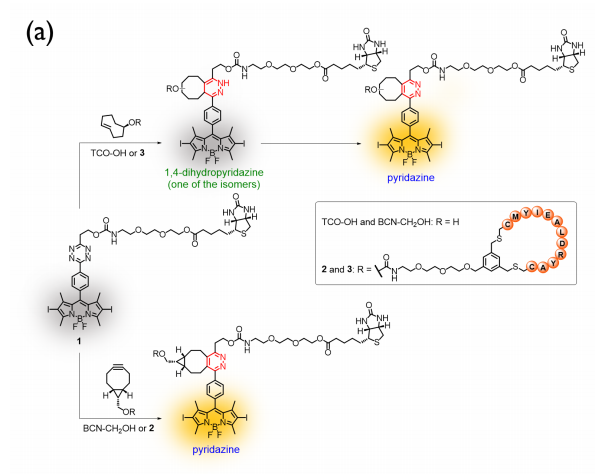
图 2. 化合物1与TCO-OH(或3)和BCN-CH2OH(或2)的IEDDA反应(图片来源:Angew. Chem. Int. Ed.)
接着,作者研究了化合物1的光物理性质(图3)。化合物1在539 nm处有较强的吸收带,当激发波长为510 nm时,在556 nm处可以观察到微弱的荧光,荧光量子产率为0.003。这种弱荧光发射可以归因于两个碘原子引起的重原子效应和四嗪基团的淬灭效应。而当加入化合物2后,虽然吸收光谱没有明显变化,但荧光强度大大增强,荧光量子产率为0.028。该荧光的增强是由四嗪部分转化为哒嗪所引起的淬灭途径的弛豫引起的。然后,作者进一步研究了化合物2激活1光动力治疗效果的能力。当加入化合物2后,单线态氧产生的效率从0.20显著提高到0.71,从而证明了生物正交激活PDT的可行性。
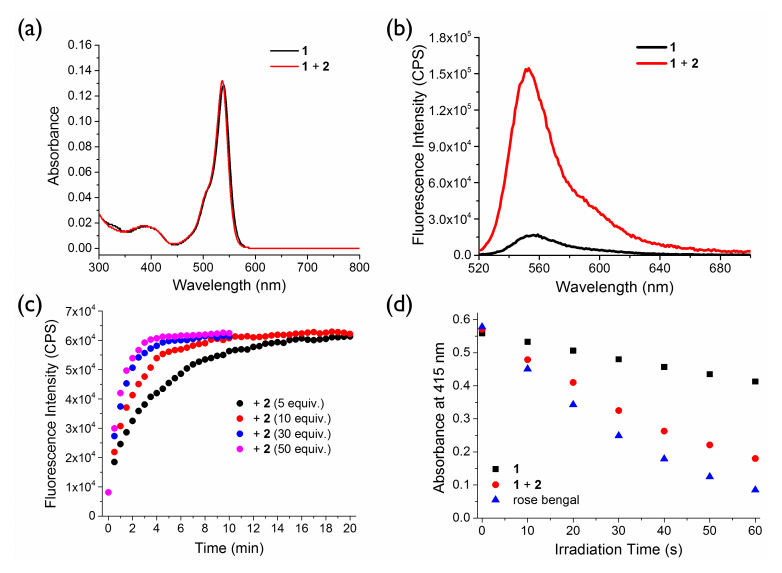
图 3. 化合物1的光物理性质(图片来源:Angew. Chem. Int. Ed.)
基于良好的光学实验结果,作者接下来在细胞水平上研究了1与2偶联时的靶向和激活效应(图4)。作者选择了四种不同的细胞系包括A549细胞(同时表达生物素受体和EGFR),HeLa细胞(只表达生物素受体),HCT116细胞(只表达EGFR)和HEK293细胞(两种受体都不表达)。首先,作者确定了孵育时间,将上述细胞系的细胞与1孵育1 h,然后在有或不存在2的培养基中孵育6 h。结果显示,仅与1孵育后,由于四嗪部分的强淬灭效应,所有四种细胞系均观察到微弱的荧光。然而,在与2孵育后,A549细胞观察到强烈的细胞内荧光,其强度增加了约5倍。对于其它三种细胞系,荧光信号仍然相对较弱。为了进一步证明活化的特异性,作者在体外研究中使用了2的非肽偶联类似物,即BCN-CH2OH作为对照化合物。由于缺乏EGFR靶向环肽,BCN-CH2OH能够以非选择性的方式进入所有细胞,结果A549和HeLa细胞的荧光强度大约是其它两种细胞系的2倍。同样地,作者应用非生物素化的BODIPY 4进行了对照,从而证明了双受体介导的生物正交激活策略的特异性。并且实验结果表明这两种生物正交组分可以很好地靶向到溶酶体。
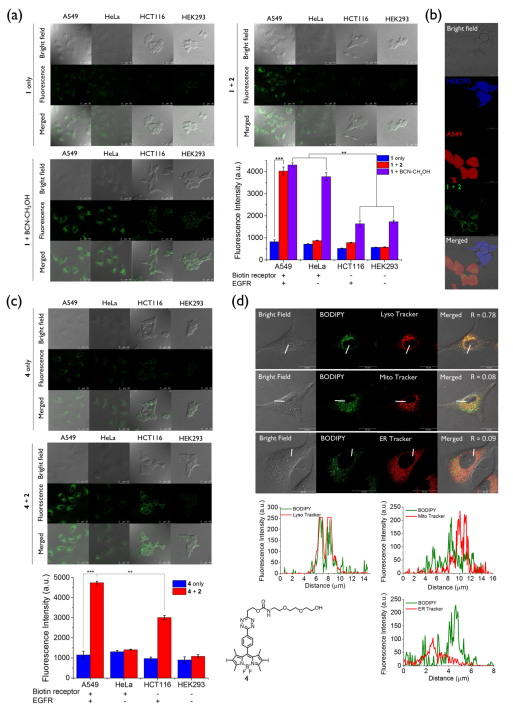
图 4. 细胞成像实验(图片来源:Angew. Chem. Int. Ed.)
此外,化合物1在细胞内被2激活的ROS生成能力也被证明(图5)。而且,通过细胞毒性实验验证了这种双受体靶向策略可以实现特异性靶向治疗,仅在A549细胞中显示出优异的光动力治疗效果。
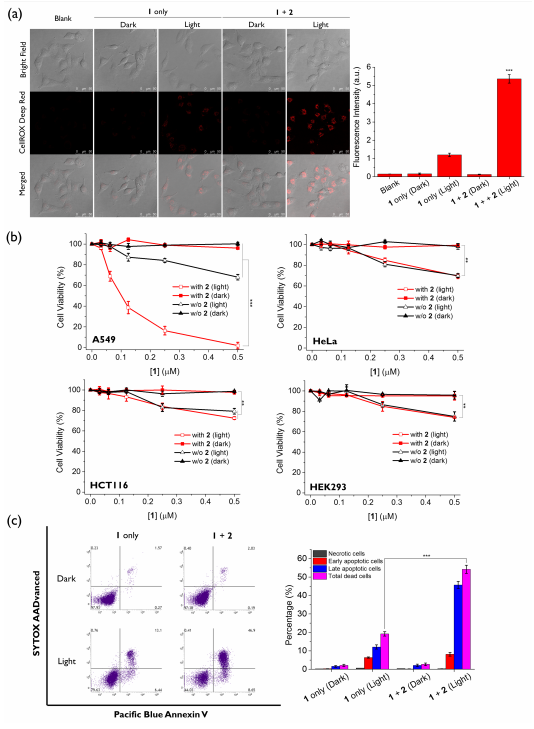
图 5. 细胞光动力治疗实验(图片来源:Angew. Chem. Int. Ed.)
总结
香港中文大学的Dennis K. P. Ng教授课题组开发了一种新的双受体介导的生物正交激活方法,能够特异性递送和激活基于BODIPY的光敏剂用于靶向PDT。该设计策略包含两种组分,分别为生物素修饰的四嗪取代的光敏剂以及EGFR与BCN嗜二烯受体相连的靶向肽,这两种组分只有在同时表达生物素受体和EGFR的癌细胞中才能优先内化,然后进行快速的生物正交IEDDA反应,形成相应的环加合物以破坏四嗪淬灭单元,从而恢复光敏剂的荧光和产生ROS的能力。通过使用一系列生物素受体和EGFR表达水平不同的细胞系,作者证明了只有在生物素受体和EGFR表达的A549细胞中,光敏剂才可以被激活,为肿瘤的精准光动力治疗提供了新思路。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn