

目标导向合成(TGS)是一种无需事先合成和高通量筛选即可识别目标选择性先导物的强大工具。它已被有效地用于各种治疗性蛋白和核糖核蛋白靶点的抑制剂的简单合成。然而,作为模板的DNA/RNA靶点在设计和开发用于调节基因功能的小分子方面的研究仍然较少。
由于肽和拟肽大环的结构限制,它们表现出代谢稳定性和增强的生物分子靶标结合亲和力仿肽大环的大表面积阻止了与双链DNA的插层结合,并显示了对DNA四链的选择性。叠氮-炔环加成反应已被用作构建大环骨架的工具,在肽和碳水化合物化学、超分子系统和药物化学中得到了广泛的应用。双官能团片段之间的双环加成进行大环化需要很高的稀释条件。通过原位双击反应合成靶标导向的多肽,如大环配体,不仅能有效构建大环结构,还有助于识别生物靶标的结合剂。然而,从反应混合物中识别原位生成的配体一直具有挑战性。在这项工作中,作者团队提出了G4s可以选择性地导向双炔和双叠氮片段合成一个大环类肽的方案(Scheme 1)。这种大环配体也已在活细胞中由其相应片段合成,显示出很有前景的生物学特性。
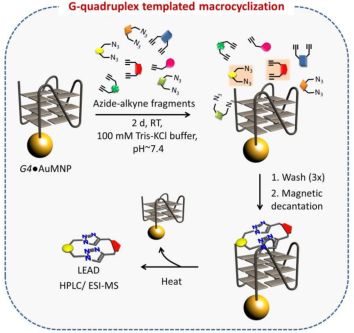
Scheme 1. DNA功能化磁性金纳米颗粒靶向导向合成G4选择性配体的示意图(图片来源:Angew. Chem. Int. Ed.)
为了生成目标特异性配体,作者制备了6个双炔(1a-f)和9个单/双叠氮(2a-i),其中包含脂肪族、芳香族和羧酰胺官能团以及烷基胺侧链(Fig. 1a-b)。以c-MYC、h-TELO、c-KIT1、c-KIT2、BCL2 G4 DNA和一个dsDNA作为DNA模板,在镀金磁性纳米颗粒(AuMNPs)上进行瞬间共价系链(Scheme 1)。UV-Vis光谱证实了DNA与纳米颗粒的结合(Fig. 1)。CD光谱显示,固定在Au-MNPs上的c-MYC, c-KIT1, c-KIT2, BCL2和h-TELO G4s具有典型的CD特征,并保持其G4构象。在反应性方面,c-MYC G4-AuMNPs生成双三唑基大环配体M1,h-TELO G4-AuMNPs也得到了相同的产物(Fig. 1c-d),并且前者具有更高的相对产率。
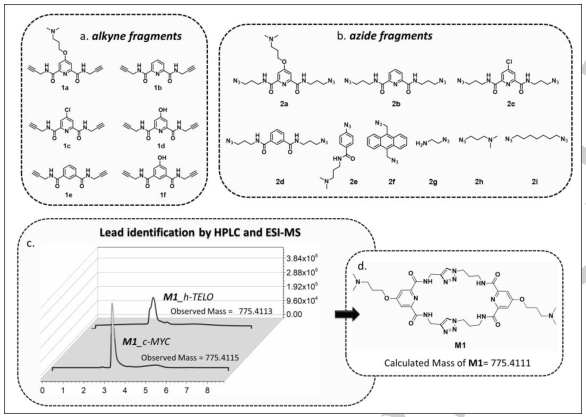
Fig 1. G4纳米模板定向原位环加成(图片来源:Angew. Chem. Int. Ed.)
为了确定原位生成M1的区域选择性,作者在高稀释条件下用标准Cu(I)-催化叠氮炔环加成(CuAAC)合成了M1(Fig. 2a)。观察到原位反应和Cu(I)-催化反应都产生1,4-双取代的抗三唑区域异构体。
为了了解这类大环的结合特性,作者团队进一步通过Cu(I)-催化CuAAC合成了3个结构相似的化合物M2、M3和M4(Fig. 2a-b)。G4定向合成没有检测到1b和2b组分形成的大环M4。含双叠氮化合物(2a,2b)的吡啶双羧基酰胺(1a,1b)与含双炔化合物的吡啶双羧基酰胺(1a,1b)的反应,得到高收率(70-78%)的双三唑大环M1-M4(Fig. 2a-b)。这类大环包含4个酰胺键和2个酰胺键同构体(三唑结构单元),可作为细胞内靶点的潜在治疗性拟肽配体。
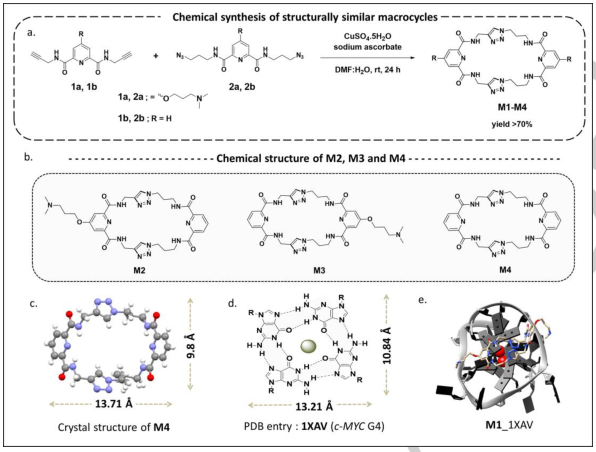
Fig 2. Cu(I)-催化叠氮炔环加成反应合成M1-M4大环化合物及其结构和分子对接(图片来源:Angew. Chem. Int. Ed.)
M4的结构通过单晶X-射线分析确认(Fig. 2c),由于这些大环(M1-M4)的大环核具有精确的几何互补和较大的表面积,预计它们对G4 DNA具有选择性。此外,用荧光滴定法测定配体对不同G4的结合亲和力(Kd)。观察结果表明,尽管两种配体都与h-TELO结合,但它们对c-MYC的结合亲和力相对较高(Fig. 3c)。与M1和M2相比,具有相似循环核的配体M3和M4对c-MYC没有太大的特异性和亲和力。与未生成M4的TGS结果一致,M4对c-MYC、c-KIT2和h-TELO G4s表现出非特异性和弱结合。这一趋势表明,带有侧链的大环配体M1和M2对G4s的结合亲和力高于没有侧链的M3(叠氮基吡啶环侧链)和M4。荧光和ITC研究表明,这些配体与双链DNA的结合微不足道。分子模型研究进一步表明,配体M1在c-MYC G4的存在下获得了平坦但灵活的构象(Fig. 2e),尽管从晶体结构上观察到大环核是非平面的。CD光谱研究显示,即使存在15摩尔当量的大环(M1-M4),c-MYC G4也能保持其构象。
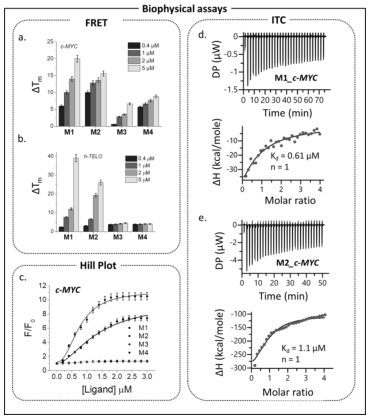
Fig 3. 配体的RET-melting、Tm和ITC分析(图片来源:Angew. Chem. Int. Ed.)
接下来,XTT法检测的细胞毒性结果表明,配体M1、M2、M3和M4对HeLa细胞具有相似的细胞毒性,但对正常NKE细胞的毒性均较低(IC50 ˃ 60 μΜ)。流式细胞术使用凋亡标记(Annexin V和PI)分析显示,M1诱导61%的细胞群凋亡,10.8%的细胞群坏死。M2还诱导45%的细胞群凋亡,8.7%的细胞群坏死。
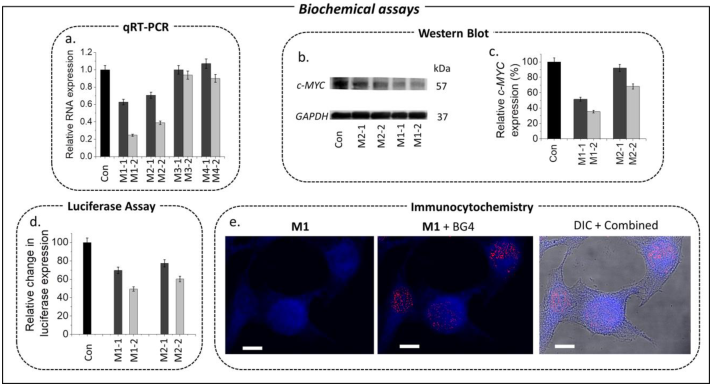
Fig 4. 配体分子的qRT-PCR、Western blot、双荧光素酶测定和免疫细胞化学分析(图片来源:Angew. Chem. Int. Ed.)
通过qRT-PCR和Western Blot研究配体对HeLa细胞中相对于管家基因表达的c-MYC基因表达的体外影响(Fig. 4a-c),结果表明M1在转录和翻译水平上比M2更有效地抑制c-MYC的表达,而不改变管家基因的表达。双荧光素酶检测发现M1和M2分别降低了c-MYC启动子连接的荧光素酶表达51%和40%(Fig. 4d)。然而,M1和M2都没有改变c-MYC突变启动子中的荧光素酶表达(不能形成G4结构),这表明观察到的c-MYC表达下调是由四联体稳定引发的。
接下来,作者通过叠氮和炔的无铜点击反应来探索其在细胞中的可行性。对Hela细胞提取物进行ESI-MS分析,发现M/z值与M1对应,表明细胞大环化。用1a和2a处理的细胞也增加了约2倍的BG4焦点,这表明细胞内形成的M1随后稳定并捕获内源性G四聚体结构。
总结
Jyotirmayee Dash团队利用非共价相互作用的力量,首次完成了模拟肽型大环(M1)的DNA模板合成。该研究表明,大环化反应可以通过靶向合成方法实现。通过Cu(I)-催化环加成也合成了M1的结构类似物。G-四联体和其中一种大环配体的晶体结构比较表明,互补结构基序通过双叠氮和双炔碎片之间不可逆的键合,在高亲和的大环仿肽剂的形成中起着至关重要的作用。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn