


(图片来源:Chem)
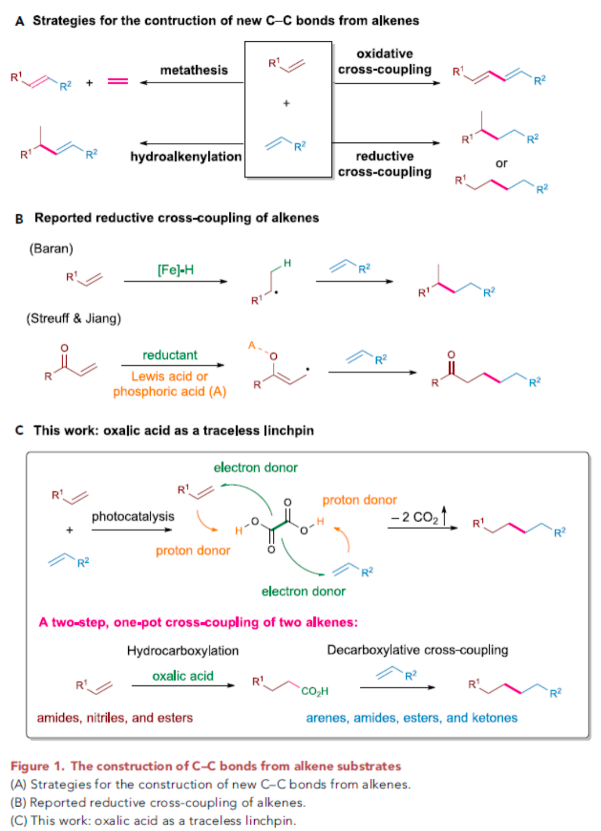
碳-碳键的构建在有机化学中是非常重要的。因此,开发新的碳-碳键形成策略受到了有机化学家们的广泛关注。烯烃是化学工业中最容易获得且最丰富的起始原料,因此在有机合成化学中许多合成策略均是利用烯烃作为底物,如丙烯腈的二聚合成己二腈、烯烃的复分解反应等。烯烃的偶联反应是另一类有用的合成转化,其可以有效实现两类不同烯烃的连接(Figure 1A)。在过渡金属催化的氧化偶联反应中,丙烯酸酯通常作为偶联配偶体来实现转化,以良好的E/Z选择性实现1,3-二烯产物的合成。而在烯烃的还原偶联反应中,烯烃底物中的不饱和位点可以连接在一起形成完全饱和的碳骨架(Figure 1B)。基于偶联反应中的linchpin策略,最近,新加坡国立大学卢一新团队使用草酸作为一种无痕linchpin,利用双光催化剂体系实现了两种简单烯烃的还原偶联,直接构建了新的碳-碳键。此反应采取一锅两步的策略,通过氢-羧基化和脱羧加成反应实现了一系列具有潜在生物活性分子的构建,具有重要的应用价值。
(图片来源:Chem)
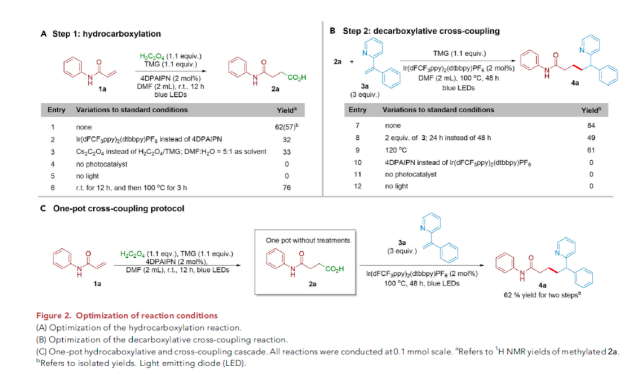
作者首先使用N-苯基丙烯酰胺1a作为模板底物进行氢-羧基化反应探索(Figure 2A),当使用草酸(1.1 equiv), TMG (1.1 equiv), 4DPAIPN (2 mol%),DMF作溶剂,蓝光照射下,室温下反应12小时可以以57%的分离产率得到产物2a(Figure 2A, entry 1)。随后,作者对脱羧偶联反应进行了探索,当使用2a (1.0 equiv), 3a (3.0 equiv), TMG (1.1 equiv), Ir(dFCF3ppy)2(dtbbpy)PF6 (2 mol%),DMF作溶剂,蓝光照射下,100 oC反应48小时可以以84%的分离产率得到产物4a(Figure 2B, entry 7)。且产物4a的结构也通过单晶衍射得到验证。接下来,作者将两步反应合在一锅中进行。当氢-羧基化反应完成后,作者直接在体系中加入光催化剂Ir(dFCF3ppy)2(dtbbpy)PF6和烯烃3a,并将体系加热至100 oC反应,可以以62%的产率得到目标偶联产物4a(Figure 2C)。值得注意的是,将两步反应合并到一锅中进行时反应更加高效,其整体效率比两锅进行的反应效率要高。
(图片来源:Chem)
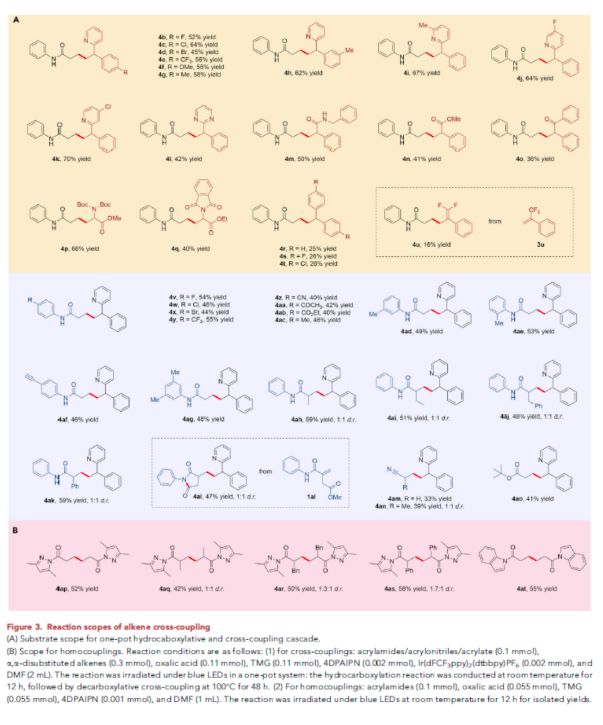
在得到了最优反应条件后,作者对此转化的底物范围进行了探索(Figure 3)。首先,作者对不同烯烃的兼容性进行考察。当苯环上存在卤素(4b-4d)、三氟甲基(4e)、甲氧基(4f)、甲基(4g)以及吡啶环上的甲基(4i)、卤素(4j, 4k)均可兼容,以45-70%的产率得到相应的产物4b-4k。此外,当将吡啶基换成其它基团,如吡嗪(4l,42%)、酰胺(4m,50%)、酯(4n,41%)、酮(4o,36%)等也均可兼容。当使用脱氢丙氨酸时,可以以66%的产率得到非天然氨基酸衍生物4p。此外,保护基Boc还可以换成Phth,以40%的产率得到4q。此体系对于电中性的烯烃(4r-4t)以及偕二氟烯烃(4u)亦可兼容,但是产率相对较低(16-26%)。
随后,作者对α,β-不饱和酰胺的底物范围进行探索。实验结果表明不同取代的α,β-不饱和酰胺(4v-4al)、α,β-不饱和腈(4am, 4an)、α,β-不饱和酯(4ao)均可顺利实现转化,以33-59%的产率实现产物4v-4ao的合成。其中卤素、三氟甲基、氰基、酯基、甲基、炔基等一系列官能团均可兼容。接下来,作者利用此策略实现了一系列丙烯酰胺的自偶联。值得注意的是,自偶联过程在室温下就可以进行,以42-58%的产率实现4ap-4at的合成。
(图片来源:Chem)
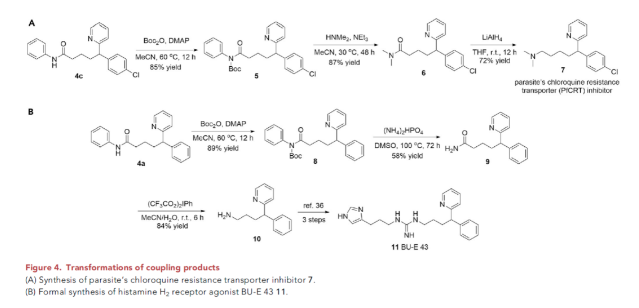
芳基吡啶骨架广泛存在于生物活性分子和已批准的药物中,如pheniramine和chlorphenamine。为了证明此烯烃交叉偶联策略的合成价值,作者利用合成出的产物进行了生物活性分子的合成(Figure 4)。首先,利用产物4c,通过Boc保护(5,85%)、转胺化(6,87%)、LiAlH4还原(7,72%)三步即可实现寄生虫氯喹抗性转运体抑制剂(PfCRT)7的合成(Figure 4A)。此外,利用4a则可以通过Boc保护(8,89%)、转胺化(9,58%)、Hofmann重排(10,84%)等过程实现组胺H2受体激动剂BU-E 43 11的形式合成(Figure 4B)。
(图片来源:Chem)
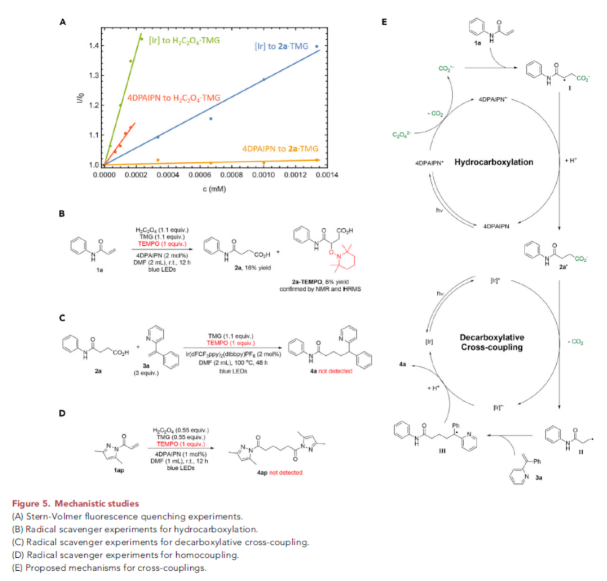
为了深入理解反应机理,作者进行了控制实验。首先,Stern-Volmer荧光淬灭实验表明双光催化剂体系分别在不同阶段促进反应,对整体转化至关重要(Figure 5A)。随后,作者进行了自由基捕获实验。在加成反应中,作者通过NMR和HRMS观察到了TEMPO捕获产物2a-TEMPO(6%)(Figure 5B)。由此表明在加成过程中包含自由基中间体。当在脱羧偶联反应中加入TEMPO后,反应被完全抑制,但是作者并没有观察到TEMPO加合物,可能由于其在高温下不太稳定(Figure 5C)。此外,氘代实验表明此转化中的两步反应均按照Giese-类型的加成途径进行的。
接下来,作者对自偶联反应的机理进行了探索(Figure 5D)。当使用1ap作为底物在反应中加入1当量TEMPO后,自偶联反应被完全抑制。此外,当使用氘代草酸作为试剂时,观察到了在酰胺α-位氘代的二酰胺产物。由于CO2.-(E1/2(CO2/CO2.-) = -2.2 V vs. SCE)可以实现丙烯酰胺1ap(Ep/2 = -1.64 V vs. SCE)的还原,而光催化剂(E1/2(4DPAIPN/4DPAIPN-) = -1.52 V vs. SCE)是不足以作为还原试剂的,因此自偶联过程可能是通过自由基加成路径发生的。此外,丙烯酰胺衍生的两种瞬态自由基阴离子物种之间的离子排斥作用也使自由基-自由基偶联过程不太可能发生。
基于上述控制实验,作者提出了此转化可能的反应机理(Figure 5E)。在氢-羧基化过程中,草酸首先被光激发的4DPAIPN氧化形成二氧化碳自由基负离子,其可以与丙烯酰胺1a加成形成中间体I。随后,中间体I通过还原和质子化过程得到氢-羧基化中间体2a,其可以经历脱羧偶联反应。接下来,在加入Ir(dFCF3ppy)2(dtbbpy)PF6和偶联配偶体3a后,发生脱羧偶联反应。羧酸盐2a’被激发态的光催化剂Ir(dFCF3ppy)2(dtbbpy)PF6氧化,随后经历脱羧形成活化的一级自由基中间体II。其可以被烯烃3a捕获并通过还原和质子化过程得到偶联产物4a。
(图片来源:Chem)
总结
新加坡国立大学卢一新团队使用草酸作为一种无痕linchpin,利用双光催化剂反应体系实现了两种简单烯烃的还原偶联,直接构建了新的碳-碳键。此反应采取一锅两步的策略,通过氢-羧基化和脱羧加成反应实现了一系列具有潜在生物活性分子的构建,具有重要的应用价值。此反应的发展为活性CO2自由基阴离子中间体在精细化学品合成中的广泛应用铺平了道路。
文献详情:
Zugen Wu, Mingyue Wu, Kun Zhu, Jie Wu*, Yixin Lu*,Photocatalytic coupling of electron-deficient alkenes using oxalic acid as a traceless linchpin. Chem, 2023
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn