

(图片来源:J. Am. Chem. Soc.)
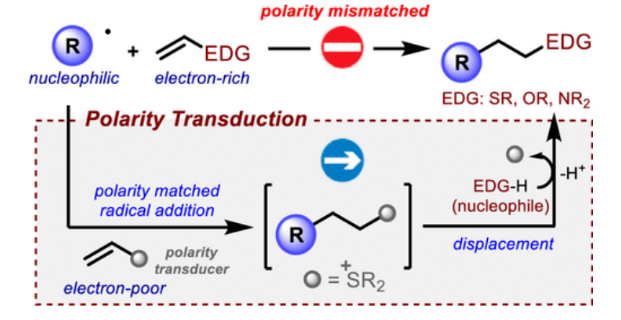
烷基自由基与烯烃的分子间加成,即烯烃的氢-烷基化反应,在化学合成中被广泛应用于碳-碳键的构建。最近,随着温和条件下促进的自由基反应的有效发展,如光氧化还原催化、电化学方法和地球含量丰富的过渡金属催化,使得该化学的范围和实用性进一步扩大,并为获得对映体富集的手性结构砌块和复杂分子的选择性官能团化提供了新的催化策略。
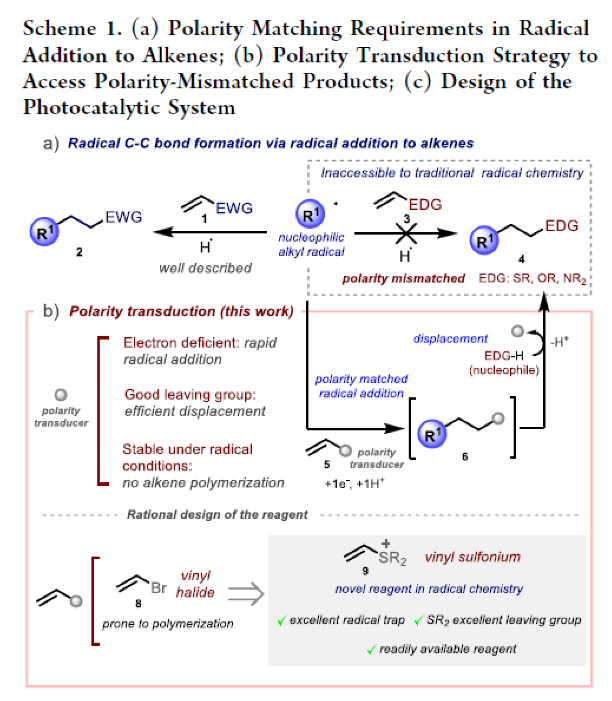
尽管这些过程具有一定的合成价值,但所涉及的自由基和烯烃之间严格的极性匹配要求是此化学发展的根本限制。虽然良好的前沿分子轨道相互作用确保了烷基自由基(通常亲核)和缺电子烯烃1(Scheme 1a, left)之间的平稳反应,但利用相同的自由基与富电子烯烃3((Scheme 1a, right)反应在动力学上是不利的,且实际上是不会发生的,除非在自由基中心引入特定的缺电子官能团来诱导其亲电特性。因此,使用传统的自由基化学方法是不可能获得产物4的。而在氢原子转移过程的背景下,化学家们已经开发了一种策略来规避自由基化学中的不利极性要求—即极性反转催化。然而,目前还没有任何方法可以克服烯烃自由基加成的底物范围限制。因此,发展解决上述底物范围限制的通用方法将极大地改善自由基化学的应用领域,从而促进合成化学各个领域的进一步进展。最近,英国诺丁汉大学Mattia Silvi课题组发展了一种极性转换策略,形式上克服了这种电性上的限制。乙烯基硫鎓离子被证明可以与碳中心自由基反应,使加合物可以进行原位或顺序亲核取代,从而获得了利用传统方法无法合成的产物。
作者认为由原位发生的两个基本步骤相组合的设计思路将绕过上述限制,从而得到传统方法难以合成的产物4。如Scheme 1b所示,在烯烃5上连接一个精心设计的官能团,其将起到类似于“极性传感器”的作用。这个“极性传感器”将发挥关键作用,将π体系中不匹配的富电子极性转换为获得产物4所需的匹配缺电子极性。随后,在快速的自由基加成得到中间体6后,“极性传感器”基团将被亲核试剂取代,从而实现了产物4的合成。
在设计合适的“极性传感器”官能团时,作者考虑了以下几个方面的要求:1)其应该是缺电子性质的,从而降低相邻π体系的电子密度,使得相应的LUMO轨道能量降低从而促进亲核碳中心自由基的加成;2)其应该是一个好的离去基团,确保亲核取代过程的快速发生;3)其结构和电子特征应该会抑制自由基聚合(这一过程通常在烯基卤8中发生)。受到Barton课题组开创性的工作的启发,作者认为乙烯基硫鎓离子9可以参与自由基共轭加成反应中,且硫鎓离子可以在分子间和分子内反应过程中作为好的离去基团。
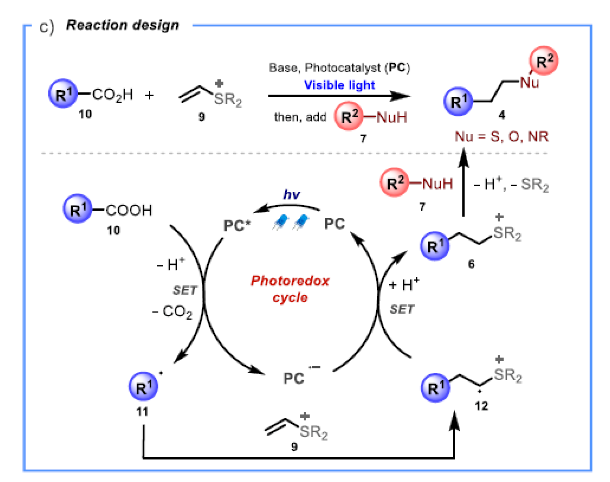
基于上述假设,作者设计了光催化反应。如Scheme 1c所示,羧酸10通过光催化剂诱导的单电子转移脱羧氧化形成碳中心自由基11。由于缺电子硫鎓离子的诱导效应,亲核自由基11将与9的端位烯基碳发生选择性加成。接下来,缺电子自由基阳离子中间体12将与还原的光催化剂(PC•−)经历SET完成催化循环并得到瞬态的硫叶立德中间体并在反应条件下经历质子化得到加合物6。最后,在体系中加入合适的亲核试剂7发生亲核取代从而得到目标产物4。
(图片来源:J. Am. Chem. Soc.)
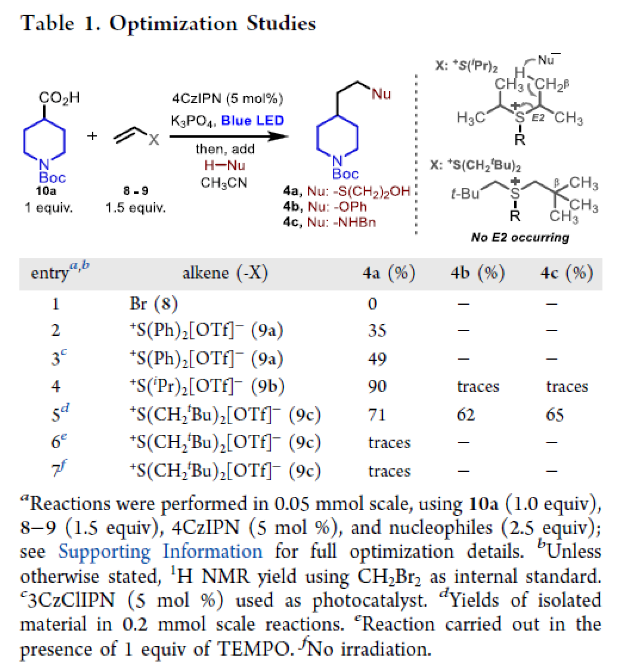
首先,作者选择N-Boc异哌啶酸10a作为模板底物进行反应探索(Table 1)。通过一系列反条件筛选,作者发现当使用10a (1 equiv), 9c (1.5 equiv), 4CzIPN (5 mol %),在CH3CN中,蓝光照射下室温反应。随后加入亲核试剂 (2.5 equiv) 60 oC反应可以分别以71%、62%、65%的产率实现产物4a (Nu = S(CH2)2OH)、4b (Nu = OPh)、4c (Nu = NHBn)的合成(Table 1,entry 5)。控制实验表明,在加入自由基捕获剂TEMPO时(Table 1,entry 6)以及在不存在光照的条件下(Table 1,entry 7)反应均不发生。
(图片来源:J. Am. Chem. Soc.)
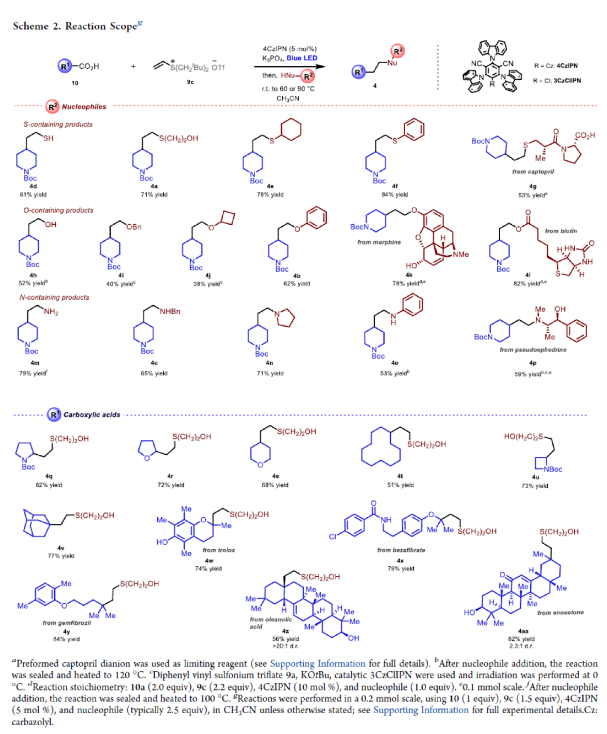
在得到了最优反应条件后,作者探索了此极性转换策略的底物适用范围(Scheme 2)。当使用一系列硫亲核试剂,如硫氢化钠(4d)、一级硫醇(4a, 4g)、二级硫醇(4e)、硫酚(4f),参与反应时,可以以良好的产率实现硫醇和硫醚产物的生成(53-84%)。此外,使用其它的氧亲核试剂(4h-4l,38-82%)和氮亲核试剂(4m-4p,53-79%)均可顺利实现转化,以中等至良好的产率得到了相应的加成产物。值得注意的是,一系列复杂的生物活性分子,如captopril(4g)、morphine(4k)、biotin(4l)、pseudoephedrine(4p)等均可与体系兼容。接下来,作者对一系列作为自由基前体的羧酸衍生物的兼容性进行了考察。实验结果表明,一系列含氮、氧杂环的羧酸(4q-4s)、不同尺寸的环状羧酸分子(4t-4v)均可参与反应。此外,一系列复杂生物活性分子衍生的羧酸,如Trolox(4w)、bezafibrate(4x)、gemfibrozil(4y)、oleanolic acid(4z)、enoxolone(4aa)等均可兼容,证明了此体系具有良好的普适性。
(图片来源:J. Am. Chem. Soc.)
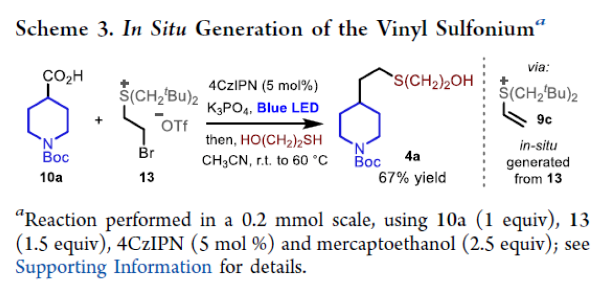
最后,作者利用13作为烯烃前体,在体系中原位生成烯烃9c后仍可以实现此转化,以67%的产率实现产物4a的合成(Scheme 3)。
(图片来源:J. Am. Chem. Soc.)
总结
英国诺丁汉大学Mattia Silvi课题组发展了一种极性转换策略,形式上克服了自由基和烯烃加成过程中的严格极性匹配要求限制。利用碳中心自由基与乙烯基硫鎓离子加成,使加合物可以与不同的亲核试剂进行原位或顺序的亲核取代,从而形式上获得了利用传统方法无法获得的烷基自由基与富电子双键的加成产物。该方法的发展重新定义了碳中心自由基与双键加成的适用范围。
文献详情:
Subhasis Paul, Dario Filippini, Mattia Silvi*, Polarity Transduction Enables the Formal Electronically Mismatched Radical Addition to Alkenes. J. Am. Chem. Soc. 2023
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn