

正文
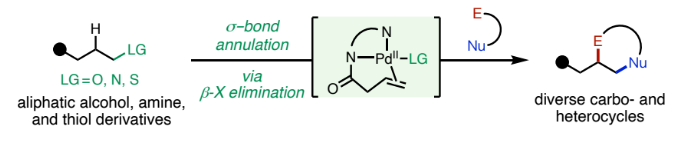
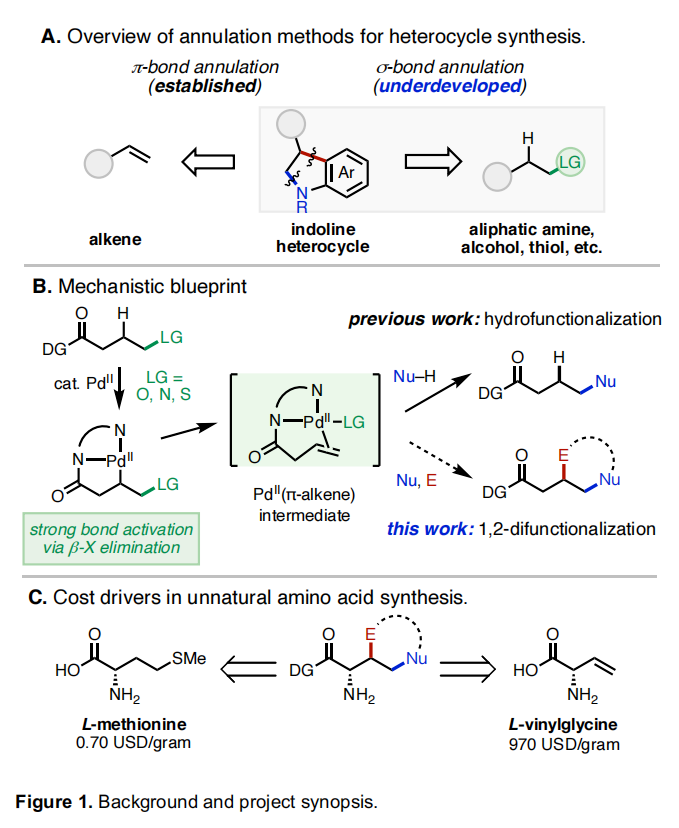
杂环和碳环是药物和天然产物中的重要结构骨架。目前,获得此类结构的重要策略是催化C=C键与双功能偶联配偶体的[n+2](杂)环化反应。在过去几十年已发展的此类反应中,金属催化π-键与两亲性有机卤化物的环化反应具有良好的实用性。此类转化可以利用简单易得的起始原料,在温和条件下实现不同取代烯烃与两亲性有机卤化物的环化。但是到目前为止,利用脂肪醇、胺以及硫醇衍生物的同时C-H和C-杂原子活化来实现此过程却少有探索。最近,辉瑞肿瘤药物化学部Indrawan J. McAlpine和美国斯克里普斯研究所Keary M. Engle课题组联合发展了首例PdII催化脂肪醇、胺和硫醇衍生物与两亲性有机卤化物的σ-键环化反应,以良好的非对映选择性实现了一系列五元和六元(杂)环的合成(Figure 1)。下载化学加APP到你手机,更加方便,更多收获。
(图片来源:Angew. Chem. Int. Ed.)
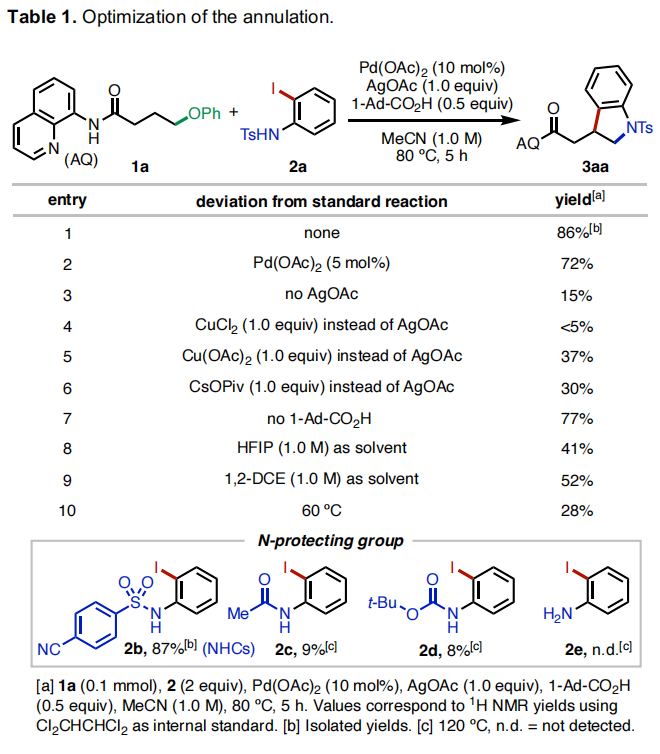
首先,作者选择连有8-氨基喹啉(AQ)的醚1a和N-Ts保护的邻碘苯胺2a作为模板底物进行反应探索(Table 1)。当使用Pd(OAc)2 (10 mol%), AgOAc (1.0 equiv), 1-Ad-CO2H (1-adamantanecarboxylic acid) (0.5 equiv),在MeCN (1.0 M) 中80 °C反应5小时可以以86%的分离产率得到产物3aa(Table 1, entry 1)。
(图片来源:Angew. Chem. Int. Ed.)
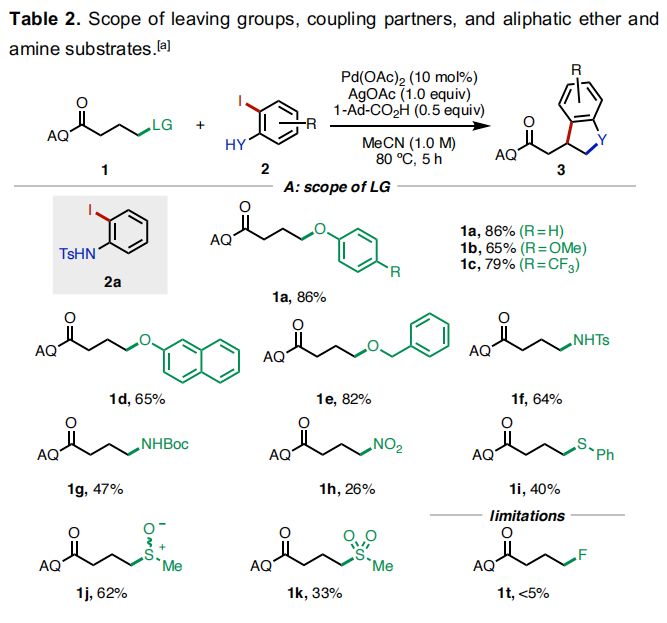
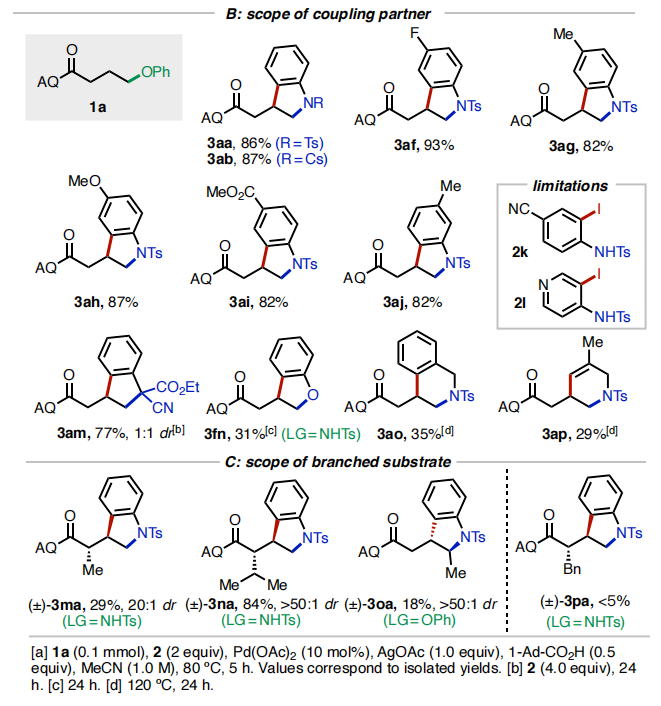
随后,作者对此反应的底物范围进行了考察(Table 2)。首先,作者对不同的离去基团进行了考察(Table 2A)。实验结果表明,一系列含氧、氮、硫离去基团均可兼容,分别通过C-O、C-N以及C-S键的断裂以26-86%的产率实现产物1a-1k的合成。遗憾的是,当使用氟原子作离去基时反应不发生。随后,作者对不同取代的邻碘苯胺(酚)2的兼容性进行了考察(Table 2B)。实验结果得出此转化具有良好的底物适用性和官能团兼容性(卤素、甲基、甲氧基、酯基、氰基等),以29-93%的产率得到产物3aa-3ap。值得注意的是,邻碘苯酚也可以作为偶联配偶体实现此[3+2]环化(3fn, 31%)。接下来,作者对连有支链的底物适用性进行了考察(Table 2C)。α-异丙基取代的底物反应较好,以84%的产率得到3na。而α-甲基和苄基取代的底物则相对差一些(3ma, 29%;3oa, 18%)。此外,γ-甲基取代的底物仅以<5%的产率得到产物3pa。
(图片来源:Angew. Chem. Int. Ed.)
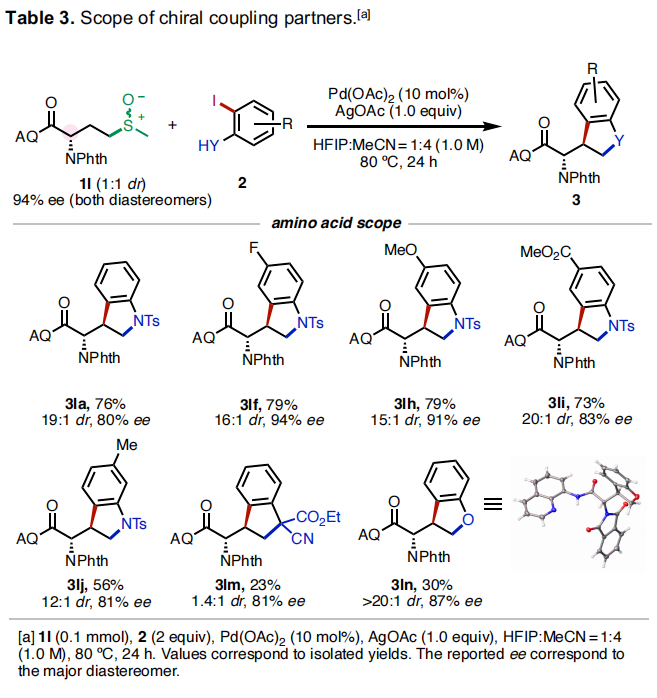
接下来,作者对光学纯的L-甲硫氨酸所衍生的起始原料1l的反应性进行了探索(Table 3)。实验结果表明,稍微改变反应体系(HFIP/MeCN作溶剂,不需要1-Ad-CO2H作添加剂),1l可以顺利与不同取代的芳基碘化物反应,以23-79%的产率,81-94% ee得到相应的产物3la-3ln。此外,(rac)-3ln通过单晶衍射表明NPhth基团与新形成的C-C键在异侧。利用此方法可以实现其它方法难以获得的α-氨基酸衍生的杂环化合物的合成。
(图片来源:Angew. Chem. Int. Ed.)
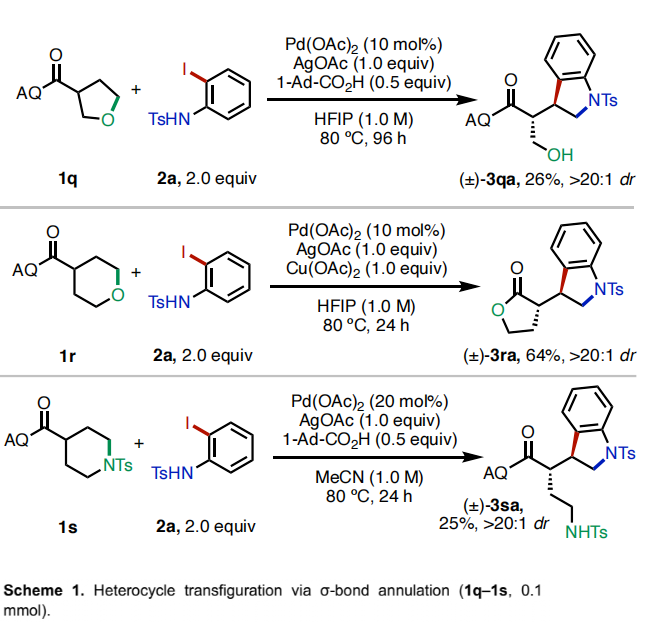
接下来,作者将此β-消除策略应用于非张力杂环的开环转化(Scheme 1)。当作者使用消旋的四氢呋喃类化合物1q作为起始原料时,以HFIP为溶剂时,可以以26%的产率得到单一非对映体的吲哚啉产物3qa。当使用四氢吡喃1r为起始原料时,在Cu(OAc)2存在下发生开环后生成的烷氧基会发生原位内酯化以64%的产率得到产物3ra。此外,使用哌啶衍生物1s参与反应时,可以以25%的产率得到开环产物3sa。
(图片来源:Angew. Chem. Int. Ed.)
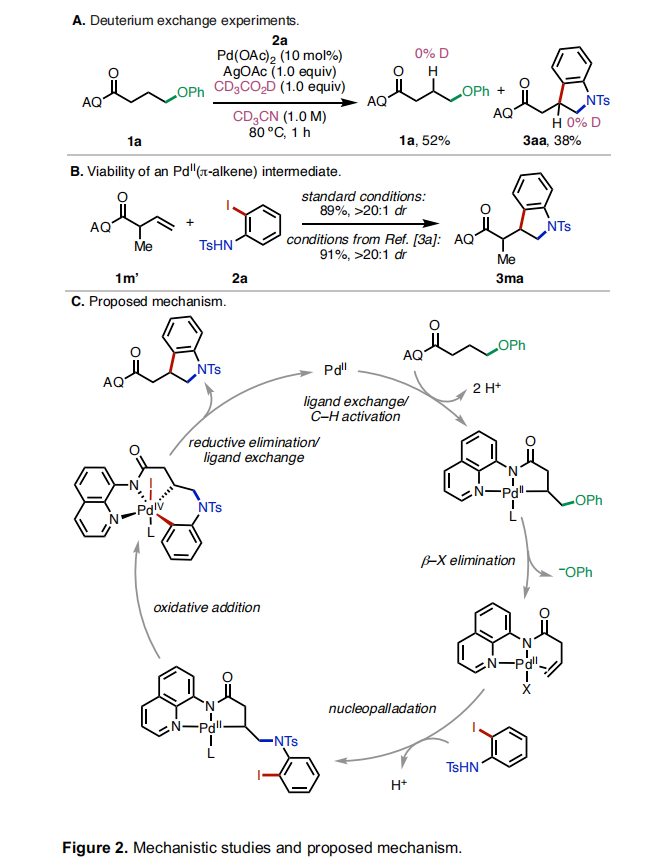
为了深入理解反应机理,作者进行了一系列控制实验。当使用CD3CN作溶剂,CD3CO2D作添加剂时,作者在低转化率时停止反应并没有在产物和回收的起始原料中观察到氘代现象,由此表明C(sp3)-H活化是不可逆的(Figure 2A)。随后,作者制备了烯烃1m’并在标准条件下反应以89%的产率,>20:1 dr得到了产物3ma,由此表明催化循环中可能会涉及PdII(π-alkene)中间体(Figure 2B)。基于上述实验结果和文献报道,作者提出了可能的反应机理(Figure 2C):首先,底物与PdII配位并发生C(sp3)-H活化得到烷基钯环中间体。由于双螯合氨基喹啉导向基的存在,使得β-H消除与β-杂原子消除相比是不利的。因为顺式β-H消除所涉及的[5-5-4]三环过渡态与反式β-杂原子消除的[5-5]双环过渡态相比增加了环张力。因此,烷基钯环中间体在经历β-杂原子消除后得到了PdII(π-alkene)中间体。接下来,PdII(π-alkene)中间体经历了亲核钯化、氧化加成以及还原消除得到产物。
(图片来源:Angew. Chem. Int. Ed.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn