


文章链接:http://doi.org/10.1126/science.add5787
2023年8月4日,北京大学医学部基础医学院/北京大学第三医院医学创新研究院姜长涛教授团队、北京大学第三医院乔杰院士团队、北京大学化学学院雷晓光教授团队与合作者,在Science杂志在线发表了题为“Microbial-host-isozyme analyses reveal microbial DPP4 as a potential antidiabetic target”的研究论文,首次提出了肠道菌源宿主同工酶(Microbial-host-isozyme,MHI)新概念,发现菌源宿主同工酶在肠道中的广泛存在,可以有效模拟宿主酶的功能,并参与疾病的发生发展。其中,菌源二肽基肽酶4(Dipeptidyl peptidase 4, DPP4)能够通过分泌进入宿主体内,降解宿主胰高血糖素样肽-1(Glucagon-like peptide-1, GLP-1),诱导糖耐量异常。宿主DPP4抑制剂西格列汀无法有效抑制菌源DPP4活性,当患者菌源DPP4富集,会导致了西格列汀临床治疗的低响应性,该工作系统揭示了西格列汀临床响应性个体差异的机制与作用靶点;并进一步筛选发现Daurisoline-d4 (Dau-d4)能够通过特异性抑制菌源DPP4,增加 GLP-1,降低血糖。该研究构建了“靶点发现—机制验证—药物筛选—疗效验证”的全链条研究体系,为后续基础研究与临床治疗提供了新的研究思路与方向。
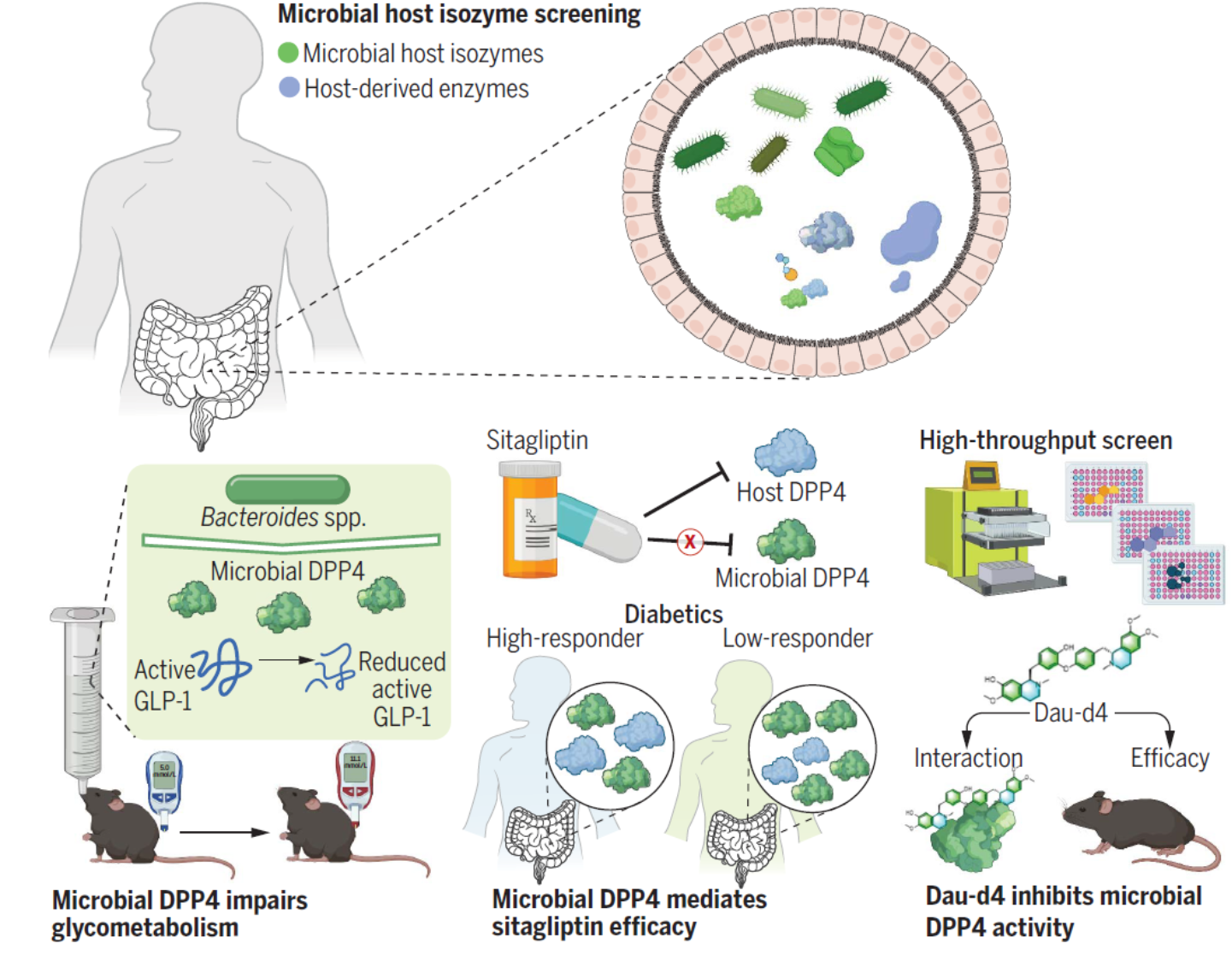
图1. 微生物—宿主同工酶分析揭示微生物DPP4,介导西格列汀临床治疗响应性,是一个潜在的抗糖尿病靶点。

图2. 肠道菌源宿主同工酶挖掘体系
肠道菌群在与宿主长期共进化的过程中,可能存在一些酶发挥着和宿主酶相同的催化功能(菌源宿主同工酶),来调节宿主的生理与病理生理功能。然而,很难通过基于测序的研究来鉴定这些微生物—宿主同工酶,因为在不同物种中具有相似功能的酶可能缺乏序列保守性。研究人员基于110种已经报道的宿主重要疾病靶点酶,包括氧化还原酶、转移酶、水解酶、裂解酶、异构酶、连接酶6大类目前已知的全部酶促反应类型,建立了一套完整的菌源宿主同工酶挖掘与评价体系。该体系基于稳定模拟宿主粪便菌群组成的体外反应体系及不同酶活特异性检测方法,能够灵敏检测复杂菌群环境中的目标酶活性。利用该系统,研究人员评估了健康志愿者粪便群菌群培养物中的菌源宿主同工酶活性,发现有71种酶在肠道菌群中存在同工酶,这些酶种类多样、功能全面,提示菌源宿主同工酶在肠道中广泛存在,可能有效模拟宿主酶的功能。在发现的这些菌源宿主同工酶中,菌源DPP4显示出最强的普遍性和稳定性。进一步,研究人员发现菌源DPP4可以在肠屏障损伤情况下,通过分泌进入宿主体内,降解宿主活性GLP-1,诱导糖耐量损伤。该部分研究提出了菌源宿主同工酶新概念,并首次揭示菌源DPP4的生理与病理生理功能。
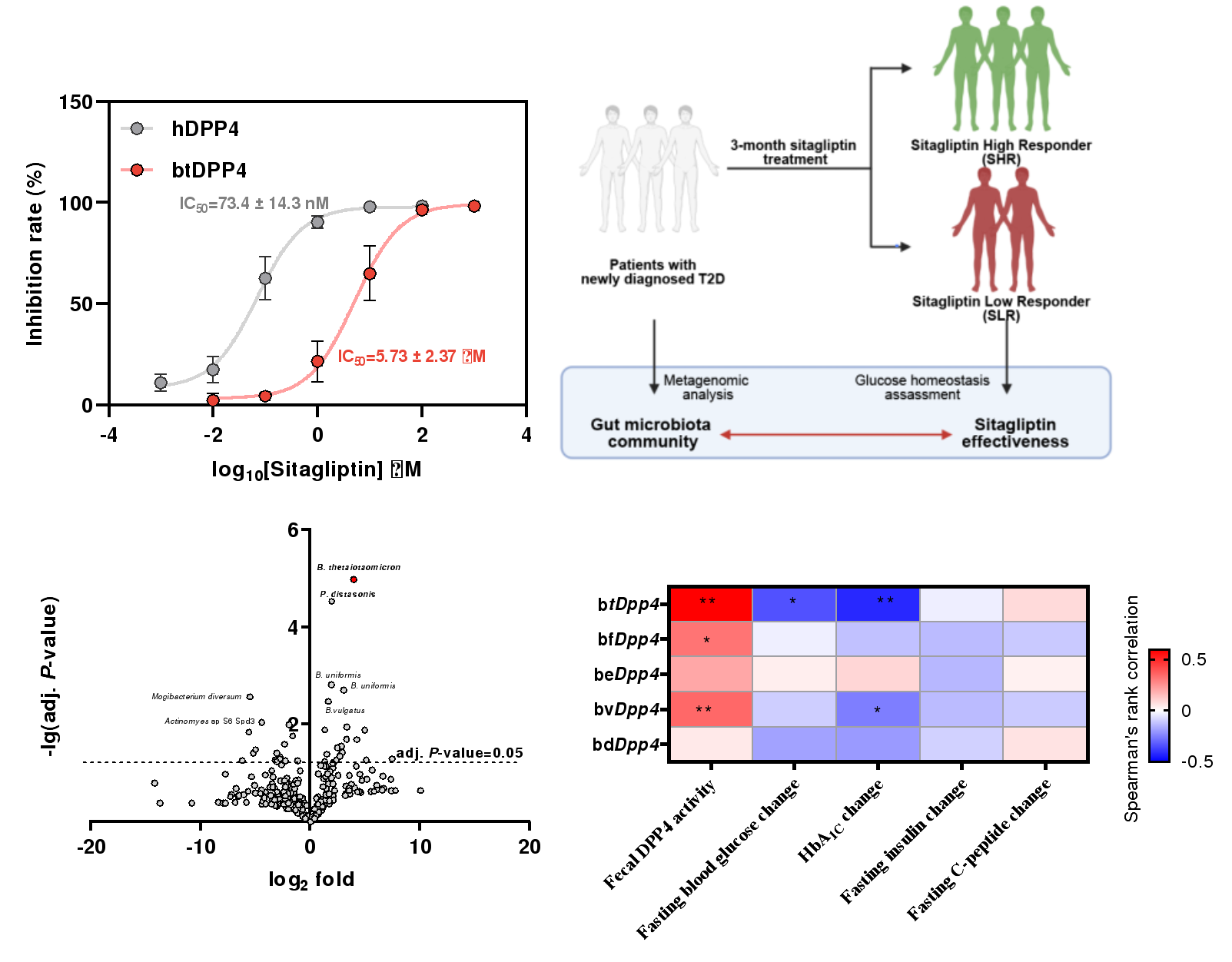
图3. 肠道菌源DPP4影响临床西格列汀疗效
随后,研究人员利用酶活抑制实验及西格列汀与菌源DPP4的共结晶分析发现,广泛用于2型糖尿病临床治疗的DPP4抑制剂西格列汀无法有效抑制菌源DPP4,基于此,研究人员进一步招募了57名初诊2型糖尿病患者进行了为期3个月的西格列汀干预研究,不同患者对西格列汀干预的疗效具有较大的个体差异。基于多组学关联分析、菌群移植、噬菌体靶向干预实验,研究人员发现多形拟杆菌产生的btDPP4介导了西格列汀临床治疗的低响应性,为西格列汀临床响应性个体差异的提供了分子机理与作用靶点。
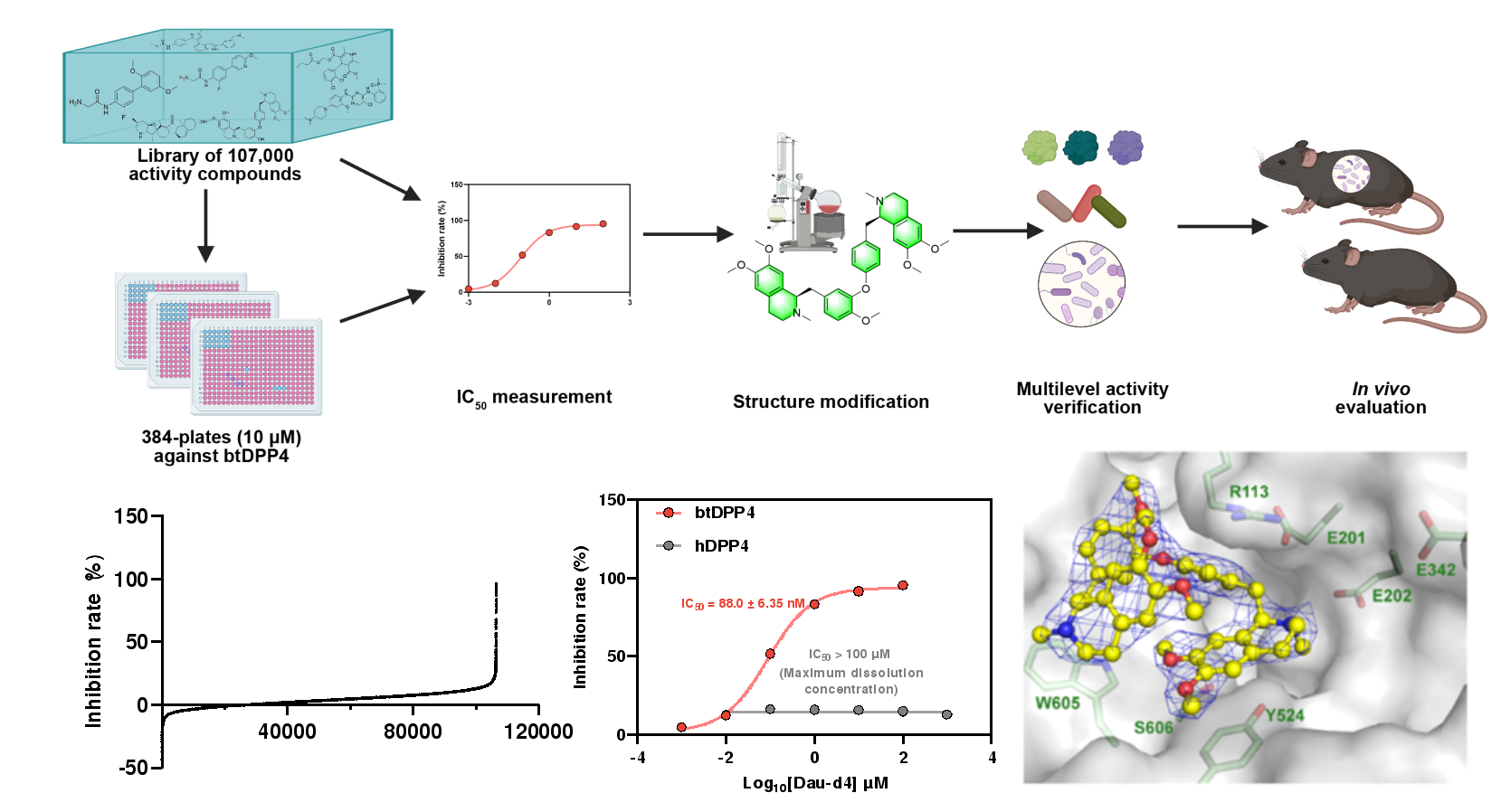
图4. 高通量筛选发现菌源DPP4特异性抑制剂
上述结果提示菌源DPP4是2型糖尿病的新型菌源治疗靶点。因此,研究人员建立了靶向菌源DPP4的高通量药物筛选体系,通过对约107,000个小分子化合物的高通量筛选结合结构改造以及构效关系分析,研究人员确定了蝙蝠葛苏林碱的衍生物Dau-d4是一种强效高选择性的菌源DPP4抑制剂,并且通过晶体结构解析揭示了Dau-d4特异性地抑制菌源DPP4而对宿主DPP4无抑制作用的结构基础。Dau-d4在高脂饮食、DSS饮水等条件以及Dpp4-/-小鼠、ob/ob小鼠等多种动物模型中均可以通过抑制菌源DPP4,增加活性活性GLP-1,改善糖耐量异常,这些结果表明,Dau-d4可以在不干扰菌群整体功能的条件下,特异性靶向菌源DPP4,有效改善小鼠代谢紊乱,是潜在的治疗2型糖尿病的新型药物。解析肠道菌源酶的功能和在代谢性疾病中的作用,有望实现特异性调控菌株功能且不影响菌群组成,从而为靶向肠道菌群的代谢性疾病精准化治疗带来新的突破。
北京大学医学部基础医学院是该论文的第一完成单位,北京大学医学部基础医学院/北京大学第三医院医学创新研究院姜长涛教授、北京大学第三医院乔杰院士、北京大学化学学院雷晓光教授、美国国立卫生研究院Frank Gonzalez研究员、首都医科大学附属朝阳医院王广教授是这一研究成果的共同通讯作者。北京大学医学部基础医学院博士后汪锴、北京大学医学部基础医学院2015级基础八年制张志威、北京大学第三医院杭婧副研究员、首都医科大学附属朝阳医院刘佳教授、北京大学化学学院博士研究生郭富生为本文的共同第一作者。本研究得到女性生育力促进全国重点实验室、血管稳态与重构全国重点实验室的大力支持,得到国家自然科学基金基础科学中心、重点项目、杰出青年科学基金以及国家重点研发计划基金等经费资助。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn