

(图片来源:J. Am. Chem. Soc.)
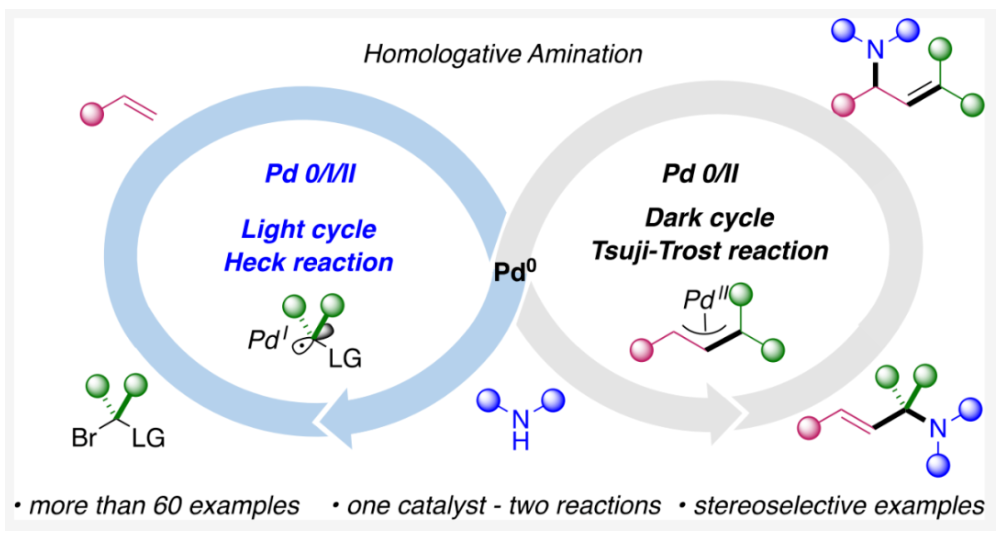
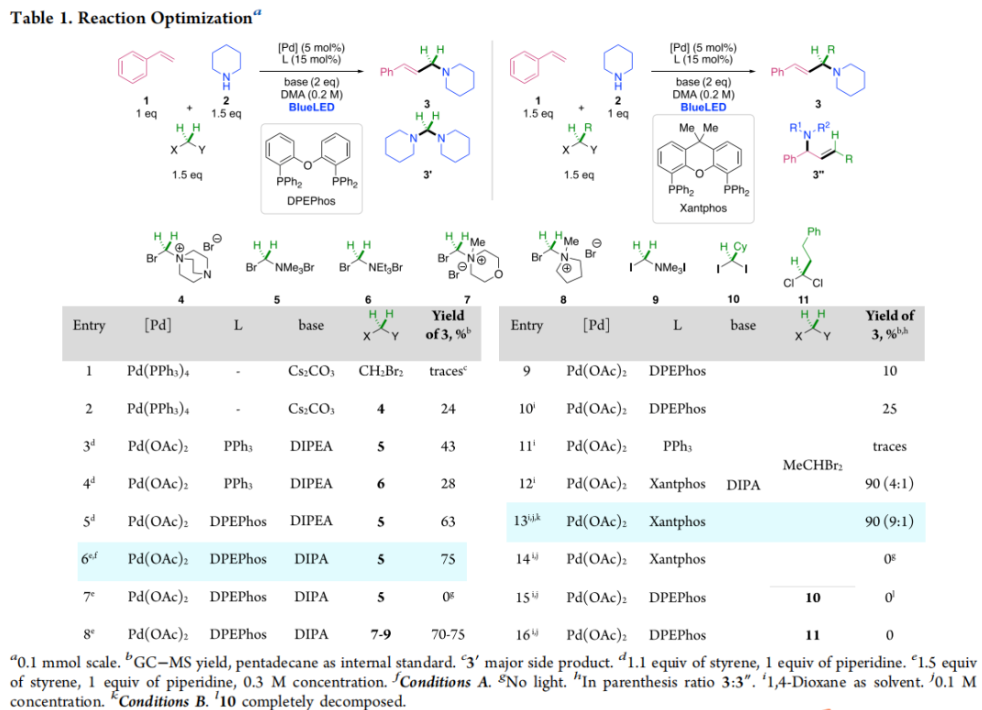
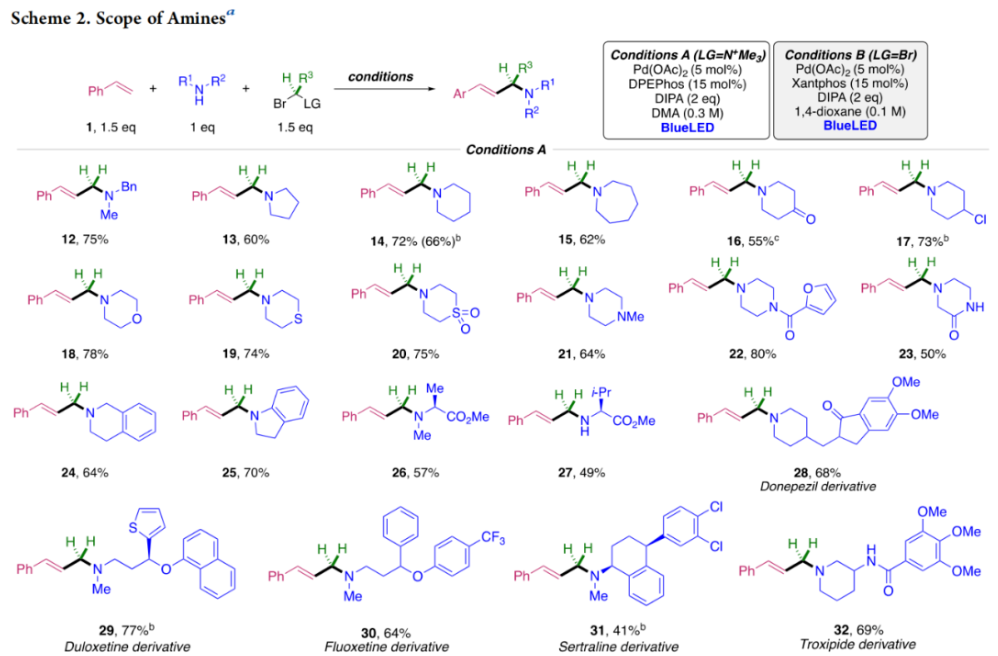
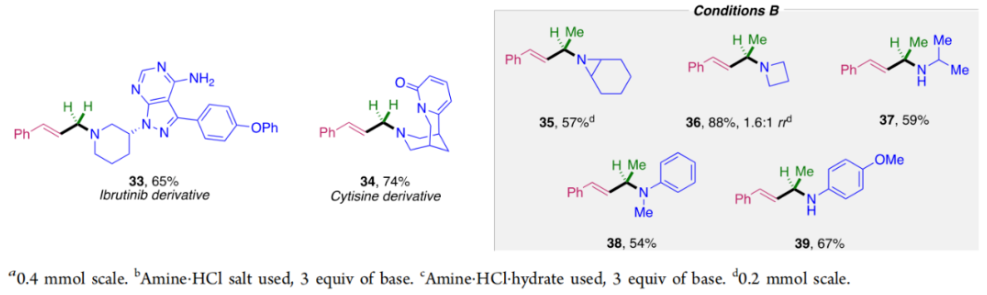
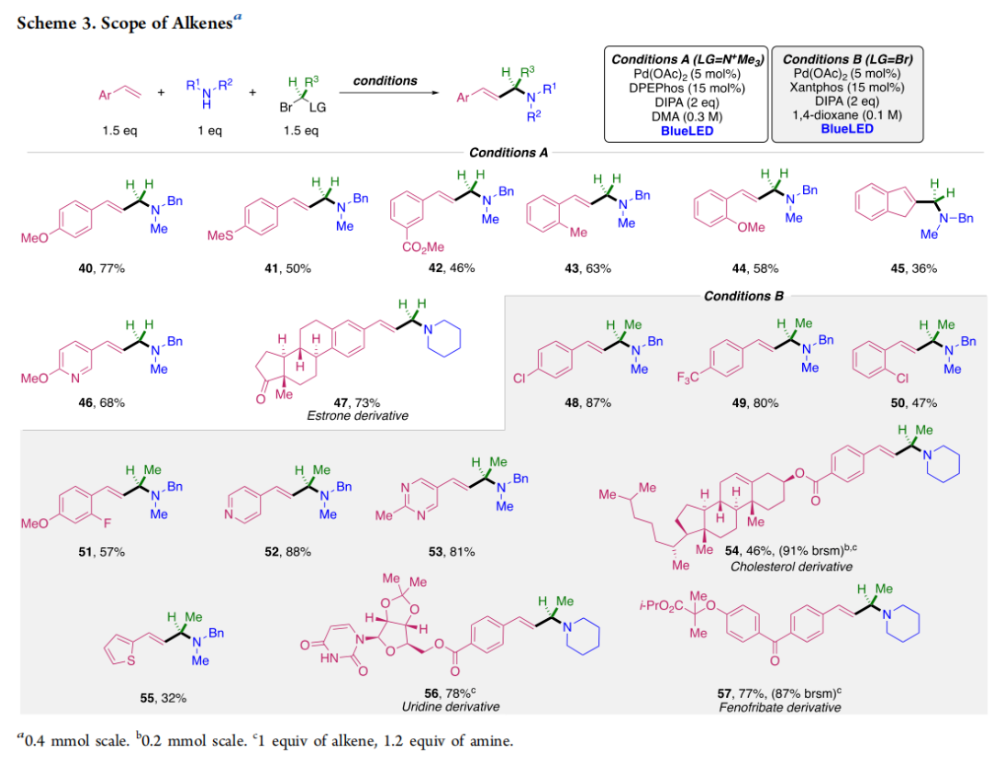
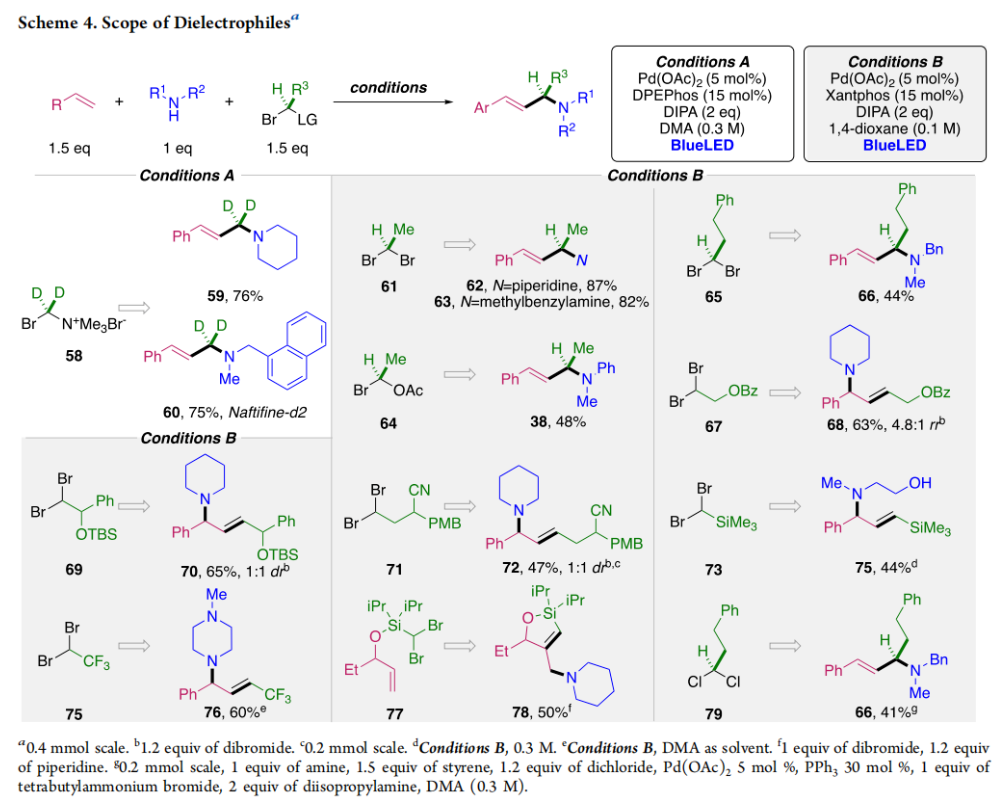
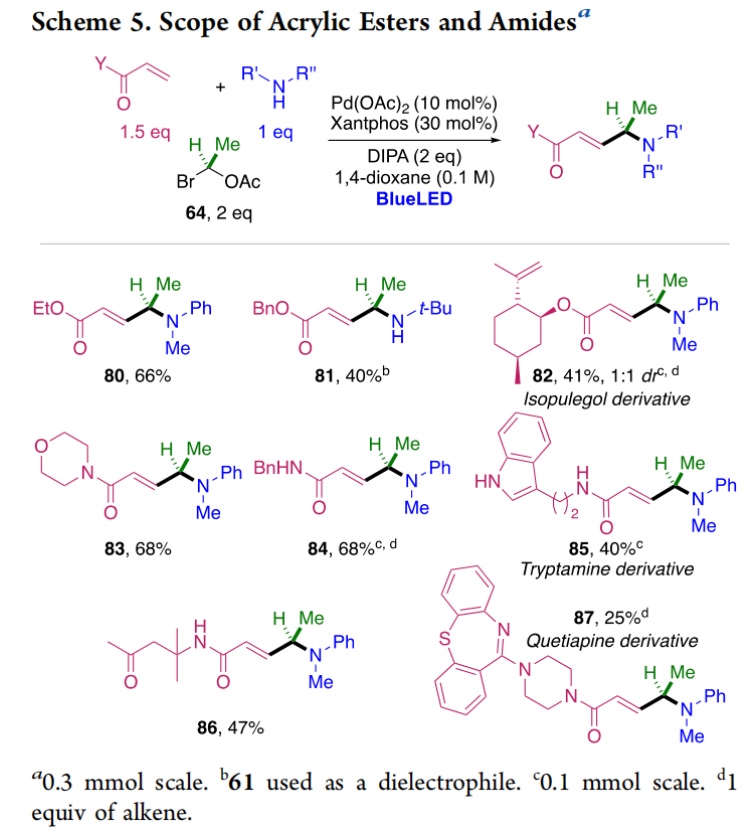
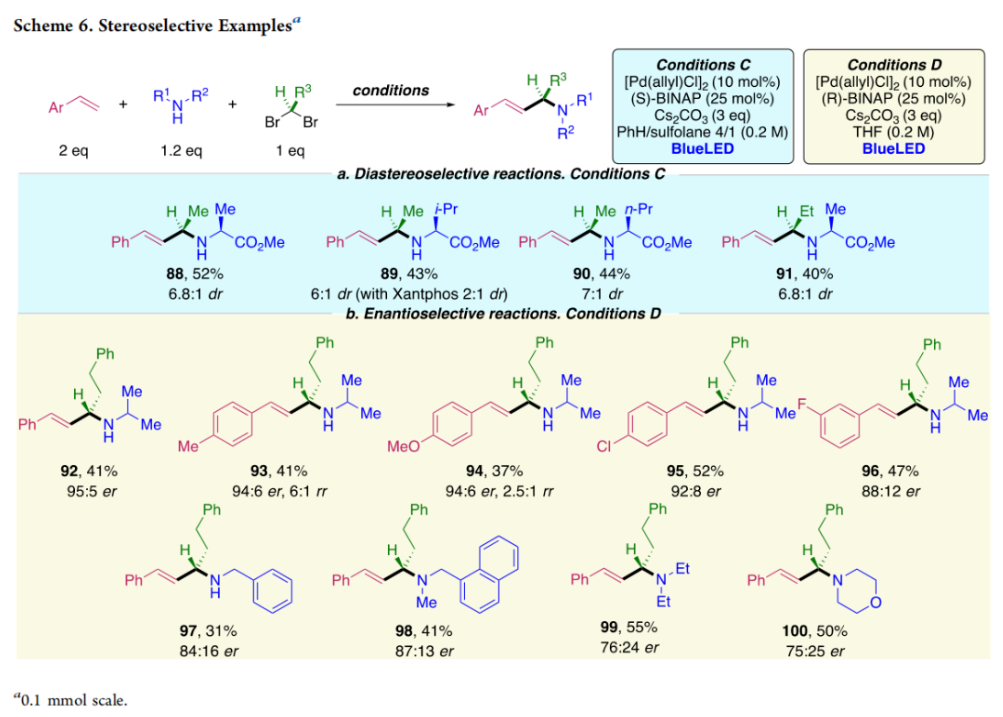
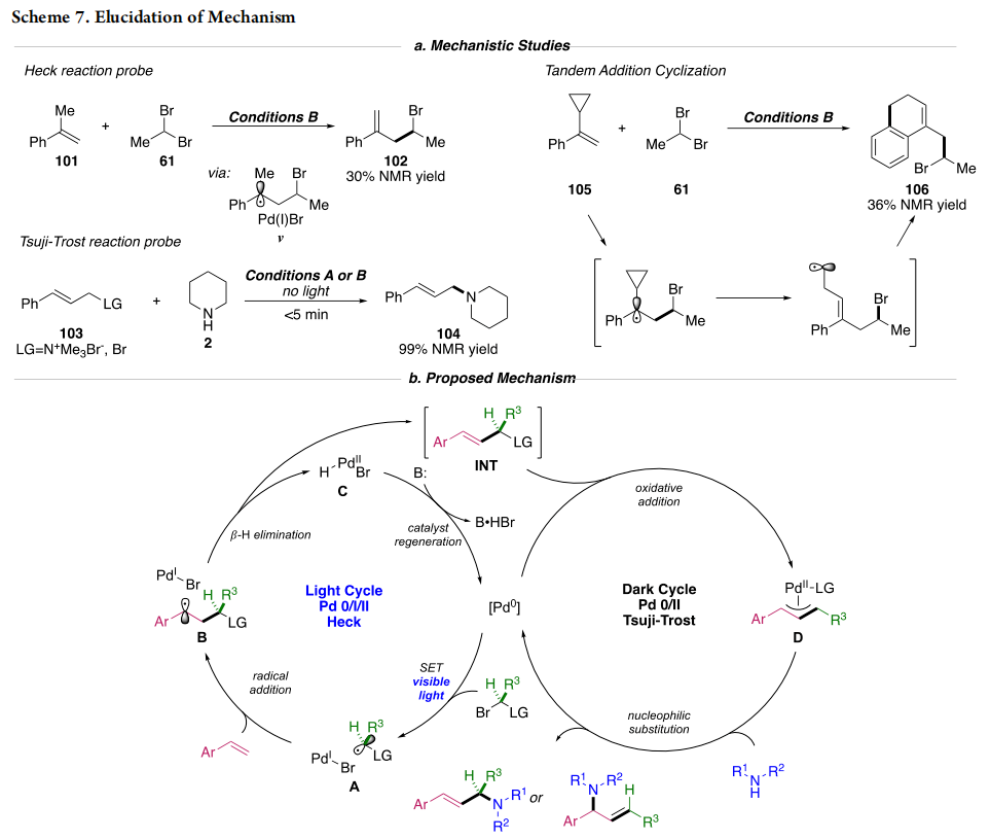
正文 烯丙基胺骨架是生物活性分子以及药物中的重要结构单元(Scheme 1a)。化学家们通过广泛的探索实现了利用各种反应前体高效实现烯丙基胺的构建,包括钯催化的Tsuji-Trost反应、C-H活化反应等(Scheme 1b)。尽管如此,目前所有利用π-烯丙基钯实现烯丙胺的构建方法均依赖于某一特定的起始原料,即围绕着烯丙位上连有离去基(I)、二烯部分(II)或烯丙基C-H (III, IV)的烯丙基亲电试剂所展开的。而使用不同类型的亲电试剂来实现烯丙基胺的合成则可以为化学家提供更多的手段来构建这些重要的骨架。从这个角度来看,直接从不具有烯丙基部分的烯烃来合成烯丙基胺则具有重要的应用价值(Scheme 1c)。2014年,MacMillan课题组发展了光催化的方法,利用预官能团化的烯烃(烯基砜),通过自由基加成/消除策略实现了烯丙基胺的合成(J. Am. Chem. Soc. 2014, 136, 11602)。黄汉民课题组发展了苯乙烯与缩胺醛的Heck-类型C-H烷基化反应实现了烯丙基胺的合成(J. Am. Chem. Soc. 2012, 134, 20613)。虽然这些方法扩大了烯丙基胺前体的范围,但它们均是两组分反应,因此不能直接使用简单易得的伯胺和仲胺作为起始原料。为了克服上述局限性,最近,美国德克萨斯大学达拉斯分校Vladimir Gevorgyan课题组利用烯基(杂)芳烃、伯胺或仲胺、双亲电试剂,在光照下,利用钯催化实现了温和的三组分偶联反应,直接构建了一系列烯丙基胺类化合物(Figure 1d)。下载化学加APP到你手机,更加方便,更多收获。 (图片来源:J. Am. Chem. Soc.) 首先,作者选择苯乙烯1和哌啶2作为模板底物进行反应探索。通过一系列反应参数优化,作者得出当使用1 (1.5 equiv), 2 (1.0 equiv), 5 (1.5 equiv), Pd(OAc)2 (5 mol%), DPEPhos (15 mol%), DIPA (2.0 equiv), 在DMA(0.3 M)中,蓝光照射下反应可以以75%的产率得到烯丙基胺产物3(Condition A)。此外,当使用MeCHBr2作双亲电试剂,XantPhos (15 mol%)作配体,在1,4-二氧六环(0.1 M)中反应可以以90%的产率得到烯丙基胺产物3(Condition B)。控制实验表明蓝光的照射对此转化至关重要。 (图片来源:J. Am. Chem. Soc.) 在得到了最优反应条件后,作者对此转化中胺的底物范围进行了探索(Scheme 2)。实验结果表明此转化对一系列不同取代的二级胺和一级胺均具有良好的兼容性,以41-88%的产率得到相应的烯丙基胺产物12-39。值得注意的是,此体系对一系列复杂生物活性分子衍生物,如Donepezil, Duloxetine, Fluoxetine, Setraline, Troxipide, Ibrutinib, Cytisine等仍具有良好的普适性,证明了此转化的实用性。此外,当使用哌啶盐酸盐直接参与反应时,仍可以以66%的产率得到产物14。 (图片来源:J. Am. Chem. Soc.) 接下来,作者对烯烃的适用范围进行了考察(Scheme 3)。实验结果表明,不同取代的烯基芳烃和烯基杂芳烃均可顺利参与转化,以36-88%的产率得到相应的烯丙基胺产物40-57。一般来讲,在Condition A下,富电子烯基芳烃的反应活性高于缺电子烯基芳烃;而在Condition B下,缺电子烯基芳烃的反应活性高于富电子烯基芳烃。值得注意的是,此转化对于具有复杂生物活性分子骨架的烯烃同样具有良好的普适性。遗憾的是,此体系不能兼容非活化烯烃。 (图片来源:J. Am. Chem. Soc.) 紧接着,作者对双亲电试剂的普适性进行了考察(Scheme 4)。包括氘代的双亲电试剂58在内的一系列双亲电试剂均可兼容,以44-87%的产率得到相应的烯丙基胺产物。值得注意的是,当使用分子内带有烯烃的底物77参与反应时,可以实现非活化烯烃的分子内环化,以50%的产率得到环烯丙基胺产物78。此外,此转化对一系列缺电子烯烃,如丙烯酸酯、丙烯酰胺等同样具有良好的兼容性,以25-68%的产率得到产物80-87(Scheme 5)。 (图片来源:J. Am. Chem. Soc.) 当作者应用手性氨基酸作为胺亲核试剂时,可以以良好的立体控制实现此转化,以40-52%的产率,6:1-7:1的dr得到产物88-91(Condition C)。此外,当作者使用手性配体(R)-BINAP诱导,在Condition D条件下可以实现对映选择性转化,以37-55%的产率,75:25-95:5 er得到产物92-100(Scheme 6)。 最后,为了深入理解反应机理,作者进行了一系列控制实验(Scheme 7A)。根据最初的设计,该串联反应首先经历烷基Heck反应。然而,作者并没有检测到Heck反应产物。作者认为可能是由于随后的Tsuji-Trost取代反应速率较快,因此难以捕获这一中间产物。且这一假设通过下面的实验得到了验证:当使用α-甲基苯乙烯101反应时,通过在中间体V的小位阻侧发生β-H消除,以30%的NMR产率得到高烯丙基溴产物102。而当使用肉桂基亲电试剂103与哌啶2即使在无光照条件下也可以在5分钟内,以接近定量的产率(99%)观察到产物104的形成。此外,当使用环丙基苯乙烯105与61反应时,通过自由基加成、开环以及环化等过程以36%的NMR产率得到自由基环化产物106。此结果不仅证实了烷基Heck反应的发生,也证实了反应经历了自由基类型的转化。上述实验结果表明此转化使用相同的钯催化剂,分别实现了光诱导循环以及热循环两个过程。 基于上述实验结果,作者提出了此转化可能的反应机理(Scheme 7B)。首先,。取代的区域选择性主要由π-烯丙基络合物的取代以及胺的性质所决定。 (图片来源:J. Am. Chem. Soc.) 总结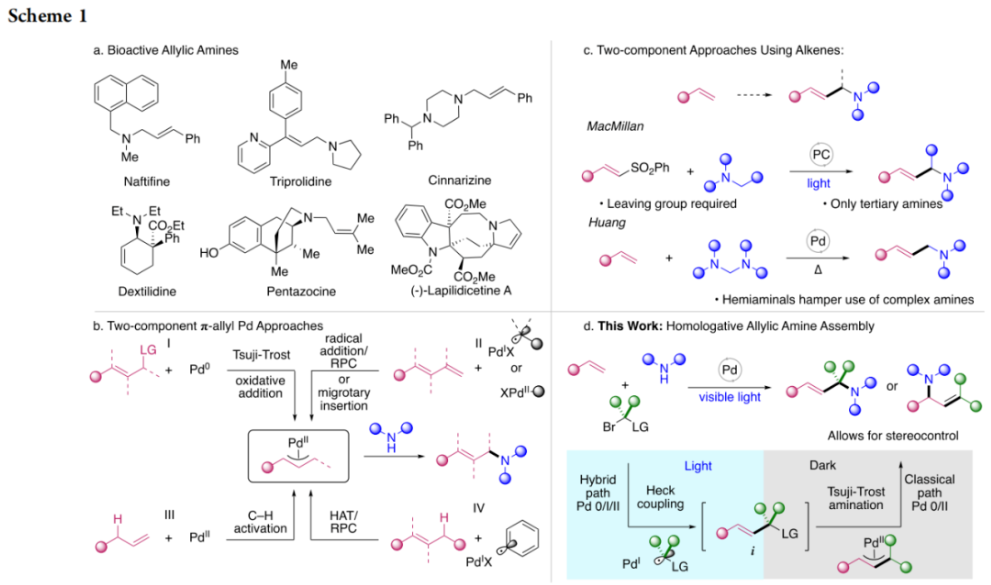
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn