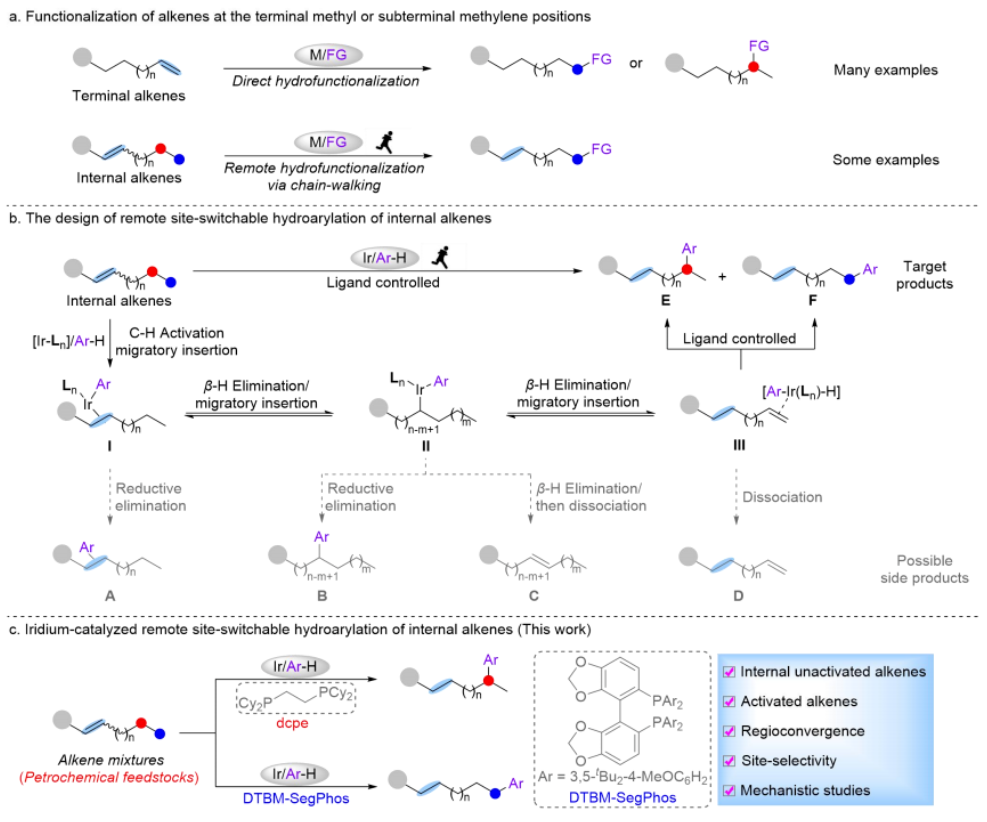
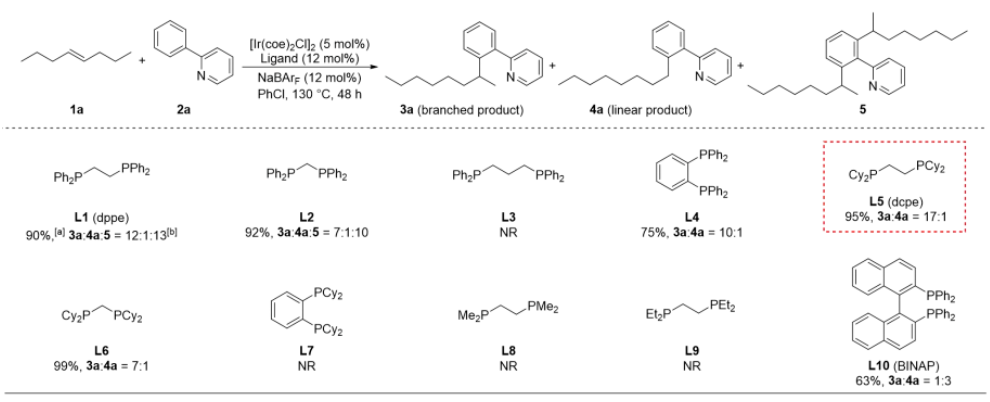
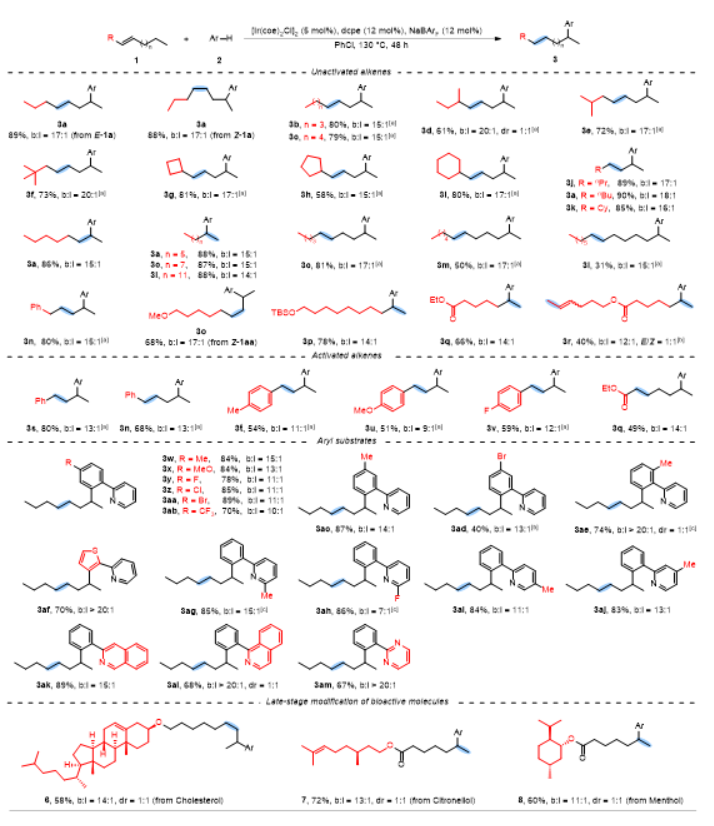
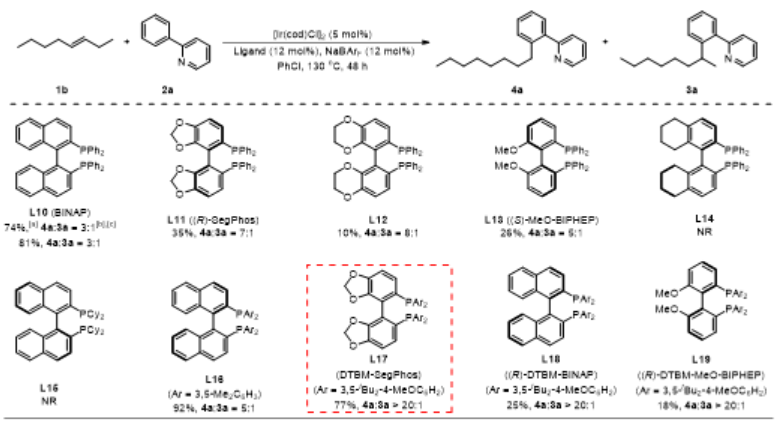
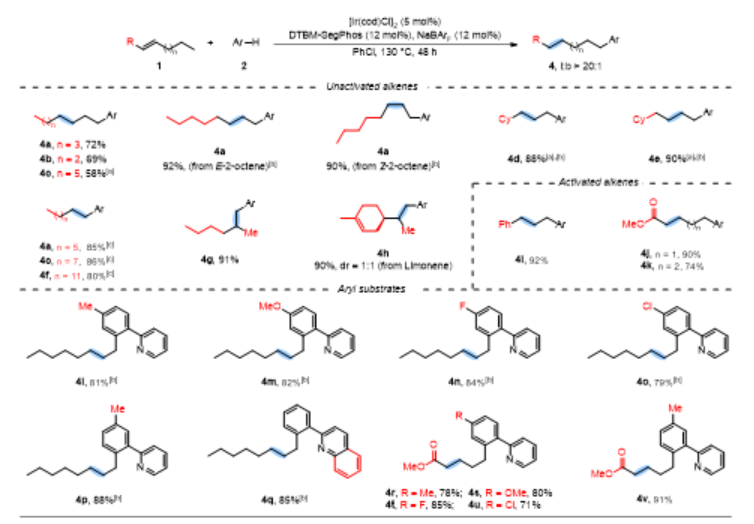
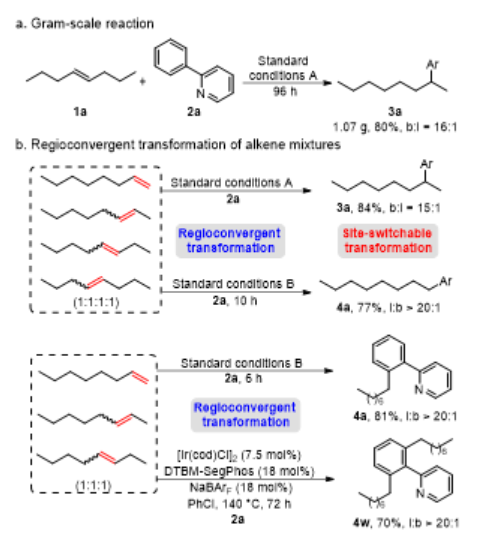
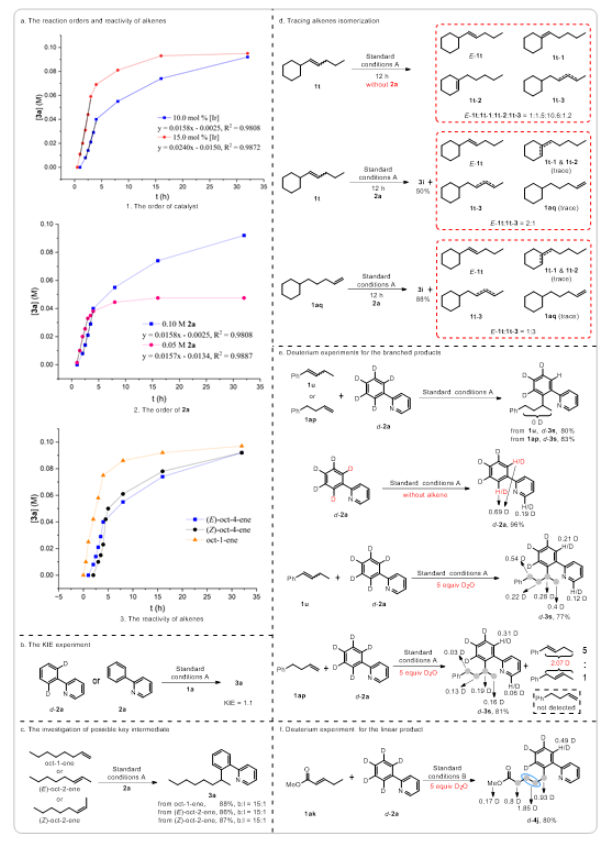
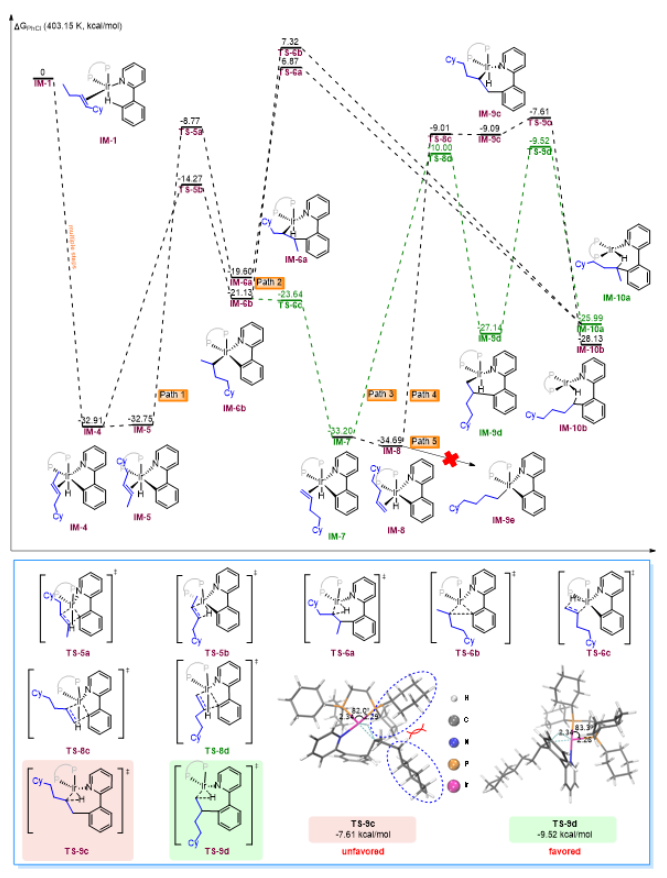
烯烃作为丰富且廉价的石油化工原料,被广泛应用于合成化学、药物化学、材料科学和精细化工等领域。在各种各样的转化中,过渡金属催化的烯烃氢官能化反应能高效构建C-C、C-N、C-O和C-B键等,因此备受关注。在烷基链上次末端亚甲基和末端甲基位置含有官能团的化合物非常重要,它们主要是通过末端烯烃的直接Markovnikov或反Markovnikov氢官能化反应来制备的(Scheme 1a, 上)。与末端烯烃相比,内烯烃也是非常丰富的石油化工原料,通常以异构体混合物的形式存在且更容易获得。在过去的十年中,通过过渡金属催化链行走来实现烯烃的远程氢官能化反应引起了广泛的关注,该策略主要给出官能化在导向基团附近的产物。然而,仅有一些关于内烯烃远程氢官能化反应生成官能化在末端甲基位置产物的例子被报道(Scheme 1a, 下),并且官能化在次末端亚甲基位置产物的制备仍然具有挑战性。因此,开发内烯烃远程位点可调控氢官能化反应制备官能化在次末端亚甲基和末端甲基位置的产物具有重大科学研究意义和工业化价值。下载化学加APP到你手机,更加方便,更多收获。上海交通大学张万斌教授课题组长期进行过渡金属催化不对称氢化反应的研究,并对其中涉及到的金属氢物种有了一定的理解并开展了一些金属氢催化烯烃异构和链行走官能化反应方面的研究(Nat. Chem. 2023, 15, 988-997; ACS Catal. 2023, 13, 4409–4420; Chem. Eur. J.2023, 29, e202300027; Chin. J. Chem.2022, 40, 2269-2275; Angew. Chem. Int. Ed. 2021, 60, 8997-9002; J. Am. Chem. Soc. 2018, 140, 7587-7597)。基于上述研究基础,最近该课题组设计了一种铱催化内烯烃远端位点可调控氢芳基化反应,可以分别得到次末端亚甲基和末端甲基官能化的产物(Scheme 1b)为实现这种转化,应解决以下关键性问题:1) 芳基底物和配体协同促进链行走过程。2) 筛选合适的配体来实现烯烃远端位点选择性氢芳基化。在本研究工作中,该团队报道了由两种不同配体控制的铱催化内烯烃远端位点可调控的氢芳基化反应(Scheme 1c)。该反应表现出良好的官能团耐受性,通过分别使用商业可得的配体dcpe和DTBM-SegPhos制备在烷基链上次末端亚甲基和末端甲基位置官能化的产物,且所得产物具有良好的产率和良好至优异的位点选择性。Scheme1. Hydrofunctionalization of alkenes and the design of this work.首先作者对反应条件进行筛选(Scheme 2),发现当使用链状的双膦配体dppe (L1)时,能以不错的结果得到目标产物3a,但观察到大量的二烷基化的副产物5;进而作者改变配体链长以及骨架结构(L2-L4),并没有得到令人满意的结果;令人高兴的是,当把配体P原子上的取代基变成环己基时(L5),能够以95%的转化率,b:l = 17:1的选择性得到支链芳基化的产物3a。当改变链长,骨架结构以及P原子上的取代基时(L6-L9),均没有得到更好的结果,有趣的是,对于BINAP类型的配体(L10),产物的选择性得到了一定程度的翻转(b:l = 1:3)。Scheme 2. Ligand screening of the remote hydroarylation of alkene. Reaction conditions: 1a (0.5 mmol), 2a (0.2 mmol), [Ir(coe)2Cl]2 (5 mol%), Ligand (12 mol%), NaBArF (12 mol%), PhCl (2 mL), 130 °C , 48 h. [a] The conversion is based on 2a. [b] The ratio of 3a:4a:5 was determined by 1H NMR of the crude product. NR = no reaction. coe = cyclooctene; NaBArF = sodium tetrakis[3,5-bis(trifluoromethyl)phenyl]borate; Cy = cyclohexyl.在获得最优反应条件后,作者对底物的适用范围进行了考察,该催化体系能够以高收率和良好至优异的位点选择性得到一系列次末端亚甲基官能化的产物,并且该催化体系具有良好的底物适用范围和官能团耐受性。对于非活化内部烯烃:E式和Z式烯烃底物都能呈现出高的收率和区域选择性;对于烷基左侧的取代基,无论是更长的链长、仲丁基、异丁基、叔丁基、各种环状取代基都能以令人满意的结果得到目标产物(3b-3i);减少烯烃异构次数的底物和增加烯烃异构次数的底物在该催化条件下也都能得到耐受(3j-3l);对于含有官能团的烯烃底物在该条件下也能以不错的收率和高的选择性给出支链产物(3n-3r)。对于活化烯烃:反应经历了去共轭的烯烃异构,以不错的收率和选择性给出支链产物(3s-3q)。接下来作者对芳基底物的适用范围进行了考察:苯环和吡啶环上无论带有供电子取代基、吸电子取代基、噻吩杂环、2-苯基喹啉,2-苯基异喹啉,目标产物均能顺利获得(3w-3am)。最后,作者将该催化方法应用到天然产物的后修饰中,并顺利得到远端支链芳基化的天然产物的衍生物(6-8) (Scheme 3)。Scheme 3. Substrate scope for the branched products.Reaction conditions: alkene 1 (0.5 mmol), aryl substrate 2 (0.2 mmol), [Ir(coe)2Cl]2 (5 mol%), dcpe (12 mol%), NaBArF (12 mol%), PhCl (2 mL), 130 °C, 48 h. Isolated yield. The ratio of branched to linear (b:l) was determined by 1H NMR of the crude product. [a] Mixture of E/Z-alkenes. [b] 72 h.[c] L4 was used. Ar = 2-(2-pyridine)C6H4 unless otherwise noted.随后作者尝试了远端直链选择性氢芳基化反应,基于之前配体筛选结果(Scheme 2,L10),首先作者筛选了一系列结构类似BINAP类型的配体(Scheme 4,L11-L19),发现当使用DTBM-SegPhos时(L17),能够以77%的转化率,专一性的位点选择性得到直链芳基化产物4a。Scheme 4. Ligand screening of the remote hydroarylation of alkene for the linear product. Reaction conditions: 1b (0.5 mmol), 2a (0.2 mmol), [Ir(cod)Cl]2 (5 mol%), Ligand (12 mol%), NaBArF (12 mol%), PhCl (2 mL), 130 °C, 48 h. [a] The conversion is based on 2a. [b] The ratio of 4a:3a was determined by 1H NMR of the crude product. [c] [Ir(coe)2Cl]2 (5 mol%). cod = 1,5-cyclooctadiene.在筛选到最优反应条件后(Scheme 4, L11),作者对烯烃底物的适用范围进行了考察(Scheme 5):带有不同烷基取代基的3-烯烃底物能以良好的收率提供相应的产物(4a-4c);E-和Z-2-辛烯均能与2a顺利反应,以优异的收率(92%和90%)得到产物;环己基取代的2-烯烃底物能以良好的产率得到相应的产物(4d, 4e);末端烯烃也能适用于该催化体系(4c, 4f),并伴有痕量的二烷基化产物(<10%);1,1-二取代烯烃和柠檬烯也能以优异的收率提供相应的产物(4g, 4h)。对于活化的内烯烃,例如苯乙烯衍生物和α,β-不饱和酯,反应也能顺利进行(4i-4k)。接下来,作者针对简单烯烃研究芳基底物的适用范围:在苯环的对位或间位具有取代基的芳基底物以良好的收率得到相应的产物(4l-4p);底物2-苯基喹啉也能得到相应的产物4q。最后,作者针对活化烯烃考察了芳基底物的适用范围:在苯环对位带有给电子基团或吸电子基团的芳基底物能以良好的产率提供相应的芳基化产物(4r-4u);苯环间位带有甲基取代基的底物也能得到相应的产物4v。应该指出的是,所有产物都具有专一的位点选择性。Scheme 5.Substrate scope for the linear products. Reaction conditions: alkene 1 (0.5 mmol), aryl substrate 2 (0.2 mmol), [Ir(cod)Cl]2 (5 mol%), DTBM-SegPhos (12 mol%), NaBArF (12 mol%), PhCl (2 mL), 130 °C, 48 h. Isolated yield. The linear product was obtained exclusively, which was determined by 1H NMR of the crude product. [a] Mixture of E/Z-alkenes. [b] 12 h. [c] 6 h. Ar = 2-(2-pyridine)C6H4 unless otherwise noted.作者对开发体系的实用性进行了研究,首先反应体系可以放大至克级规模,并保持与标准条件下相当的实验结果(80% yield, b:l = 16:1) (Scheme 6a)。随后,烯烃混合物的区域收敛式远端氢芳基化反应也可以成功实现,并且可以通过改变反应条件得到单烷基化产物4a和二烷基化产物4w (Scheme 6b)。Scheme 6. Gram-scale reaction and the applications.为了研究反应历程,作者设计了一系列控制实验:首先对反应的动力学进行了研究,发现该催化体系对于催化剂是一级,对于芳基底物是零级(Figure 1a);反应的KIE值是1.1,表明C-H键活化不是决速步骤(Figure 1b);1-辛烯,(Z)-2-辛烯和(E)-2-辛烯能给出相似的结果,证明末端烯烃和内烯烃在给出支链选择性芳基化产物过程中可能经历相同关键中间体(Figure 1c);进而作者对烯烃异构过程进行跟踪,发现没有芳基底物存在的情况下烯烃不会向末端异构,而是通过1,3-H迁移机理异构为热力学更稳定烯烃异构体,当加入芳基底物时检测到烯烃主要向末端异构;而对于末端烯烃,在2a存在下也只检测到烯烃异构到内部,没有环内烯烃;这些结果说明在C-H键活化后的链行走过程是通过1,2-H迁移机理进行的(Figure 1d);氘代实验证明了该链行走过程是一个可逆的过程(Figure 1e和1f)。鉴于内烯烃远端甲基官能化反应机理已有研究报道,接下来作者基于上述控制实验结果并结合DFT计算,重点研究了功能化在次末端亚甲基位置的反应历程(Figure 2)。通过DFT计算,在烯烃底物存在下,2-苯基吡啶与铱催化剂发生C-H键氧化加成得到[Ir-H]物种,接下来烯烃对[Ir-H]物种进行迭代的迁移插入和β-H消除实现烯烃的异构,得到中间体IM-4。从IM-4开始,有五种可能的反应途径生成目标产物。作者比较了五种可能的反应路径,发现路径3为最优:中间体IM-4通过迁移插入Ir-H键,得到中间体IM-6b,随后发生β-H消除得到末端烯烃的[Ar-Ir-H]络合物IM-7。紧接着,末端烯烃迁移插入Ir-C键后,得到中间体IM-9d,其中芳基加成到次末端亚甲基位置。最后通过C-H键的还原消除得到中间体IM-10a,在与另一分子烯烃底物交换后,目标产物生成同时伴随着下一个催化循环的开始。因为过渡态TS-9c的能量比过渡态TS-9d的能量要低(TS-9d: -9.52 kcal/mol vs TS-9c: -7.61 kcal/mol, ΔG‡ = 1.91 kcal/mol),所以产物以支链选择性为主。作者通过对两个关键过渡态(TS-9c和TS-9d)的空间结构分析发现:过渡态TS-9c中烯烃底物1t的烷基链和环己基取代基与配体的P原子上的二环己基取代基之间存在一定的空间相互作用;然而,这种空间排斥作用在过渡态TS-9d中得到减轻,因为在过渡态TS-9d中,烯烃底物1t的环己基远离配体P原子上的二环己基取代基,正是由于烷基链或环己基取代基与配体P原子上的二环己基取代基之间的空间相互作用导致了两个过渡态的能量差异。Figure 1.Control experiments.Figure 2.DFT calculations for the five possible reaction pathways.综上所述,本文报道了一种由配体控制的铱催化烯烃远端位点可调控氢芳基化反应,以良好的产率和良好至优异的位点选择性得到官能化在烷基链上次末端亚甲基和末端甲基位置的芳基化产物。机理研究的结果表明,该反应历程首先发生快速的链行走,得到末端烯烃和[Ar-Ir-H]配位的络合物,随后的过程通过改进的Chalk−Harrod机理进行:末端烯烃迁移插入到Ir−C键中,然后发生C-H键还原消除得到氢芳基化的产物。上述研究工作近期发表于Angew. Chem. Int. Ed.,第一作者为上海交通大学李飞博士,通讯作者为上海交通大学张万斌教授和袁乾家副教授。文献详情:
Fei Li, Yicong Luo, Jinbao Ren, Qianjia Yuan, Deyue Yan, Wanbin Zhang*. Iridium-Catalyzed Remote Site-Switchable Hydroarylation of Alkenes Controlled by Ligands. Angew. Chem. Int. Ed. 2023, https://doi.org/10.1002/anie.202309859