

正文
轴手性联芳基双膦是一种非常有用的优势的配体,在金属催化的不对称反应中得到了广泛的应用。研究表明,轴手性联芳基双膦配体-金属配合物的二面角是影响不对称催化性能的关键因素之一。其根本原因是二面角与靠近金属中心的四个芳基不对称排列形成的“手性袋”密切相关。改变二面角会影响芳基在配位膦原子上的空间位置,从而导致手性环境的改变(Scheme 1)。因此,开发具有二面角可调的轴手联芳基双膦配体至关重要。
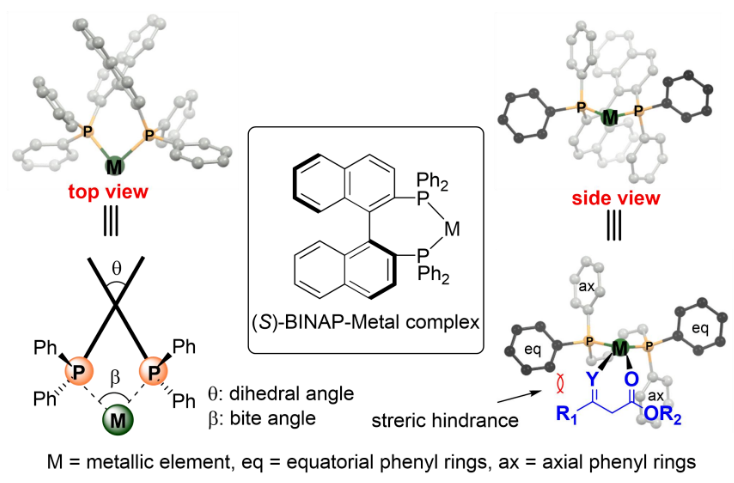
Scheme 1. Dihedral Angle and Steric Hindrance Induced by Phosphorus Substituents
上海交通大学张万斌教授课题组利用“角度调控”策略开发了一系列新型高效的手性配体/催化剂,并在不对称催化反应中取得了高效的不对称催化效果(Acc. Chem. Res.2022, 55, 2708;CCS Chem. 2023, 5, 361;J. Am. Chem. Soc. 2022, 144, 20078;Angew. Chem. Int. Ed. 2021, 54, 1641;Angew. Chem. Int. Ed. 2020, 59, 20814;Angew. Chem. Int. Ed.2014, 53, 1901;Chem. Commun.2014, 50, 1227;Angew. Chem. Int. Ed. 2013, 52, 2203;J. Am. Chem. Soc. 2010, 132, 15939;Tetrahedron Lett. 2010, 51, 2044)。最近,基于前期开发的Cn-BridgePohs,该课题组提出用柔性醚链代替刚性碳链,设计合成了新型Em n-Bridgephos配体(这里的“n”和“m”分别指醚链上的所有原子个数和氧原子个数),并成功应用于α-乙酰氨基-1,3-茚二酮衍生物的对映选择性不对称氢化反应(Scheme 2)。一方面,柔性醚链的引入能够有效地减轻对联苯骨架旋转的束缚,从而获得更大的二面角调控范围;另一方面,含有氧和碳原子的醚链有更多组合的可能性,能够提供更精细的二面角调控。下载化学加APP到你手机,更加方便,更多收获。
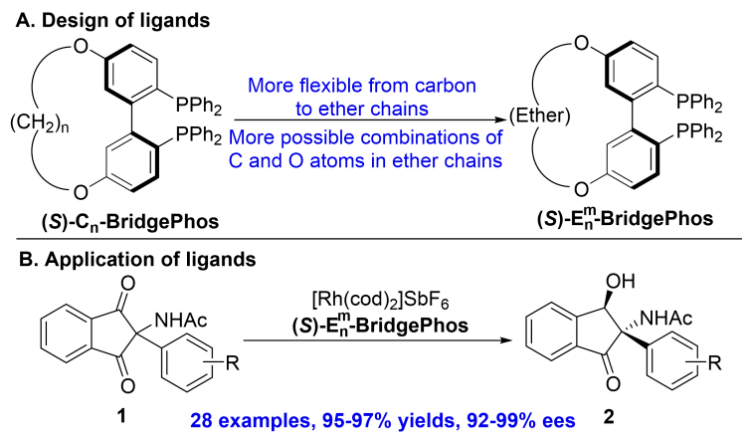
Scheme 2. Design of BridgePhos Ligands and Their Application
作者共设计和合成了6种具有不同醚链桥的Em n-BridgePhos配体(Scheme 3)。
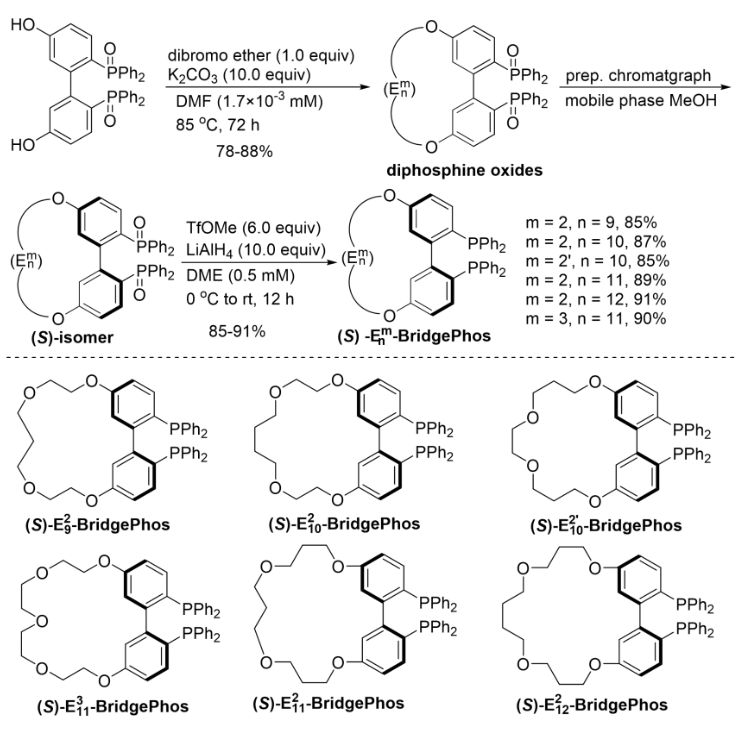
Scheme 3. Synthesis of Em n-BridgePhos ligands
作者对Em n-BridgePhos-Rh配合物进行了X射线分析(Figure 1)。结果表明,与Cn-BridgePhos相比,Em n-BridgePhos-Rh配合物具有更大范围的二面角(从原来的63.7-67.5°到现在的62.8-71.4°);具有合适长度的醚链并含有较多氧原子的E3 11-BridgePhos-Rh配合物具有最大的二面角(71.4°)。
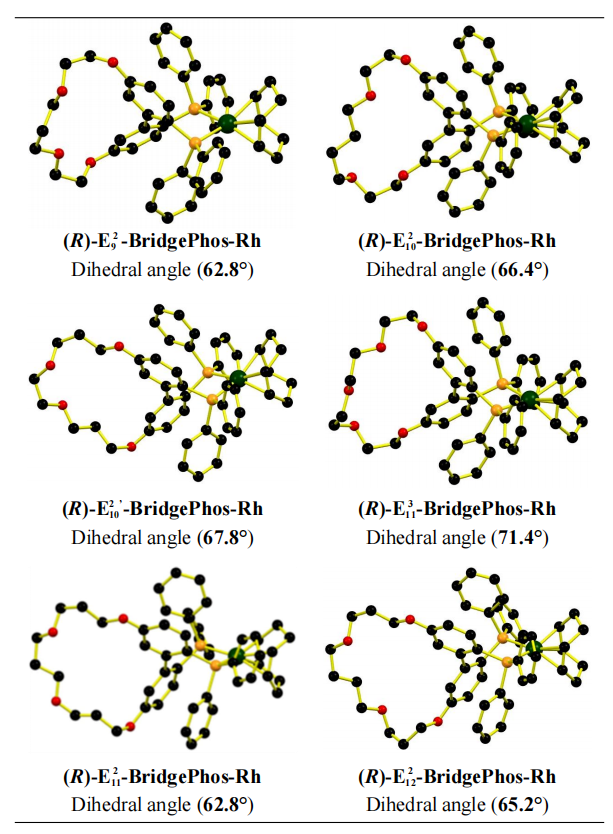
Figure 1. The Crystal Structure of (R)-Em n-BridgePhos-Rh Complexes. The dihedral angle of the biphenyl rings of the BridgePhos-Rh complexes are shown. All H atoms and counteranion (BF4-) are omitted for clarity. See detail crystal parameters in the Supporting Information.
作者以α-乙酰酰胺-α-苯基-1,3-茚二酮(1a)作为模型底物,对反应条件进行优化。首先,对Cn-BridgePhos-Rh催化体系进行了考察。实验发现以(S)-C10-BridgePhos-Rh催化剂,以二氯甲烷作为溶剂,在室温下30 atm的H2压力下反应12 小时,以95%的核磁收率和93%的对映选择性得到单还原产物2a。实验结果表明,二面角最大的(S)-C10-BridgePhos具有最佳的对映选择性(93% ee) (Table 1,entries 1-6)。为了考察二面角对反应的影响,新型(S)-Em n-BridgePhos配体作为手性配体应用于上述反应中(entries 7-12)。结果显示,具有最大二面角的(S)-E3 11-BridgePhos-Rh优于其他(S)-Em n-BridgePhos配体,以97%的收率和97%的ee获得2a。以上结果表明,手性BridgePhos-Rh催化剂的二面角对其不对称催化行为有显著影响。二面角的大小与反应的对映选择性似乎存在正向相关,具有最大二面角的(S)-E3 11BridgePhos-Rh催化剂提供了最佳的催化效果(97% ee)。
Table 1. Ligand Screening
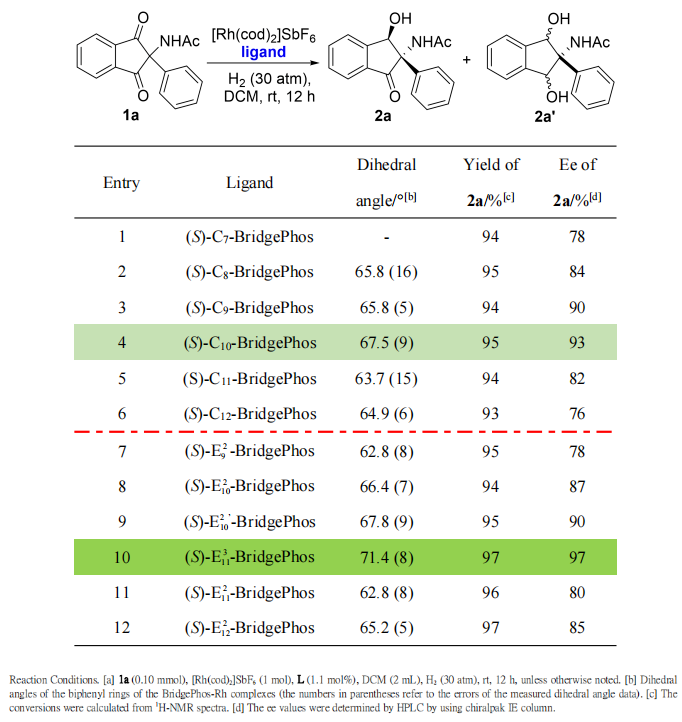
在最优反应条件下,作者考察了α,α-二取代-1,3-茚二酮加氢反应的底物范围(Scheme 4)。总的来说,无论在α-取代苯环的间位或对位上具有供电子或吸电子基团的底物(1a-1m),氢化反应均可以获得高收率(95-97%)和优异的对映选择性(93-99%)。此外,α-取代苯环的不同位置具有二取代基团的底物(1n-1x)也同样能够以高收率和优异的选择性得到目标产物。含α-萘基的底物也以95%收率和95% ee得到产物2y。令人高兴的是,反应对α-位置上具有各种苯并杂环取代基的底物(1z-1ab)也具有良好的耐受性,并且获得了高效的不对称催化效果。
Scheme 4. Substrate Scope.Reaction conditions: 1 (0.40 mmol), [Rh(cod)2]SbF6 (1 mol%), (S)-Em n-BridgePhos (1.1 mol%), DCM (2 mL), H2 (30 atm), rt, 12 h; isolated yields; ees were determined by HPLC using chiral columns; the absolute configuration of 2a was confirmed by X-ray diffraction analysis and other products were assigned according to 2a.
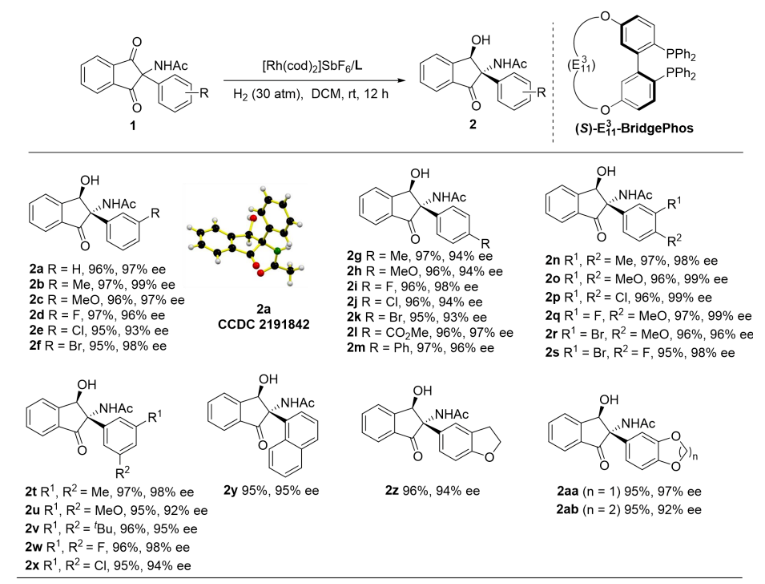
接下来,作者对该不对称氢化反应进行放大实验,同样以高产率高对映选择性获得手性产物。该产物可作为关键中间体首次合成了手性苄基异喹啉生物碱的类似物(Scheme 5)。
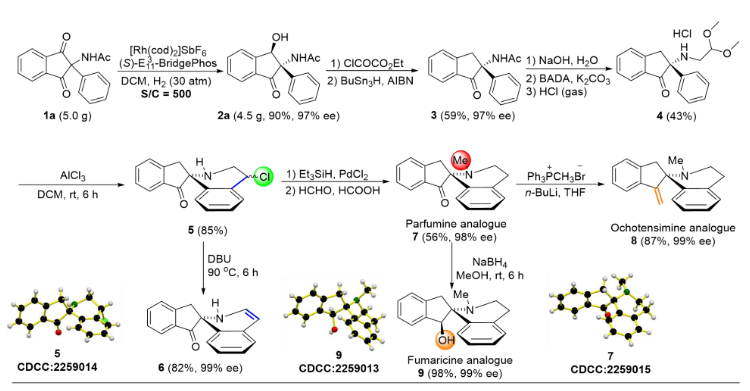
Scheme 5. Gram-Scale Synthesis of 2a and the Total Synthesis of Natural Alkaloid Analogues
手性产物2a也可以进一步衍生转化(Scheme 6)。
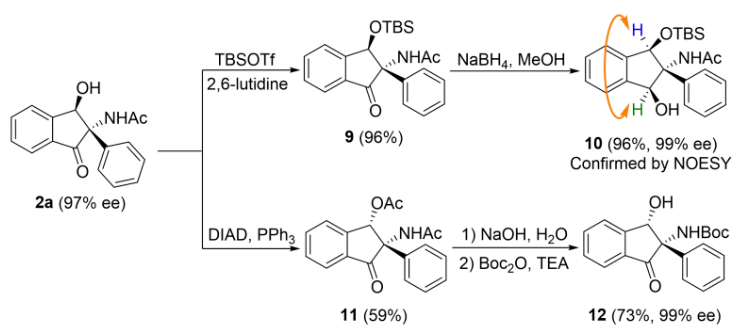
Scheme 6. The Transformations of 2a
作者还进行了DFT计算,以进一步了解氢化反应和Em n-BridgePhos配体的立体控制能力(Scheme 7)。具体的机理如下:首先,活化的Rh催化剂与底物1(IM-1a和IM-1b)呈四边形配位。然后H2与配合物结合,形成IM-2a和IM-2b。由于1空间位阻较大,H2的进入方向特异地转到苯基的对立面;H2通过TS-2a和TS-2b氧化加成,生成八面体Rh(III)配合物IM-3a和IM-3b。在这个步骤中,一个H原子将酰胺基团推到与另一个H原子相反的位置。因为底物1可以从IM-3a和IM-3b分离并允许IM-3a和IM-3b之间的相互转化,高能量的TS-2a和TS-2b表明这一步骤可能是速率限制步骤,但不是立体决定步骤。事实上,IM-3a或IM-3b中羰基的解离是释放能量的。随后,Rh-H键通过TS-3a和TS-3b进行迁移插入。最后,IM-4a和IM-4b的还原消除作为该反应的立体决定步骤。这一步骤的过渡态TS-4a和TS-4b的能量差为3.29 kcal/mol,对应于99.2%的ee值。产生的IM-5a和IM-5b返回到一个四边形。值得注意的是,当使用(S)-C10-BridgePhos配体时,立体决定步骤中过渡态之间的能量差为3.03 kcal/mol,对应于98.8%的ee值。虽然DFT可能不能提供定量准确的对映选择性,但是ΔΔG‡的计算结果与实验结果定性趋势是一致的。
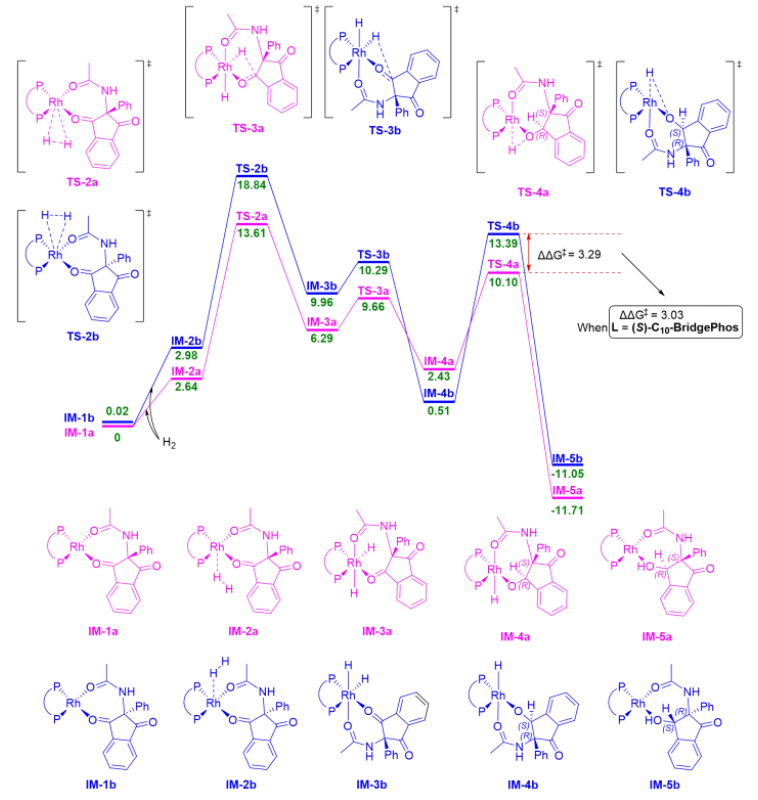
Scheme 7. Gibbs Energy Profile of the Overall Reaction (The Data Were Acquired at the PBE0(D3BJ)/cc-pvTz/SMDDCM Level of Theory)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn