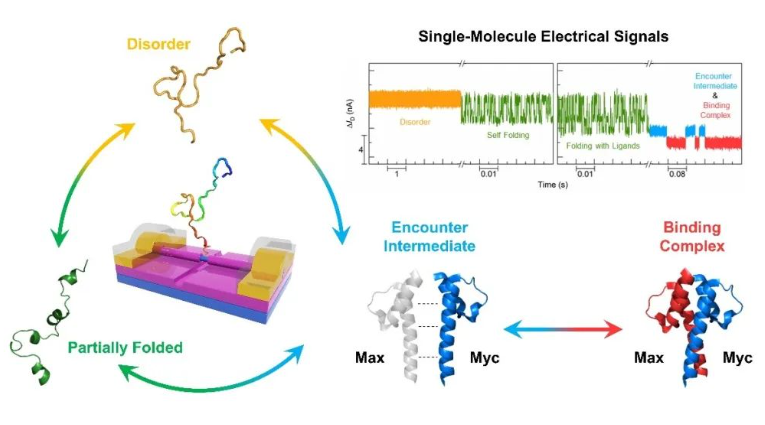
图1. 单分子器件的结构示意图以及无序蛋白动态过程的电学实时监测
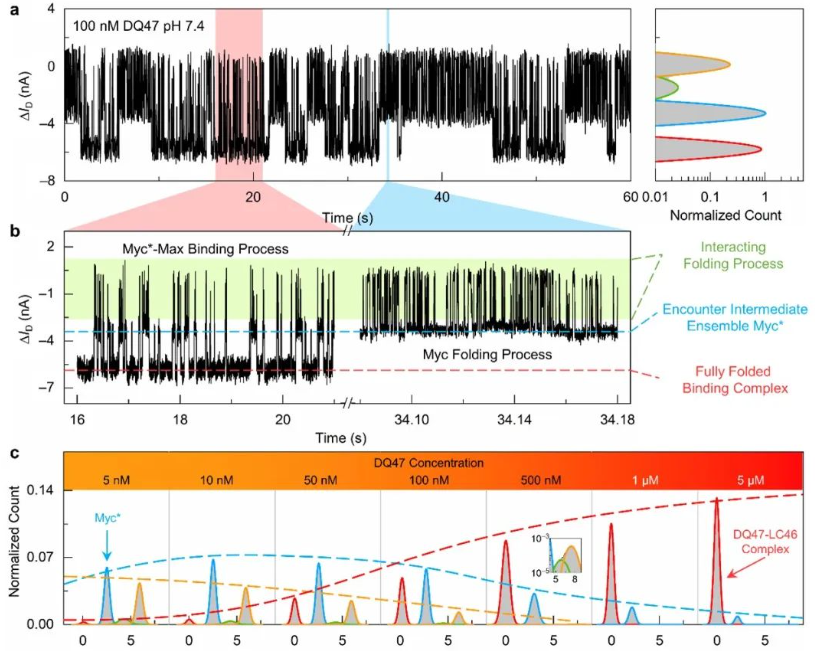
通过实时监测原位电学信号,研究团队成功捕获了自由态c-Myc蛋白的折叠与去折叠过程中不同动力学行为的构象系综,并检测到c-Myc与Max的结合全过程。该过程包括复杂的构象变化、相对稳定的相遇中间体构象系综(图2)以及稳定的全折叠复合体的形成。c-Myc是重要的抗癌药物设计靶标,其动态结构给相应的药物设计及结合化合物表征带来很大困难。研究团队发现小分子抑制剂的加入可以诱导c-Myc的构象系综发生改变,通过对浓度依赖单分子实验中大量结合与解离数据进行统计分析所得出的解离常数与传统系综实验结果高度一致,并且捕获到了小分子与c-Myc的相遇中间体构象系综。进一步研究了小分子抑制剂与Max竞争结合c-Myc的动态过程,发现了不同的相遇中间体系综。该研究结果表明SiNW-FET 可以在单分子水平上高时间分辨率地探测IDP结构的动态变化,克服了传统系综实验中难以表征无序蛋白单分子动力学性质的难题。相关研究将有助于深入了解IDP的动态构象变化及分子识别机制,为靶向IDP的理性药物设计提供全新的视角和可能性。
图2. Myc-Max相互作用过程的单分子电学实时监测
综合之前的研究成果表明,SiNW-FET单分子平台可以广泛应用于各种单分子分辨率的无标记生物检测,例如生物反应机制,蛋白质折叠,靶向治疗,药物发现,酶活性和单分子测序等。除此之外,该单分子电学检测平台与当前CMOS技术的兼容性和可靠性,为实际生物医学应用,如精确的分子识别、即时临床诊断以及开发低成本的多通道电子设备提供了技术前景。该工作于2023年8月25日以“Visualizing single-molecule conformational transition and binding dynamics of intrinsically disordered proteins”为题在线发表在Nature Communications( Nat. Commun. 2023, 14 , 5203. DOI: 10.1038/s41467-023-41018-x)期刊上。北京大学化学与分子工程学院2017级毕业生刘文哲博士(郭雪峰课题组)和北大-清华生命科学联合中心2017级毕业生陈丽敏博士(来鲁华课题组)为本文的共同第一作者。郭雪峰教授、来鲁华教授以及孙琦副研究员为本文的共同通讯作者。该工作得到了国家自然科学基金委、科技部、北京分子科学国家研究中心和北大-清华生命科学联合中心的资助。原文链接:https://doi.org/10.1038/s41467-023-41018-x