

正文
有机磷化合物由于其独特的生物和化学特性,在有机化学、药物化学和材料科学等领域中有着重要而广泛的应用,如何高立体选择性地构建手性有机磷化合物是有机化学领域的重要研究方向之一。过渡金属催化重氮化合物分解生成金属卡宾继而发生不对称X-H键插入反应是立体选择性构建C-X键的有效途径。虽然金属卡宾参与的不对称X-H(X=C, N, O, S, Si, B)插入反应已获得较好的发展,但P-H插入反应在经过三十多年发展之后仍未有效解决其不对称催化的难题,直接影响了该C-P键高效构建方法的应用。不对称催化P-H插入反应挑战在于:(1)膦氢化合物易毒化手性金属催化剂,从而影响重氮分解生成金属卡宾或手性配体的立体选择性控制能力;(2)不对称P-H插入反应的质子转移过程不易控制;(3)活性卡宾中间体易于发生自聚等竞争反应。下载化学加APP到你手机,更加方便,更多收获。
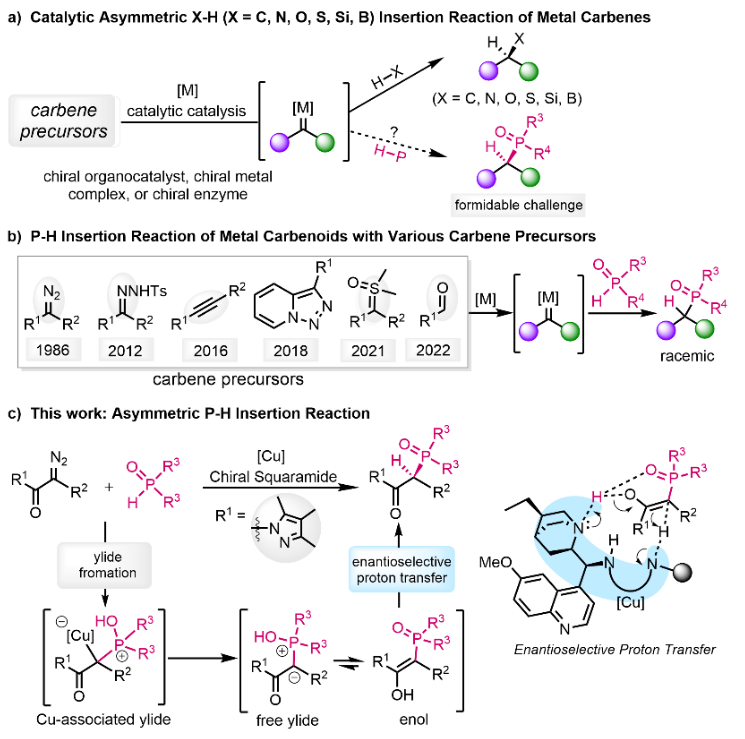
图1 金属卡宾的插入反应
作者首先使用重氮吡唑酰胺A1和二苯基膦氧B1作为底物模型对反应条件进行筛选(图2),并在反应条件筛选中发现:(1)金属铜化合物和手性有机小分子催化剂缺一不可;(2)手性有机小分子催化剂需同时具备质子供体和质子受体的双功能性质才能很好地实现反应的立体选择性控制;(3)手性有机小分子催化剂的骨架结构为金鸡纳碱时反应立体选择性效果最好。经过大量的条件筛选后确定了最优反应条件:溴化亚铜(CuBr)和手性奎宁方酰胺衍生物Q7作为共催化剂,硫酸钡作为添加剂,二氯甲烷(DCM)作为溶剂,反应温度为0 ℃,同时使用硼氢化钠作为还原剂,一锅法合成手性b-羟基膦氧化合物。
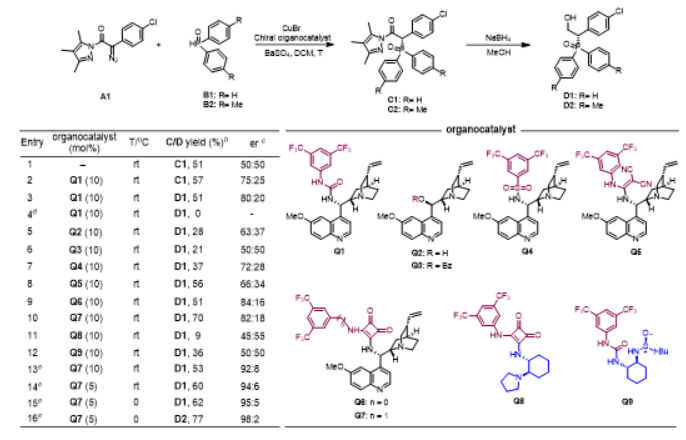
图2 条件筛选
在最优反应条件下,作者对底物普适性进行了考查(图3)。首先,苯环上带有不同吸电子和供电子取代基的重氮吡唑酰胺底物均有很好的适用性,稠环重氮吡唑酰胺底物也能以较好的收率和高对映体选择性生成相应手性b-羟基膦氧化合物(图3A)。随后,对不同的膦氢化合物底物进行拓展,含有供电子和吸电子取代基的芳环和萘环均能顺利地发生不对称P-H插入反应,生成相应的手性b-羟基膦氧化合物(图3B),膦氢化合物的电子效应和位阻效应对该反应有较大影响。作者还进一步验证了该反应的可扩展性和实用性,反应放大至1 mmol规模时,仍可以以73%的产率和95:5 er的对映体选择性合成目标产物。同时,作者对产物进行了衍生实验,手性b-羟基膦氧化合物可以顺利进行硼烷化、溴化和酯化等多种转化,为快速获得结构多样的手性膦氧化合物提供了可能途径。
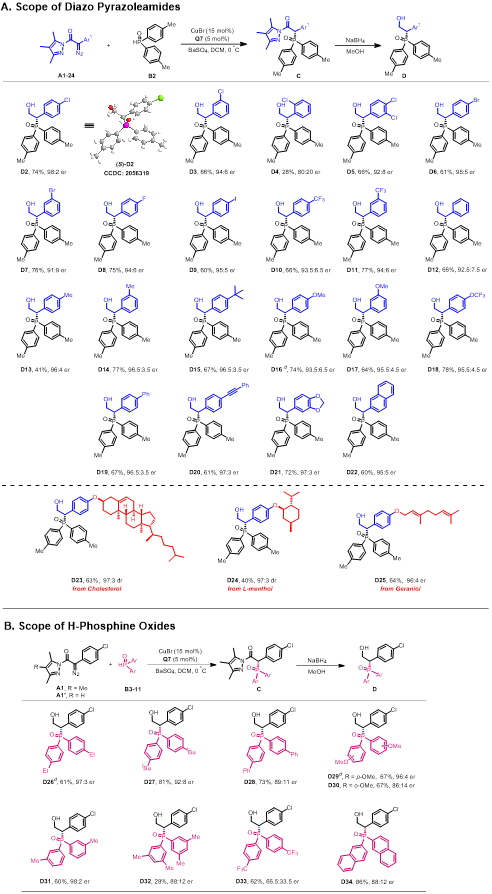
图3 底物拓展
为了进一步探索反应机理,研究人员开展了氘代实验、控制实验等机理验证实验。此外,广西大学谢鹏副教授对该反应进行了密度泛函理论(DFT)计算研究。如图4所示,膦氢化合物B1的互变异构体B1’与铜卡宾中间体IM1发生反应生成铜络合的叶立德IM2,再经羰基扭转、质子转移和铜解离等过程生成烯醇中间体IM5。作者还对铜催化剂与奎宁方酰胺Q7在不同位点络合形成的催化物种,及其与IM5发生Ha质子转移生成中间体IM6的能垒进行比较,发现当铜催化剂与奎宁方酰胺Q7的双羰基配位形成的[Cu·Q7]*配合物时的反应能垒更低,只有4.1 kcal/mol。最后,在不对称质子转移生成产物C1的过程中,分别计算了Ha、Hb和Hc质子转移途径的反应能垒,结果显示,Hc发生质子转移过程的能垒最小。作者还比较了决定反应对映体选择性的过渡态TS7(S)和TS7(R)的反应能垒,发现反应经过TS7(S)的能垒比TS7(R)低1.4 kcal/mol,解释了产物(S)绝对构型产生的原因。
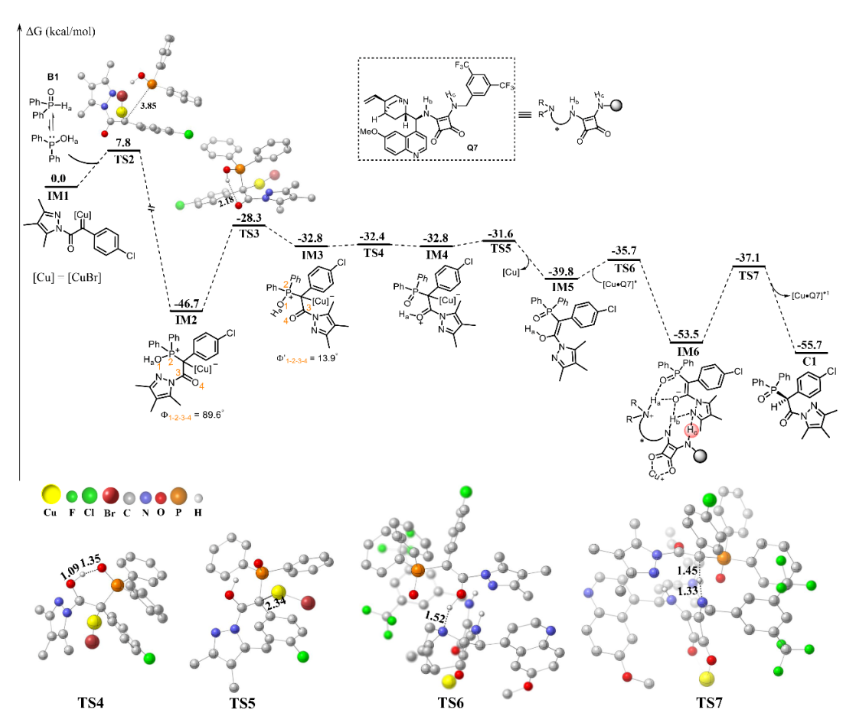
图4 反应机理的计算研究
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn