(图片来源:J. Am. Chem. Soc.)
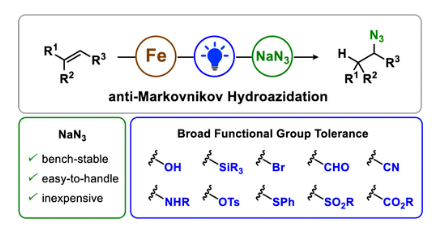
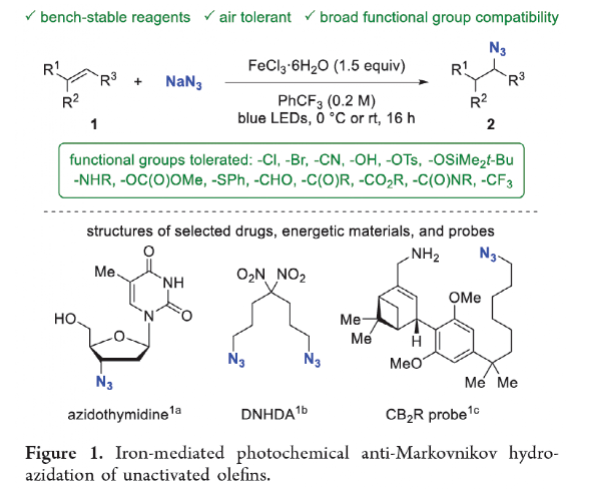
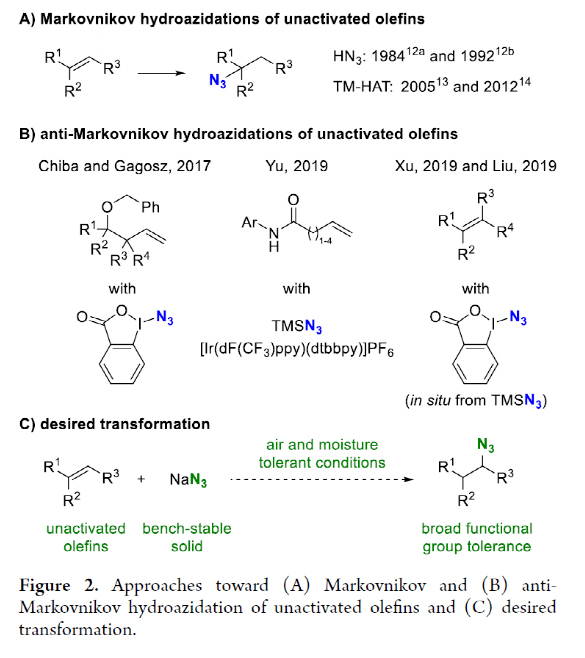
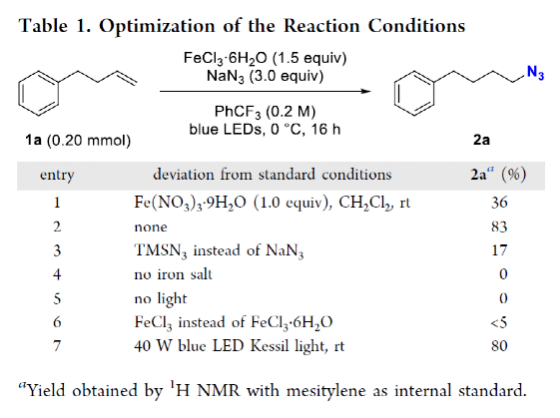
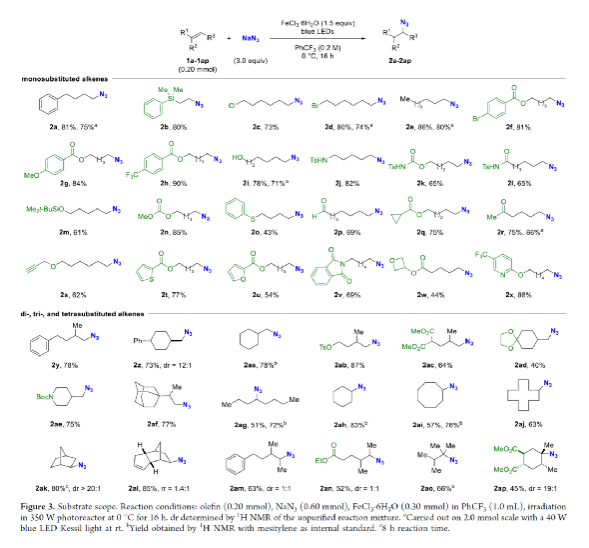
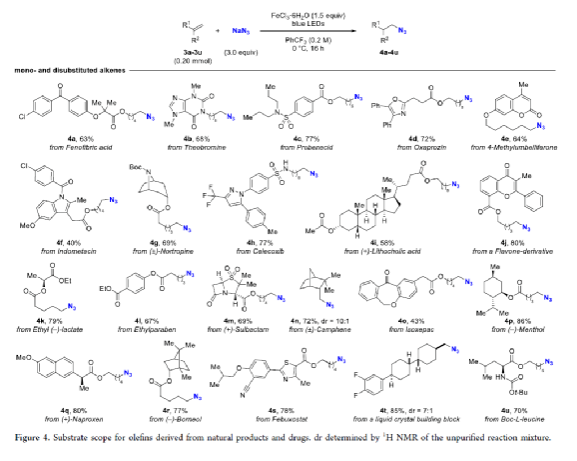
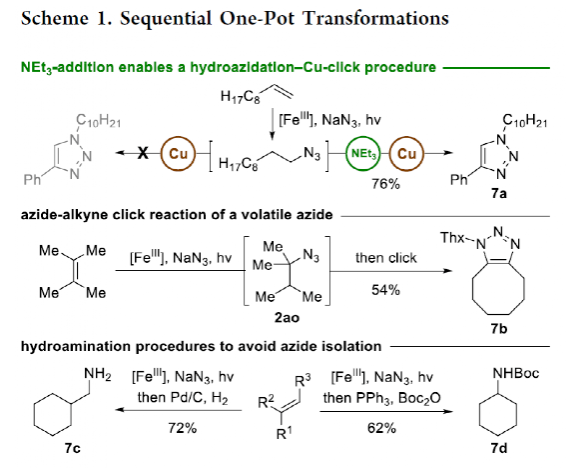
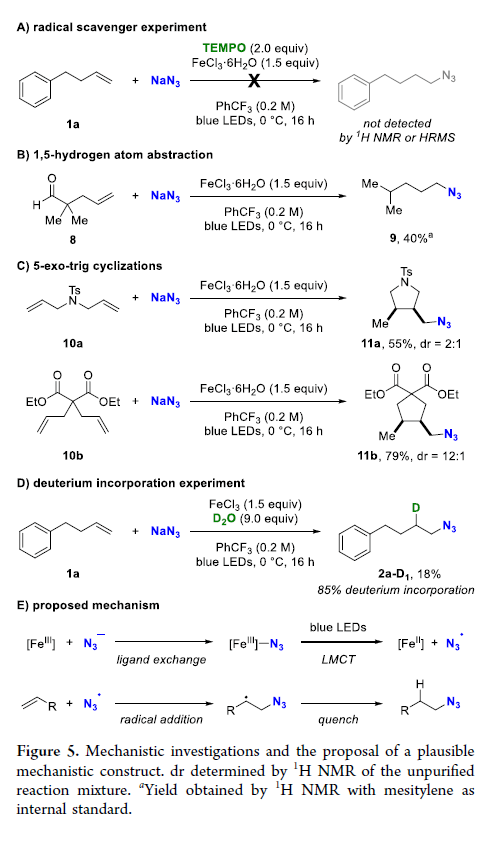
有机叠氮化物是一系列药物分子、高能材料和化学探针的重要组成部分。它们也是合成天然产物、药品和农用化学品的宝贵合成砌块。此外,叠氮化物在经典合成方法中得到了广泛的应用,如Staudinger还原,Huisgen环加成,点击化学,Schmidt和aza-Wittig反应等。最近,叠氮化物作为亚硝基前体被广泛应用于过渡金属催化的C-H键胺化反应中。特别是在多步合成的情况下,R-N3可以作为保护的胺来使用(Figure 1)。下载化学加APP到你手机,更加方便,更多收获。传统上,有机叠氮化合物是通过亲核取代以及重氮和叠氮转移反应合成的。作为一种互补的方法,利用烯烃直接转化为烷基叠氮化物得到了化学家们的关注。Hassner和Kropp的早期研究工作主要集中在将HN3加成到烯烃上,从而得到相应的马氏加成产物(Figure 2A)此后,Chiba 和 Gagosz,于炜, 项昊,刘国生等课题组分别使用高价碘试剂ABX(azidobenziodoxolone)和TMSN3实现了烯烃的反马氏氢-叠氮化反应(Figure 2B)。尽管此领域已取得了一系列进展,但使用简单易得的NaN3作为廉价叠氮化物来源的方法仍未有报道(Figure 2C)。最近,瑞士苏黎世联邦理工学院Erick M. Carreira课题组发展了首例光/铁共催化,非活化烯烃的反马氏氢-叠氮化反应。该转化采用耐空气和水分的NaN3作为稳定的叠氮源,在温和的条件下进行,且具有广泛的官能团兼容性(Figure 2)。作者首先以4-苯基丁烯1a为模板底物,NaN3作为稳定的叠氮源,对烯烃的反马氏氢-叠氮化反应进行了探索(Table 1)。通过一系列条件筛选,作者发现当使用1a (0.20 mmol), NaN3 (0.60 mmol, 3.0 equiv), FeCl3·6H2O (0.30 mmol, 1.5 equiv)在PhCF3 (1.0 mL)中,350 W 光反应器的引发下,0 °C反应16 h可以以83%的核磁产率得到反马氏氢-叠氮化产物2a(entry 2)。控制实验表明,铁盐和光照的存在对此转化至关重要(entries 4和5)。此外,FeCl3·6H2O的结晶水不可缺少(entry 6)。接下来,作者对此转化的底物范围进行了考察(Figure 3)。实验结果表明一系列连有不同取代基的单取代烯烃、二取代烯烃、三取代烯烃以及四取代烯烃均可顺利实现此转化,以40-90%的产率得到相应的反马氏氢-叠氮化产物2a-2z, 2aa-2ap。值得注意的是,卤素、羟基、炔基、醛基等官能团均可顺利兼容,这为产物的后续合成转化提供了可能性。此外,当将反应放大至2.0 mmol规模时,仍可以以75%的产率得到产物2a,证明了此转化的实用性。在对此方法的底物适用范围进行了考察后,作者探索了对生物活性和生物相关分子衍生物的兼容性(Figure 4)。实验结果表明,Fenofibric acid, Theobromine, Probenecid, Oxaprozin, Indometacin, Nortropine, Celecoxib, Lithocholic acid, Flavone, Sulbactam, Camphene, Isoxepac, Menthol, Naproxen, Borneol, Febuxostat等一系列药物或天然产物衍生物均可兼容,以40-86%的产率得到相应的产物4a-4u。特别是,含有不同取代芳烃和杂环的分子,如噁唑、吲哚、噻唑、β-内酰胺和二唑等均具有良好的耐受性,表明该方法具有实现后期应用的潜力。为了应对低分子量叠氮化物的挥发性和固有风险,作者探索了氢-叠氮化反应后的几种合成转化。使用一锅法策略可以有效避免后处理过程,包括溶剂蒸发、纯化、分离和叠氮化物中间体的处理(Scheme 1)。作者首先尝试了Cu(I)-催化的原位click反应,但并未成功。随后,作者观察到NEt3的加入对三唑7a(76%)的生成至关重要。利用挥发性的叠氮化物2ao与环辛炔反应,可以以54%的产率得到三唑产物7b。此外,利用环己基叠氮化物2ah分别经历钯催化的氢化以及Staudinger还原可以分别以72%和62%的产率得到7c和7d。为了深入理解反应机理,作者进行了控制实验(Figure 5)。首先,在体系中加入自由基捕获剂TEMPO后,作者并未监测到目标产物,由此表明反应中会涉及自由基中间体(Figure 5A)。随后,当作者使用醛8作为底物时,以40%的产率观察到了1-叠氮基-4-甲基戊烷9作为唯一产物。这说明叠氮自由基与烯烃加成后形成的二级碳自由基会经历1,5-自由基氢原子攫取,并经历脱羰得到更稳定的三级自由基,并被淬灭(Figure 5B)。接下来,作者利用二烯底物10a和10b反应,可以经历5-exo-trig环化,分别以55%和79%的产率得到吡咯啉产物11a和环戊烷产物11b。对这两个底物,作者仅观察到了环化产物的生成,由此表明淬灭过程要慢于环化过程(Figure 5C)。紧接着,作者利用同位素实验得出水是产物中氢的来源,且氢原子转移到二级碳中心自由基的过程可能是此转化的决速步骤(Figure 5D)(Figure 5E)。Erick M. Carreira课题组发展了首例光/铁共催化,非活化烯烃的反马氏氢-叠氮化反应。该转化使用廉价易得的NaN3作为稳定的叠氮源,在温和的反应条件下实现了一系列烷基叠氮化物的合成。该转化具有广泛的底物适用性和官能团兼容性,并可以兼容一系列药物和天然产物分子骨架。此反应的发展为有机叠氮化物的合成提供了新的策略。文献详情:
Henry Lindner, Willi M. Amberg, Erick M. Carreira*. Iron-Mediated Photochemical Anti-Markovnikov Hydroazidation of Unactivated Olefins. J. Am. Chem. Soc.,2023,https://doi.org/10.1021/jacs.3c09122.