

(图片来源:Angew. Chem. Int. Ed.)
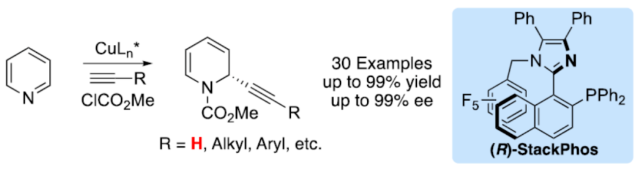
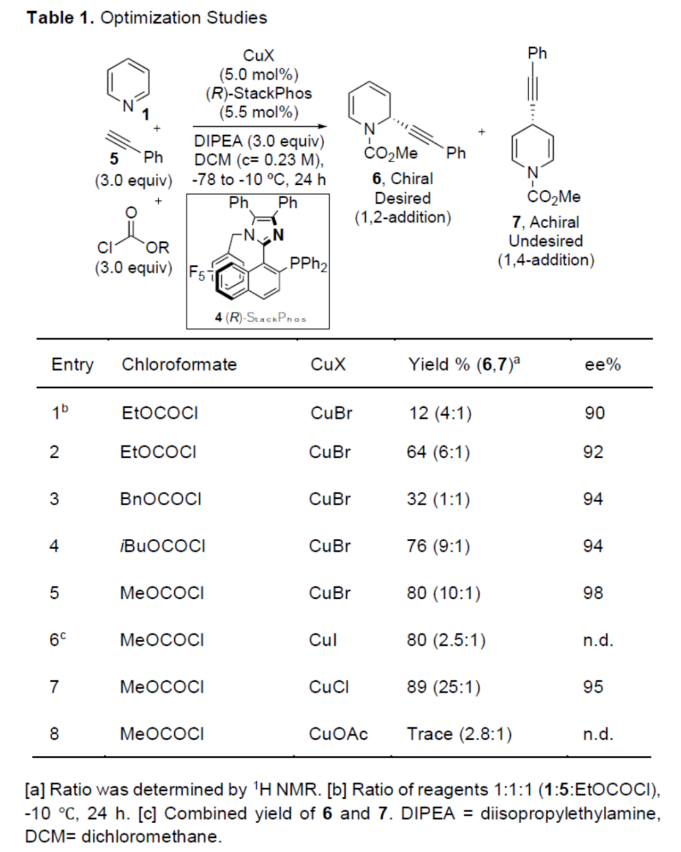
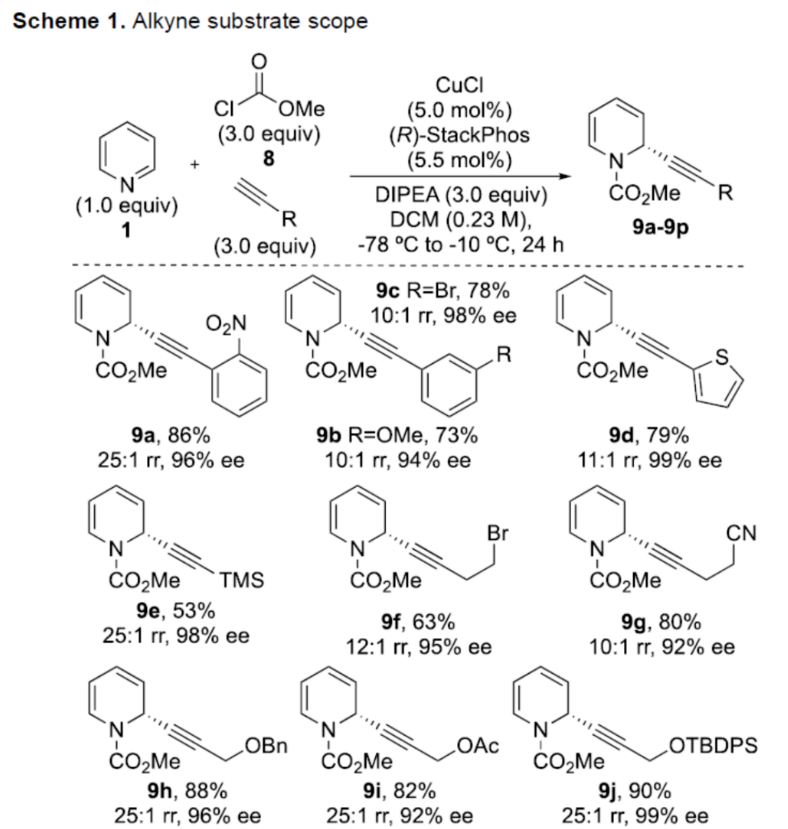
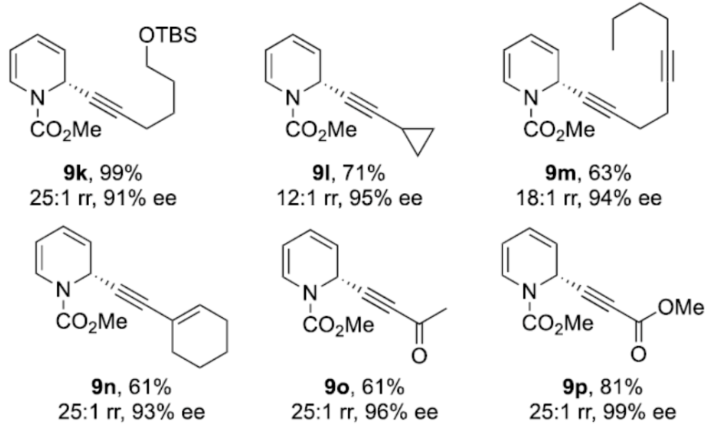
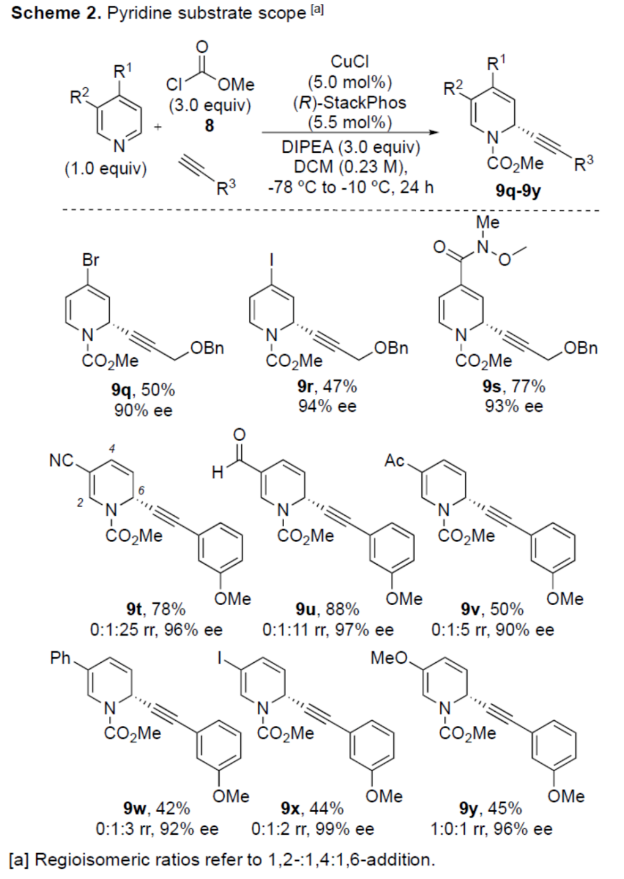
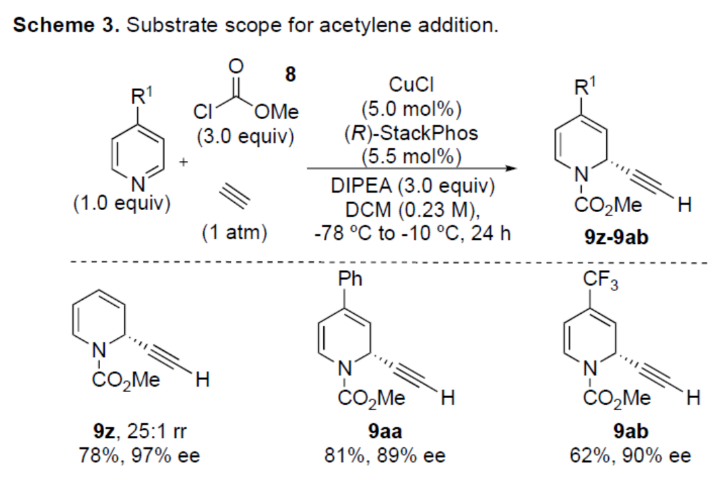
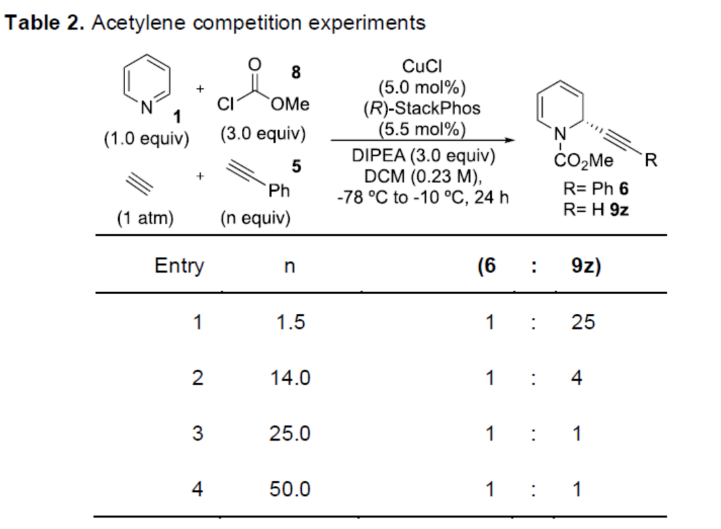
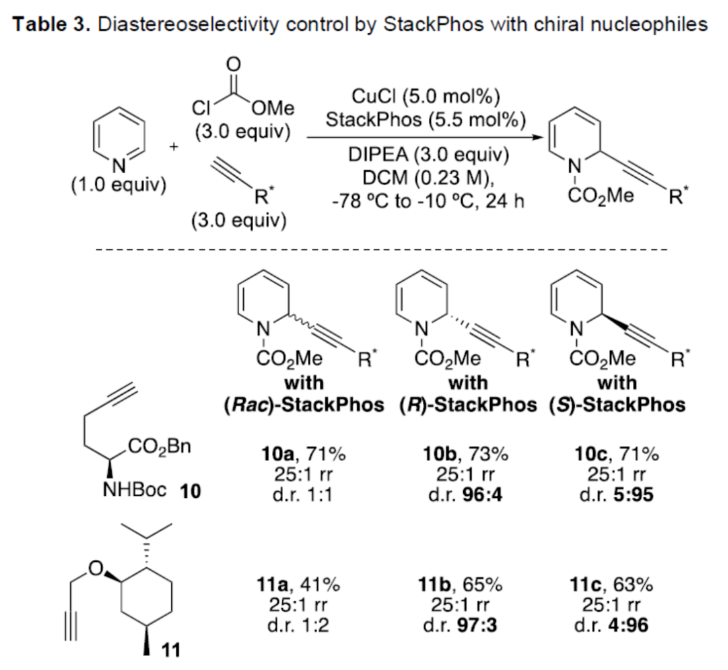
正文 对映选择性催化是制备手性非外消旋化合物最为直接的途径之一,并且化学家们已开发了大量用于引入手性的催化策略。其中,前手性π-键的一个特定面的选择性反应是这些方法中最常见和最成功例子之一。近年来,利用平面芳烃制备高度官能团化分子的策略越来越受欢迎。其中,吡啶的亲核加成是典型的例子,因为2-、4-和6-位都可以在去芳构化反应中进行加成反应。最近,化学家们已经开发出了使用氢化物进行吡啶去芳构化的巧妙策略,随后使用手性催化剂对3-位进行官能团化反应。前期,Comins和Charette课题组利用在2-和4-位具有取代基的底物的手性助剂来区分前手性π-面,同时也有助于化学选择性的控制。对于母体吡啶,Doyle课题组报道了镍催化芳基有机锌试剂的加成反应,其中利用镍配合物中间体破坏了吡啶的对称性。鉴于温和的反应条件和产物的高实用性,炔基化化学仍然是一种强大的方法。马大为课题组(J. Am. Chem. Soc. 2007, 129, 9300.)报道了一种吡啶与炔烃的加成反应,但亲核试剂的范围仅限于丙二醇酯和丙炔酮底物(对于常见的苯乙炔底物,仅观察到1%ee)。因此,对于吡啶的催化对映选择性加成仍然具有难度。近日,美国佛罗里达大学Aaron Aponick课题组报道了一种铜催化吡啶、末端炔烃和氯甲酸甲酯的去芳构化炔基化反应,合成了一系列手性2-炔基-1,2-二氢吡啶,具有优异的区域选择性和对映选择性(Figure 1)。下载化学加APP到你手机,更加方便,更多收获。 (图片来源:Angew. Chem. Int. Ed.) 首先,作者以吡啶1a、苯乙炔5与MeOCOCl作为模型底物,进行了相关三组分反应条件的筛选(Table 1)。当以CuCl(5.0 mol %)作为催化剂,(R)-StackPhos(5.5 mol %)作为配体,DIPEA(3.0 equiv)作为碱,在DCM溶剂中-78 oC至-10 oC反应24 h,可以89%的收率得到产物6,rr为25:1,ee为95%。 (图片来源:Angew. Chem. Int. Ed.) 在获得上述最佳反应条件后,作者对炔烃底物范围进行了扩展(Scheme 1)。研究表明,一系列不同取代的苯乙炔、噻吩基乙炔以及烷基取代的炔烃,均可顺利反应,获得相应的产物9a-9p,收率为53-99%,ee为91-99%,rr为10:1->25:1。值得注意的是,该策略具有出色的官能团兼容性,一系列活性的基团,如卤素、炔基、烯基、羰基、烷氧羰基等,均与体系兼容。 (图片来源:Angew. Chem. Int. Ed.) 紧接着,作者对吡啶底物的范围进行了扩展(Scheme 2)。研究表明,当吡啶底物中的R1为卤素与酰胺基时,均可顺利反应,获得相应的产物9q-9s,收率为47-77%,ee为90-94%。当吡啶底物中的R2为氰基、甲酰基、乙酰基、苯基、卤素与甲氧基时,也与体系兼容,获得相应的产物9t-9y,收率为42-88%,ee为90-99%,rr为0:1:2-0:1:25。然而,2-取代吡啶在标准反应条件下未能有效的进行反应。 (图片来源:Angew. Chem. Int. Ed.) 同时,在标准条件下,当使用乙炔气体作为底物时,可获得相应的产物9z-9ab,收率为62-81%,ee为89-97%(Scheme 3)。 (图片来源:Angew. Chem. Int. Ed.) 随后,作者进行了乙炔和苯乙炔之间亲核加成选择性的竞争性实验(Table 2)。反应结果表明,随着苯乙炔当量的增加,产物9z的比例在逐渐降低,因此乙炔比其它炔烃衍生物更具反应性。 (图片来源:Angew. Chem. Int. Ed.) 此外,作者发现,利用手性炔烃(10与11)以及非手性StackPhos作为配体时,反应也能够顺利进行,获得相应的产物10a(d.r.为1:1,rr为25:1)和11a(d.r.为1:2,rr为25:1)(Table 3)。值得注意的是,当使用(R)-StackPhos或(S)-StackPhos作为配体时,反应具有出色的非对映选择性。 (图片来源:Angew. Chem. Int. Ed.) (图片来源:Angew. Chem. Int. Ed.) 总结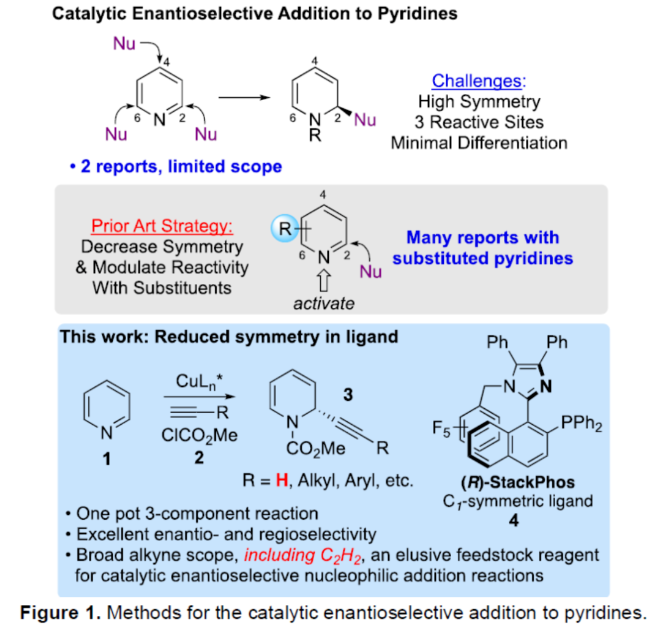
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn