

正文
人类中超过30%的编码蛋白质的基因表达细胞外或细胞表面蛋白质。其中许多蛋白在各种病理生理条件下发挥着关键作用。近年来,靶向蛋白降解(TPD)技术已成为靶向传统不可成药蛋白的新型高效治疗方式。然而,大多数TPD相关策略,包括PROTAC、分子胶和AUTAC等,只能降解胞质蛋白或具有胞质结构域的膜蛋白。在此,作者报道了iLYTACs,并通过一系列实验证实了iLYTAC可以用于扩展当前LYTAC和相关技术的潜在应用。下载化学加APP到你手机,更加方便,更多收获。
(图片来源:J. Am. Chem. Soc.)
 a
a
(图片来源:J. Am. Chem. Soc.)
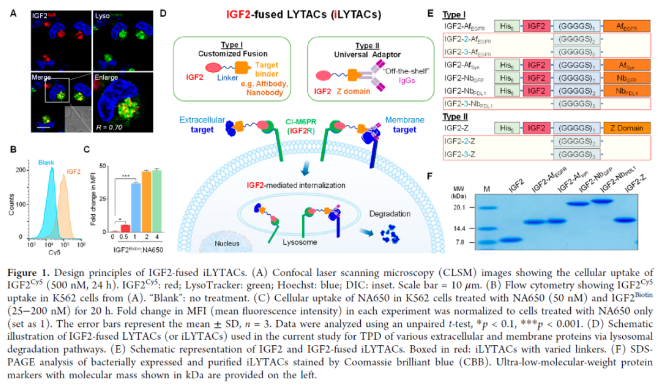
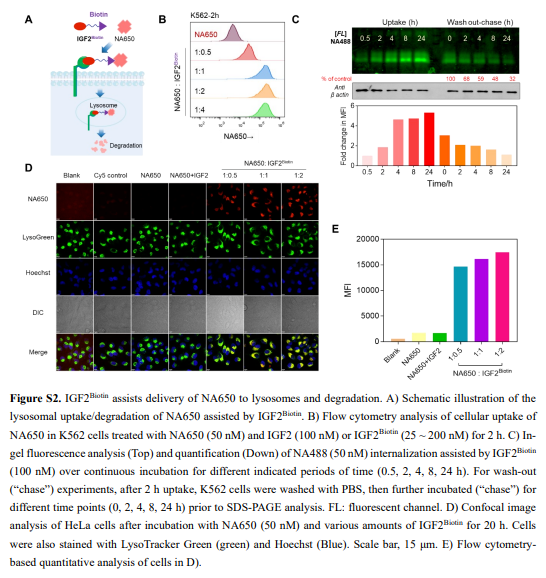
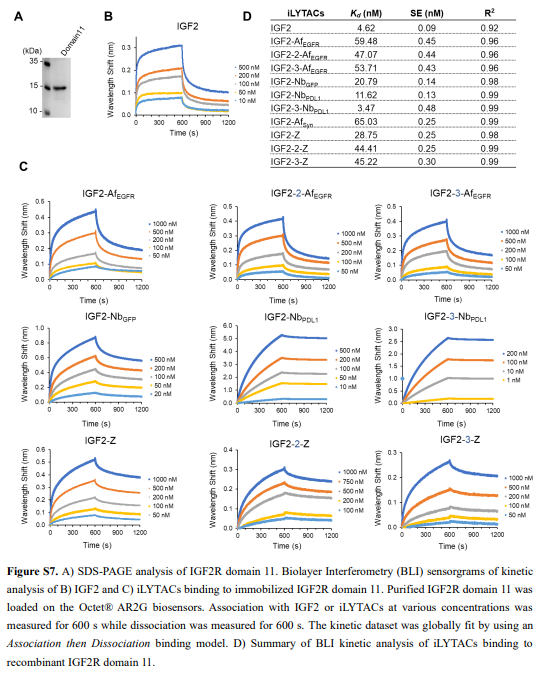
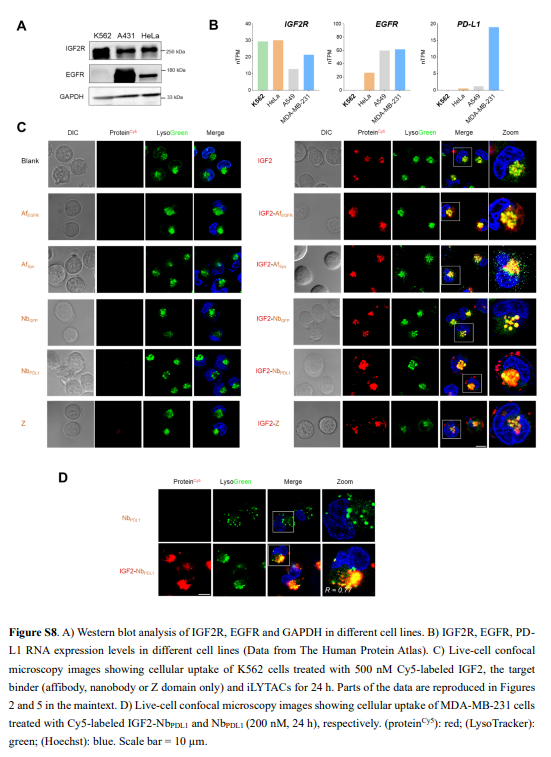
IGF2R结构域11特异性结合IGF2。结合后,IGF2–IGF2R复合物经历细胞运输进入溶酶体,最终导致IGF2降解。作者首先验证了IGF2的这种特殊性质可以被用作一种有效的溶酶体靶向受体(LTR)配体,以实现细胞外和膜蛋白的广泛有效的溶酶体递送和降解(图1A、B和S1)。在概念验证实验中,作者证实了细胞外生物素结合蛋白NeutrAvidin protein DyLight 650/488(NA650/NA488,图1C和S2)的成功细胞摄取和溶酶体递送。细胞的蛋白质组裂解物的凝胶内荧光扫描分析显示,IGF2介导的NA488摄取与时间相关,显著摄取在2小时开始发生,并持续24小时(图S2C),且在洗出后2小时明显观察到NA488带的荧光强度显著降低,表明NA488的溶酶体降解成功。
(图片来源:J. Am. Chem. Soc.)
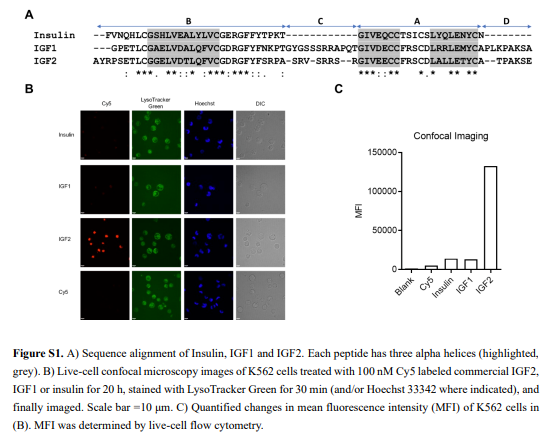
随后,作者试图将基于IGF2的iLYTAC建立为一个通用、方便和模块化的平台(图1D)。I型iLYTACs是IGF2与POI结合物或纳米体融合的产物,即IGF2-TB。II型iLYTAC(也称为IGF2-Z)是免疫球蛋白G(IgG)的Z结构域与IGF2融合,从而能够融合大多数市售mAb(图1E)。作者总共构建了四种I型iLYTACs,即IGF2-AfEGFR、IGF2-AfSyn、IGF2-NbGFP和IGF2-NbPDL1。
(图片来源:J. Am. Chem. Soc.)
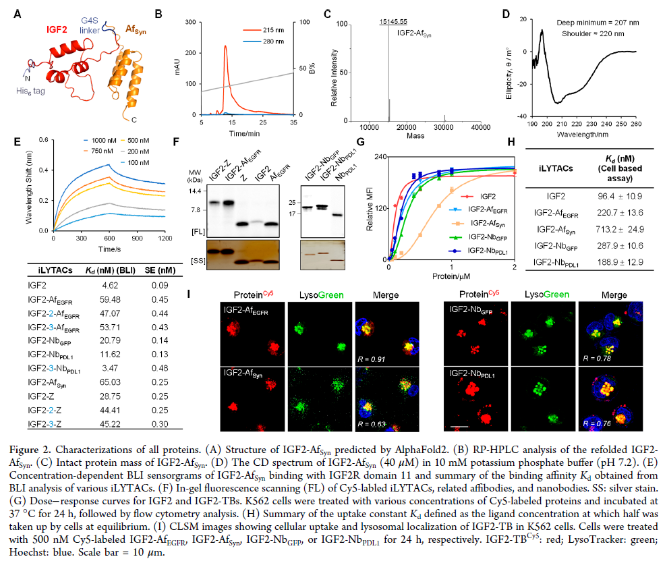
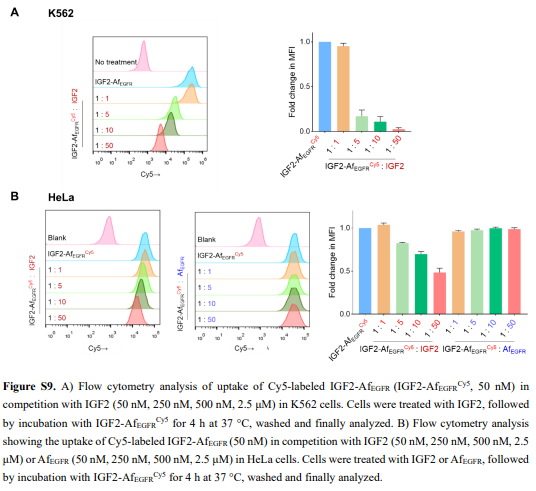
接下来,作者进行了BLI实验,确证了iLYTACs中的IGF2仍保持对IGF2R的结合活性(图2E和S7)。用LysoTracker Green对IGF2-TB处理的细胞进行的进一步共定位实验显示,大多数内化的IGF2-TB的溶酶体定位成功(图2I和S8C)。作者在K562和HeLa细胞中用IGF2-AfEGFR进行了竞争摄取测定(图S9A),进一步验证了IGF2/IGF2R辅助摄取IGF2-TB。
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
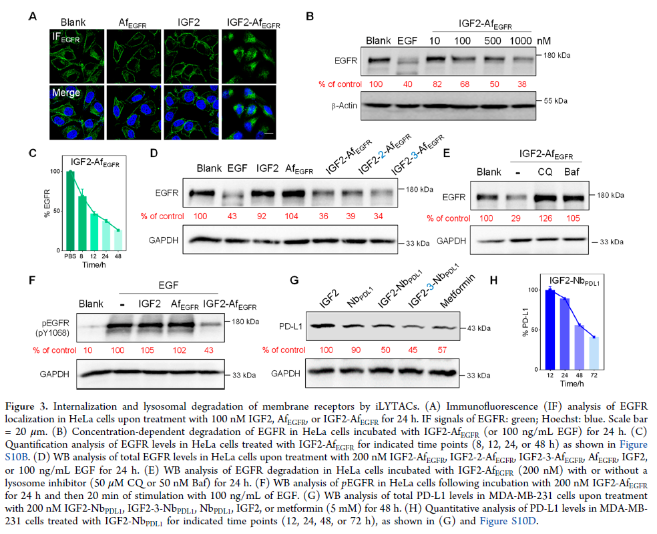
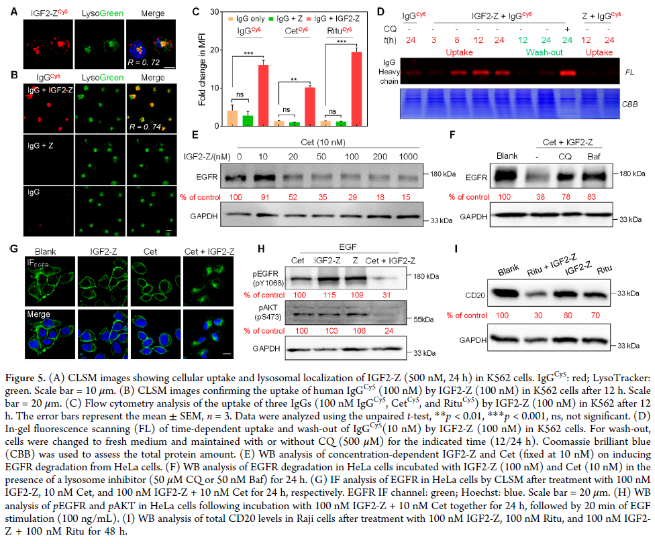
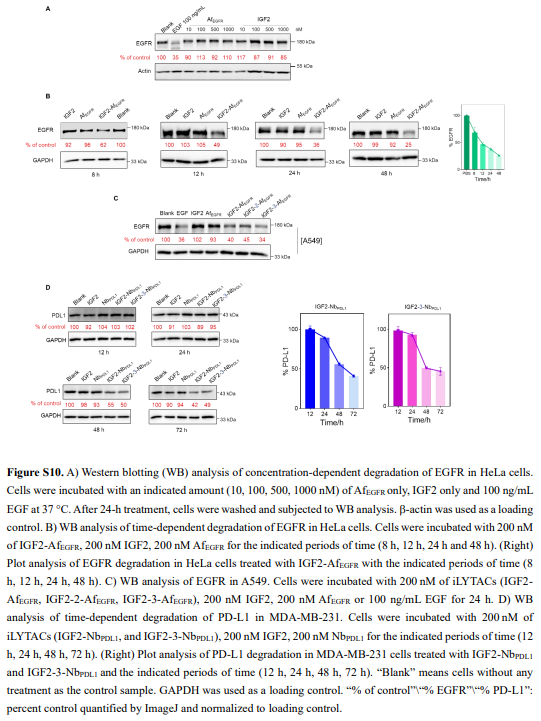
接下来,作者确证了iLYTACs能够介导疾病相关的细胞外蛋白和膜蛋白的溶酶体降解(图3A–D和S10A,B)。此外,添加了溶酶体抑制剂Baf和氯喹CQ后显著抑制了EGFR降解,进一步证实了溶酶体降解机制(图3E)。作者进一步评估了IGF2-AfEGFR如何影响EGFR的下游信号传导。急性EGF刺激(100 ng/mL,20分钟)没有降低EGFR水平,但显著增强了磷酸化(图3F,泳道2)。单独用IGF2或AfEGFR预处理没有改变EGF刺激后EGFR的Y1068的磷酸化状态(图3F,泳道3和4)。然而,作者观察到pEGFR表达在IGF2-AfEGFR处理的细胞中显著减少(图3F,泳道5),这表明与西妥昔单抗(Cet)/AfEGFR结合相比,IGF2-AfEGFR去除EGFR在抑制下游激酶信号传导方面更有效。
(图片来源:J. Am. Chem. Soc.)
为了进一步验证iLYTACs的普适性和灵活性,作者接下来设计并得到了靶向PD-L1的iLYTACs IGF2-NbPDL1和IGF2-3-NbPDL1。观察到了与IGF2-AfEGFR类似的效果(图3G、H、S10D和S8D)。
(图片来源:J. Am. Chem. Soc.)
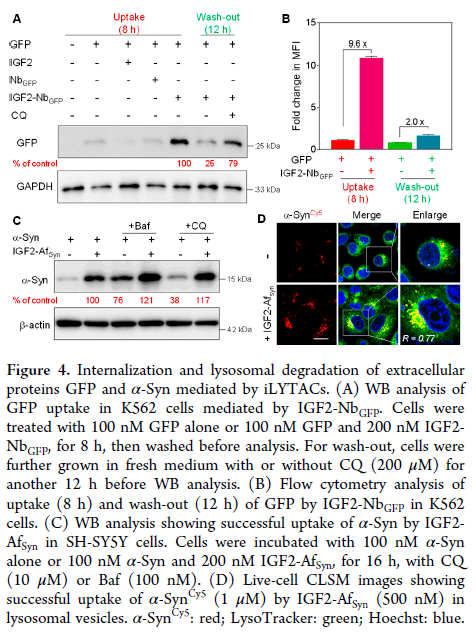
随后,作者进一步评估了iLYTAC介导的细胞外蛋白降解。GFP和α-Syn被用作靶向蛋白;相应的iLYTAC IGF2-NbGFP (图 4A,4B)和IGF2-AfSyn(图4C,D)均对GFP和α-Syn表现出降解能力。
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
随后,为了探索在II型iLYTAC(或IGF2-Z)的基础上开发通用降解平台的可能性,作者使用类似于生产I型iLYTACs的方法将IGF2-Z在大肠杆菌中表达、纯化并表征(图5A和S3–S8)。
(图片来源:J. Am. Chem. Soc.)
接下来,作者评估了IGF2-Z与Cet联合是否可以降解内源性EGFR(图5E和S13A,B);WB分析显示,与Cet和IGF2-Z共同孵育的HeLa细胞内的EGFR水平以剂量和时间依赖的方式显著降低,在用摩尔比1:10 Cet/IGF2-Z 24小时孵育处理的细胞中观察到有效的EGFR降解。IGF2和Z结构域之间的连接体的长度不影响降解效率(图S13C)。这种降解被溶酶体抑制剂抑制(图5F)。免疫荧光和CLSM显示,在用Cet+IGF2-Z处理的细胞中,膜结合的EGFR信号成功地输送到主要的溶酶体(图5G)。与用IGF2-AfEGFR处理细胞的I型iLYTAC相比(图3B–F),作者观察到在EGF刺激后,用Cet+IGF2-Z处理的HeLa细胞中pEGFR和pAKT(S473;EGFR的下游靶标)的水平更显著地降低(图5H)。
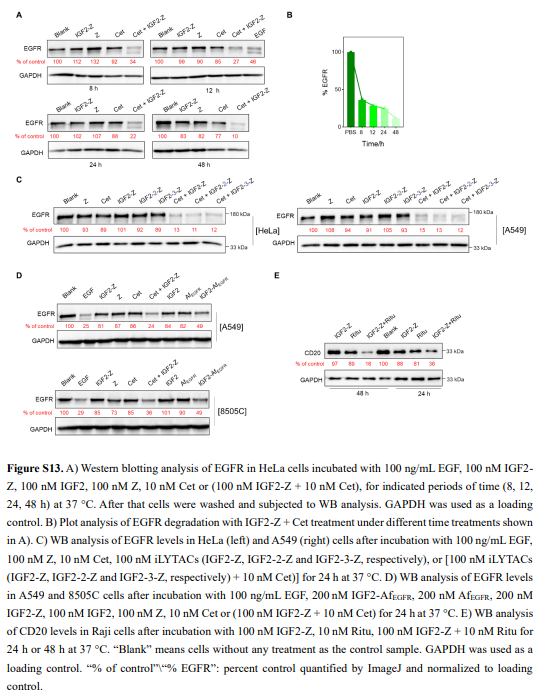
为了进一步验证IGF2-Z的普适性,作者研究了IGF2-Z降解CD20的能力。结果发现,用IGF2-Z+Ritu处理Raji细胞后,比单独用Ritu或IGF2-Z处理的细胞的CD20水平低得多(图5I和S13E)。
(图片来源:J. Am. Chem. Soc.)
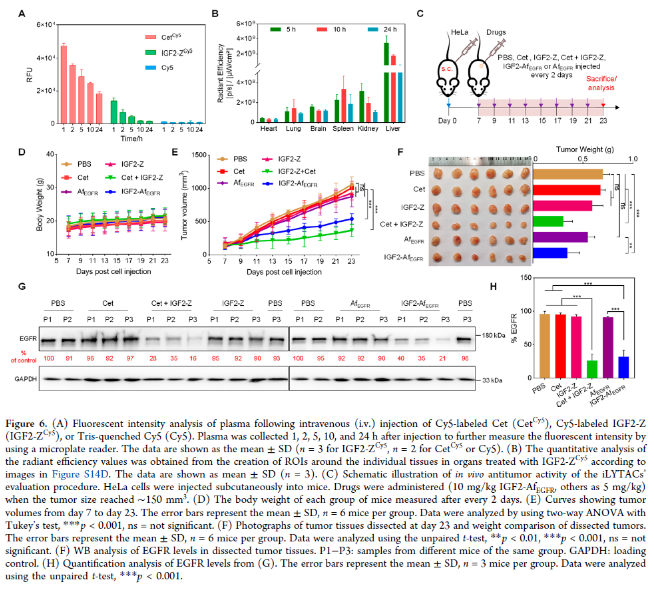
随后,作者选择IGF2-Z来评估其在小鼠中的药代动力学和生物分布。静脉注射Cy5标记的IGF2-Z、Cet和Cy5(图S14A)。基于处理小鼠尾血中荧光强度的清除率显示,仅使用Cy5染料的清除率最快,其次是IGF2-Z,最后是Cet(图6A),这与分子大小影响药代动力学的已知现象一致。主要器官的离体荧光成像也显示出类似的清除趋势(图S14B–D);IGF2-Z与Cet的复合物形成并没有显著影响IGF2-Z的清除率,这可能是由于血液中IgG水平高得多。此外,在IGF2-Z或Cet-5-h处理的小鼠中,观察到肝脏的摄取最高。5小时时在肾脏中检测到强烈信号,表明IGF2-Z正在迅速从血液循环中清除(图6B和S14D)。
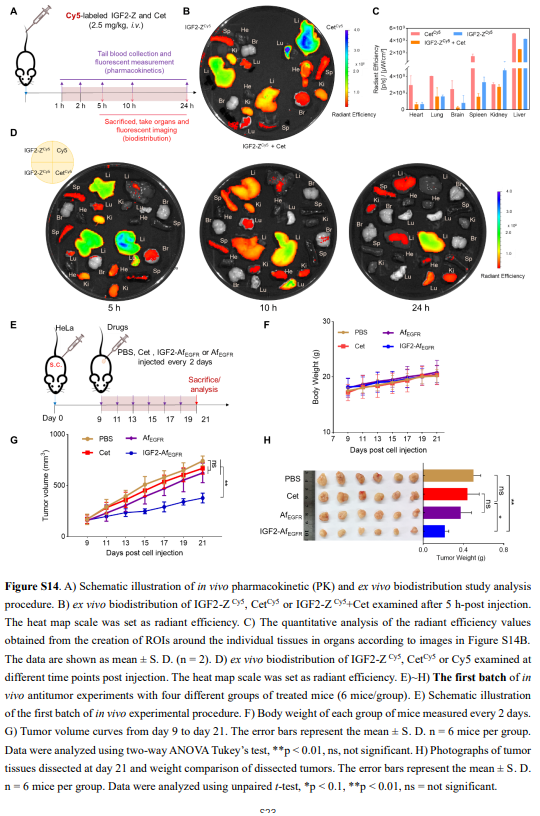
(图片来源:J. Am. Chem. Soc.)
随后,作者使用HeLa细胞异种移植的Balb/c裸鼠,在体内评估iLYTACs的治疗潜力。结果表明,用IGF2-Z+Cet治疗的小鼠的肿瘤体积和重量下降了~50%,而用IGF2-AfEGFR治疗的小鼠肿瘤体积和体重下降水平略低(图6E和F)。WB结果也表明通过使用iLYTAC,体内EGFR成功降解(图6G/H)。
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn