

(图片来源:J. Am. Chem. Soc.)
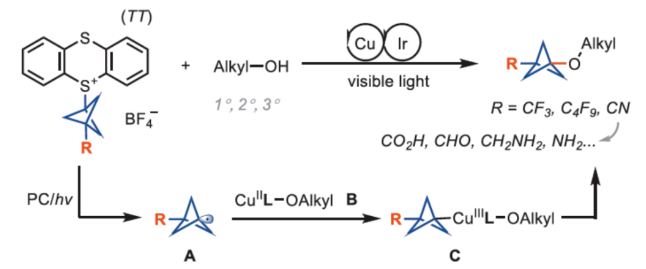
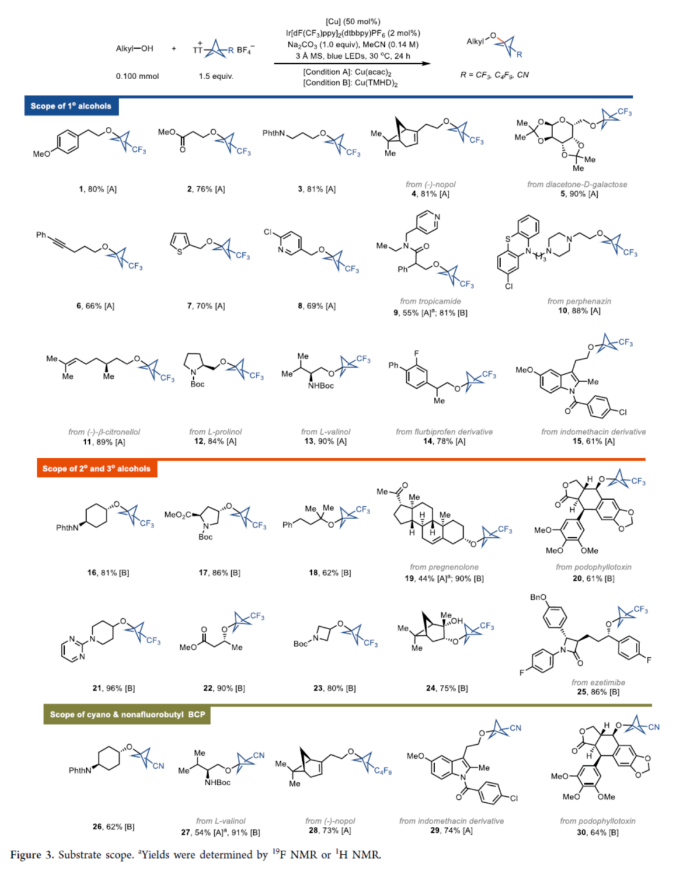
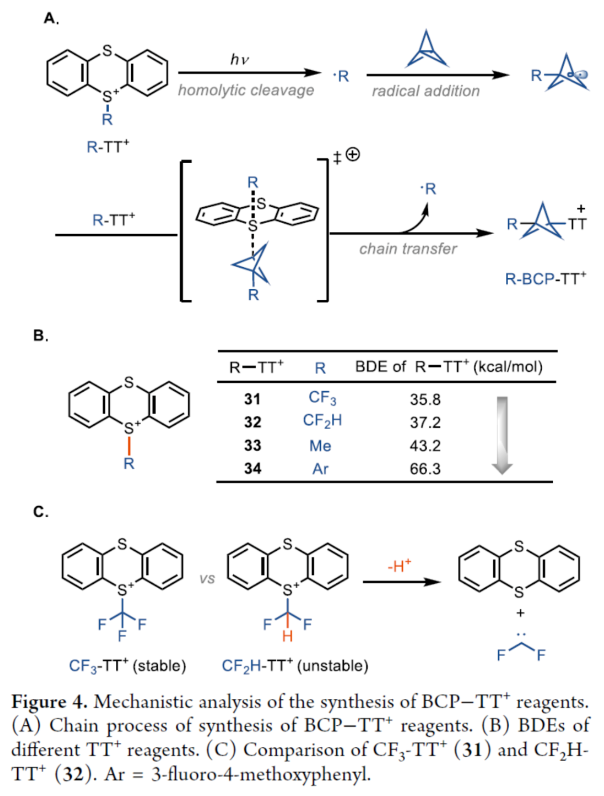
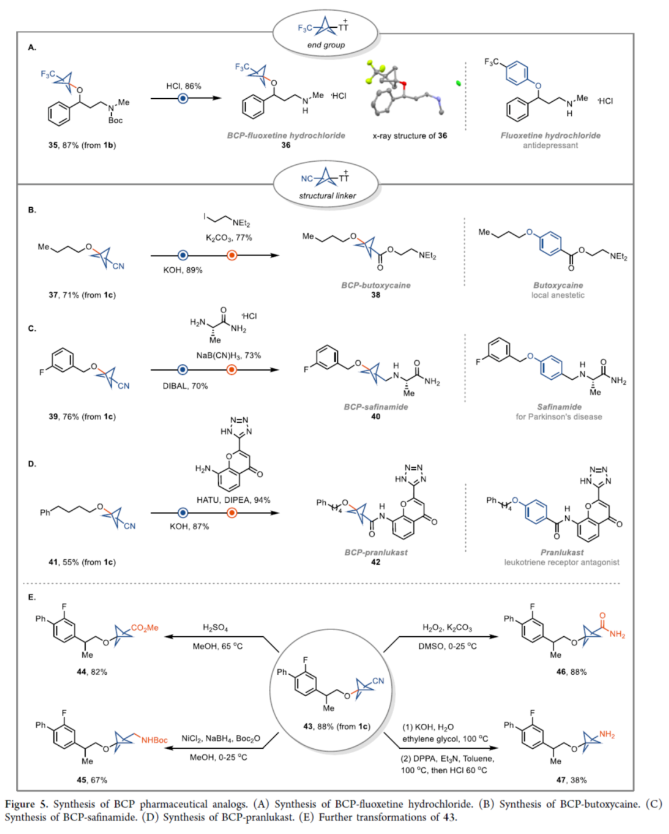
正文 在现代药物化学中,用富含sp3的生物电子等排体取代平面苯环可以提高代谢稳定性、膜渗透性和溶解度。在过去的几十年里,化学家们通过[1.1.1]-螺桨烷的官能团化或基于BCP试剂的交叉偶联反应,已经实现了多种取代BCPs的合成,如BCP胺、BCP芳烃、BCP烷烃和BCP芳醚。然而,对于醇与BCP骨架的直接烷基化反应,仍有待进一步的探索。近日,德国马克斯普朗克煤炭研究所Tobias Ritter课题组首次使用BCP-噻蒽鎓(TT+)试剂,实现了醇的双环戊基化反应(bicyclopentylation)。与通过碳阳离子中间体将醇与三级亲电试剂(如溴代叔丁烷)进行烷基化不同,该方法通过金属介导的自由基过程进行,可绕过不稳定的BCP阳离子。机理研究表明,TT可能潜在地充当光氧化还原催化剂与铜催化剂之间的电子转移介质。下载化学加APP到你手机,更加方便,更多收获。 烷基芳基醚是药物活性化合物中的重要结构单元,如氟西汀、Butoxycaine、沙芬酰胺和普仑司特。目前,羟基取代的BCP与烷基化试剂的烷基化反应是合成BCP烷基醚的常用方法。因此,在强碱条件下进行的传统Williamson醚合成方法中,仅限于反应性的一级亲电试剂,如苄基溴(Figure 1A,left)。同时,基于BCP试剂对醇进行双环戊基化反应是合成三级烷基醚的另一种概念上不同的方法,但极具挑战(Figure 1A,right)。前期,Baran(Nature 2019, 573, 398.)和Ohmiya(J. Am. Chem. Soc. 2020, 142, 1211.)课题组分别报道了通过电化学和有机光氧化还原催化策略,以三级烷基羧酸和醇为底物,优雅地合成了大位阻的二烷基醚。成功的关键在于在非酸性条件下生成三级碳阳离子或类碳阳离子中间体,这些中间体随后可以被醇亲核试剂捕获。然而,BCP羧酸作为桥头3°碳阳离子前体,在这些条件下不能提供相应的产物(Figure 1B),这可能是因为BCP阳离子中间体的稳定性低。迄今为止,BCP金属、BCP卤化物、BCP硼酸盐、BCP胺和BCP羧酸盐衍生物是构建BCPs最常用的试剂。然而,它们中没有一种用于醇的官能团化以构建醚键。近日,Tobias Ritter课题组开发第一个使用BCP−TT+试剂实现了TM-催化醇的双环戊基化反应(Figure 1C)。其中,反应可以通过还原生成BCP自由基A来进行。随后,BCP自由基被金属醇盐中间体B捕获,形成Cu(III)中间体C,其经过还原消除以形成C−O键。 (图片来源:J. Am. Chem. Soc.) 首先,作者以4-甲氧基苯乙醇1a与三氟甲基双环戊基噻蒽鎓盐(CF3-BCP−TT+BF4−,1b)作为模型底物,进行了相关反应条件的筛选(Figure 2A)。当以Cu(acac)2(50 mol %)作为催化剂,Ir[dF(CF3)ppy]2(dtbbpy)PF6(2 mol %)作为光催化剂,Na2CO3(1.0 equiv)作为碱,3Å分子筛作为添加剂,460 nm蓝色LEDs作为光源,在MeCN溶剂中30 oC反应24 h,可以85%的收率得到产物1。 同时,作者还对反应的机理进行了研究(Figure 2B)。Stern-Volmer研究结果表明,Cu(acac)2和噻蒽(TT)有效淬灭了光激发敏化剂(Ir[dF(CF3)ppy]2(dtbbpy)PF6)的发光(Figure 2B)。基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure 2C)。首先,LnCuII经SET后生成活性催化剂LnCuI。诱导后,反应可以通过TT还原淬灭激发的Ir(III)光氧化还原催化剂来进行。其次,在激发的Ir(III)光催化淬灭后,Ir(II)配合物可以还原BCP−TT+盐,生成BCP自由基III。TT自由基阳离子可以氧化Cu(I)催化剂生成Cu(II)催化剂,可与O-亲核试剂进行配体交换。与中间体III的氧化连接(oxidative ligation)得到Cu(III)配合物IV。最后,中间体IV经还原消除后形成所需产物。 (图片来源:J. Am. Chem. Soc.) 在获得上述最佳反应条件后,作者对底物范围进行了扩展(Figure 3)。首先,在Condition A条件下,一系列一级烷基醇,均可顺利反应,获得相应的产物1-15,收率为55-90%。其次,在Condition B条件下,一系列二级或三级烷基醇,也与体系兼容,获得相应的产物16-25,收率为61-96%。此外,含有氰基与全氟丁基取代的BCP,也是合适的底物,获得相应的产物26-30,收率为54-91%。值得注意的是,该策略可用于一系列药物分子的后期衍生化,进一步证明了反应的实用性。同时,一系列活性的基团,如烷氧羰基、卤素、炔基、烯基等,均与体系兼容。 (图片来源:J. Am. Chem. Soc.) 此外,作者还对反应机理进行了进一步的研究(Figure 4)。首先,反应很可能通过自由基链转移进行,在光化学引发后,TT自由基阳离子从起始底物转移到产物上(Figure 4A)。对于链引发和传播,CF3-TT+(31)中C−S键的均裂是容易的,这是相当稳定的CF3自由基的情况。然而,如DFT计算所支持的,其它取代基,如Me-TT+(33)中的甲基取代基,结合更强(Figure 4B)。其次,其它化合物也具有小的键离解能(BDE),可能参与产生链转移的化合物不能合成,因为它们缺乏稳定性。例如,31的二氟甲基类似物(32;Figure 4C)是不稳定的,可能是由于从阳离子锍盐中快速消除导致。氰基取代的BCP化合物1c是通过不同的程序合成的,并且显示出不能扩展到其它亲核试剂的独特合成,可能是由于竞争性氧化还原化学,而不是氰化物被噻蒽鎓自由基阳离子氧化。 (图片来源:J. Am. Chem. Soc.) 最后,作者对反应的实用性进行了研究(Figure 5)。首先,以1b为底物,通过两步反应,可以两步74%的总收率得到盐酸氟西汀的BCP类似物36(Figure 5A)。同时,BCP试剂1c的氰基可以作为合成其它1,3-二取代BCPs的关键。例如,化合物37通过氰基水解以及随后的烷基化后,可以三步48%的总收率得到BCP-butoxycaine(38)(Figure 5B)。类似地,化合物41经水解和酰胺缩合后,可以三步45%的总收率得到BCP-普仑司特(42)(Figure 5D)。化合物39也可以选择性地还原为BCP醛,从而能够进行还原胺化,可以三步39%的总收率得到BCP-沙芬酰胺(40)(Figure 5C),这些类似物以前都没有报道过。此外。BCP骨架中的氰基可以进一步转化为甲基羧酸酯、甲基氨基、酰胺和氨基取代基,获得相应的衍生物44-47,收率为38-88%(Figure 5E)。 (图片来源:J. Am. Chem. Soc.) 总结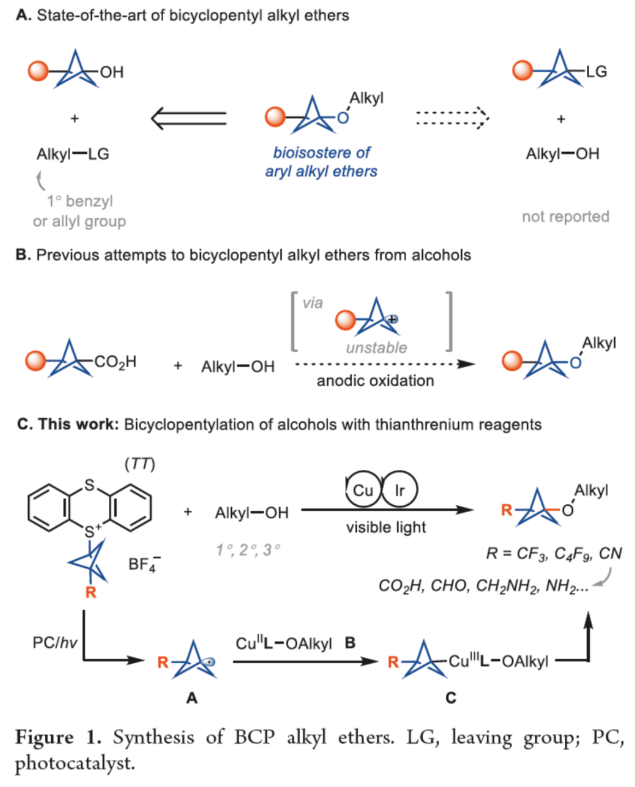

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn