

(图片来源:J. Am. Chem. Soc.)
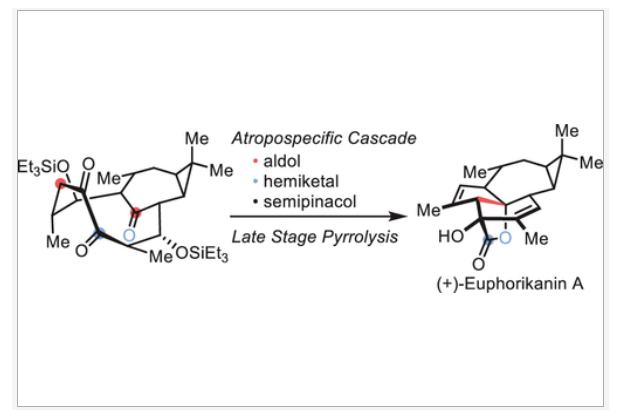
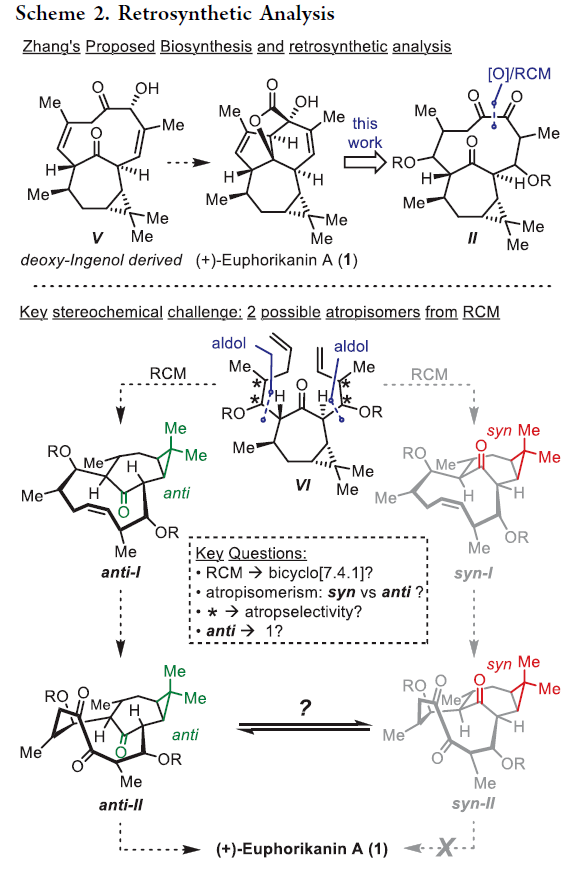
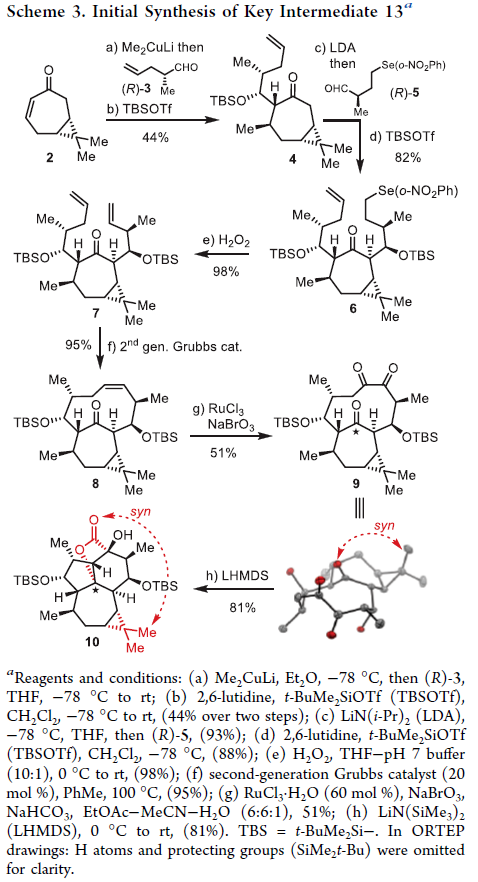
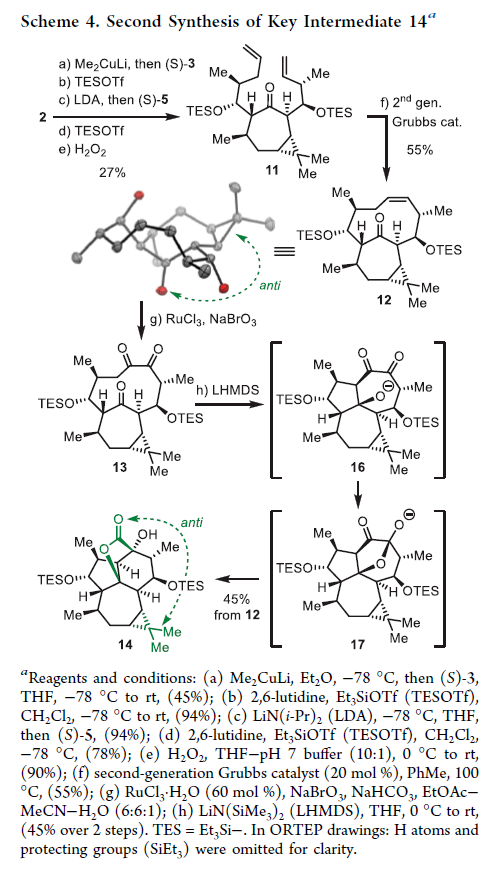
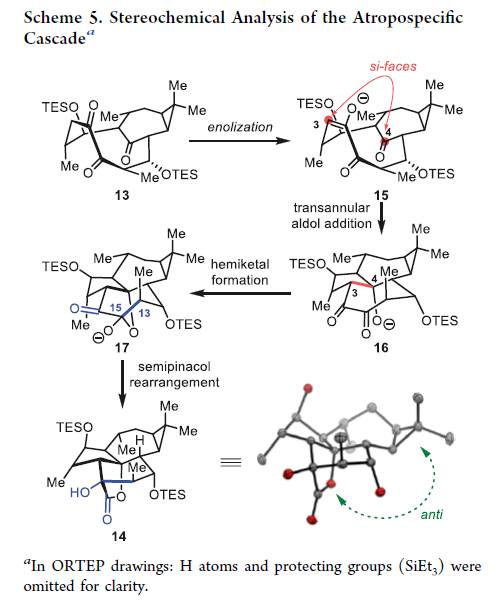
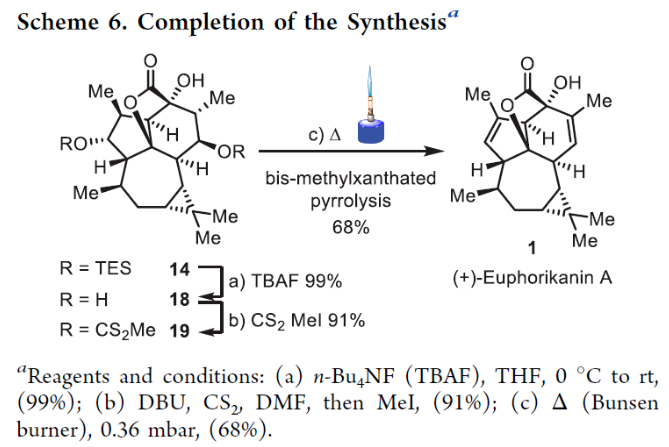
正文 大戟科植物家族会生产包含一系列具有生物活性的天然产物,其中最著名的当属ingenane二萜,其在近几十年来一直是合成化学家们的研究主题。2016年,兰州大学张占欣团队从大戟科植物kansui中分离得到(+)-euphorikanin A (1)(Scheme 1),其被认为是一种重排的ingenane。由于其分子内具有5/6/7/3-四环骨架以及[3.2.1]-桥联γ-内酯骨架,因此在合成上具有很大的挑战性。到目前为止,仅有两个课题组实现了(+)-euphorikanin A (1)的全合成。这两种方法的共同点是按顺序组装A环和B环。最近,瑞士苏黎世联邦理工学院Erick M. Carreira课题组实现了(+)-euphorikanin A的全合成,其利用一个官能团化的十元环一步实现了A环、B环和γ-内酯的合成。该合成策略的核心包括通过闭环复分解(RCM)形成双环[7.4.1]十四烯I和从三烯酮II通过串联反应得到euphorikanin骨架IV。下载化学加APP到你手机,更加方便,更多收获。 (图片来源:J. Am. Chem. Soc.) 在逆合成分析中,作者认为使用(+)-carene通过两个连续的aldol加成可以得到中间体VI,其经历关环复分解得到中间体I,并经历一系列串联反应,通过中间体II得到(+)-euphorikanin A (1)(Scheme 2)。值得注意的是,在双环[7.4.1]体系中会存在两种可能的阻旋异构体anti-I和syn-I,而反式异构体anti-I的立体化学与产物一致。因此这就产生了以下问题:1)是否可以依靠RCM来合成双环[7.4.1]十四烯酮? 2)反应是否会对一种阻旋异构体有偏好?如果有,它们是否可以相互转换?3)侧链的构型是否会影响环癸烯形成过程中的阻旋选择性? 4)三酮anti-II是否参与了实现(+)-euphorikanin A (1)合成的串联反应? (图片来源:J. Am. Chem. Soc.) 作者首先以烯酮2为起始原料,通过与Me2CuLi的共轭加成以及随后与醛(R)-3反应,得到的羟基用TBS保护,以44%的产率得到单一的非对映异构体4 (Scheme 3)。另一侧链通过4与LiN(i-Pr)2的位点选择性烯醇化以及与(R)-5的aldol加成和二级醇羟基的TBS保护,以82%的产率得到6。接下来,6在H2O2存在下发生消除,以98%的产率得到二烯烃7。二烯烃7在Grubbs二代催化剂存在下发生关环烯烃复分解,以95%的产率得到环癸烯产物8。通过1H 和13C NMR分析,作者发现产物8为单一的异构体,由此表明反应具有阻旋异构选择性。接下来,作者将8在RuCl3、NaBrO3条件下氧化,以51%的产率得到三酮产物9。作者通过对9进行晶体解析得出十元环阻旋异构体的相对构型为顺式。接下来,当作者将9在LiN(SiMe3)2的THF溶液中室温反应2小时后,可以以81%的产率得到单一异构体产物10。然而,作者通过单晶衍射得出由于环丙烷和内酯为顺式,因此10是不适合合成(+)-euphorikanin A (1)的。虽然作者尝试将8或9进行异构化,但均未成功。 (图片来源:J. Am. Chem. Soc.) 于是作者变换思路,开始了第二代合成(Scheme 4)。作者从单一对映体的醛(S)-3和(S)-5出发,并通过其它相同的步骤以五步27%的产率从烯酮2实现了RCM前体11的合成。而11通过烯烃关环复分解反应可以以55%的产率得到双环[7.4.1]十四烯酮12,且单晶衍射结果表明环丙烷与桥接酮成反式关系。因此,通过对侧链构型的转变,可以得到期望的阻旋异构选择性。接下来,作者在RuCl3、NaBrO3条件下氧化12为相应的三酮13,在无需分离纯化的情况下加入LHMDS,可以以两步45%的产率得到单一的异构体内酯产物14。单晶衍射实验结果表明,内酯14的构型与(+)-euphorikanin A (1)一致。 (图片来源:J. Am. Chem. Soc.) 为了深入理解构建14的立体化学过程,作者在Scheme 5中提出了可能的反应路径。阻旋异构体13形成烯醇酯15时,其si-面进攻内桥接酮的si-面,产生 (+)-与(+)-euphorikanin A (1)具有相同C-3和C-4结构构型的产物16。而C-4的结构决定了半缩酮的形成。从17开始,C-13-C-15键进行立体电子排列,进行半频哪醇重排得到(+)-euphorikanin A骨架14。因此,在一次操作中,构建了5/6/7并环体系和桥接γ-内酯骨架以及构建了三个连续的立体中心。 (图片来源:J. Am. Chem. Soc.) 最后,作者将14在n-Bu4NF存在下脱保护,以99%的产率得到三醇产物18(Scheme 6)。随后,18通过选择性的形成黄原酸甲酯得到19(99%),并经历Chugaev消除,再借助真空热解手段来实现纯化,以68%的产率得到(+)-euphorikanin A (1)。且产物的所有分析数据(1H NMR, 13C NMR, IR, HRMS, [α]D)均与文献报道一致。 (图片来源:J. Am. Chem. Soc.) 总结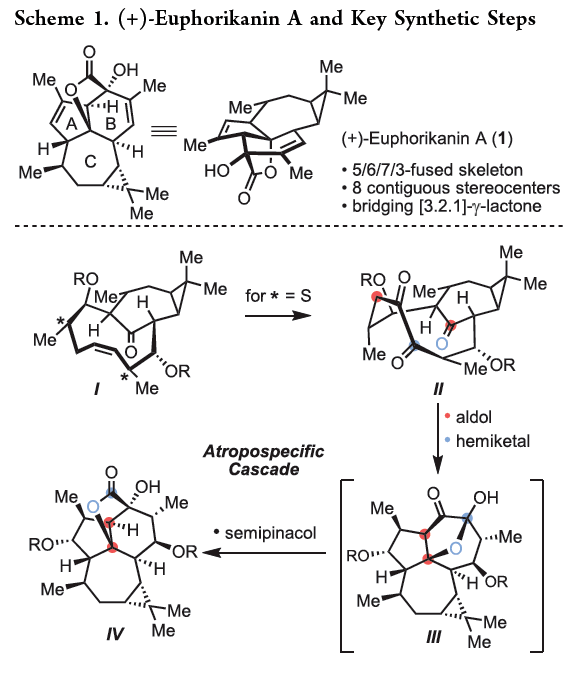
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn