

(图片来源:Science)
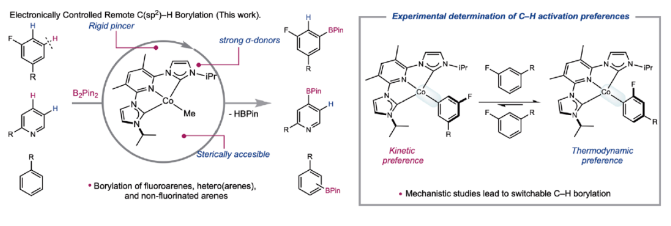
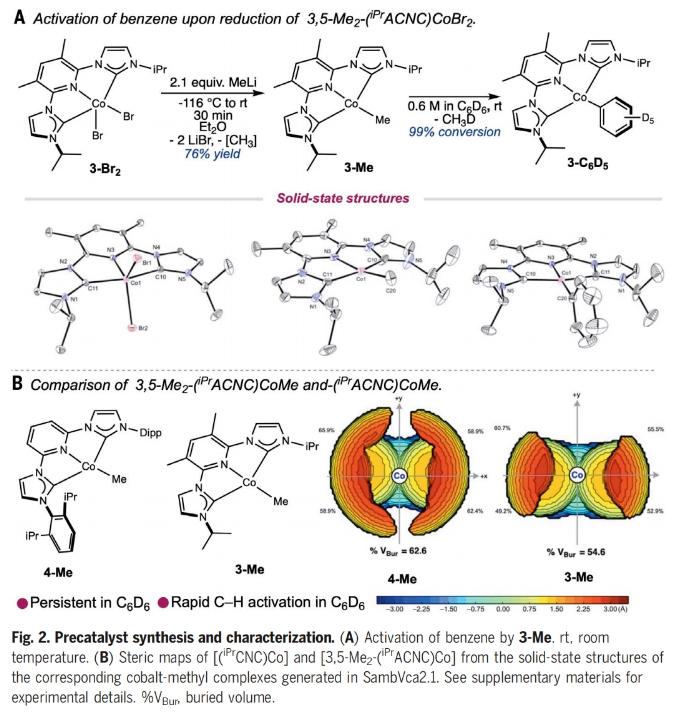
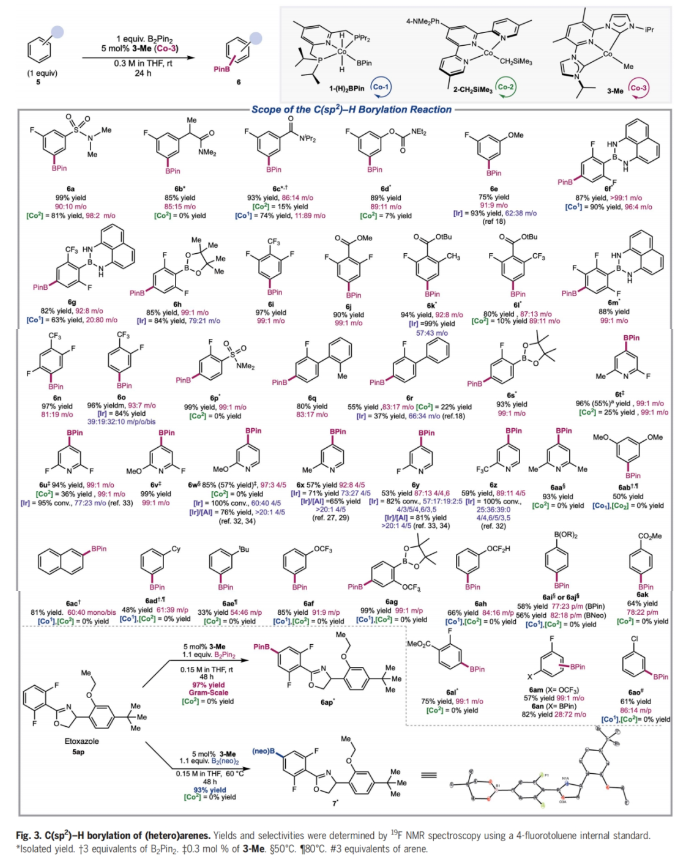
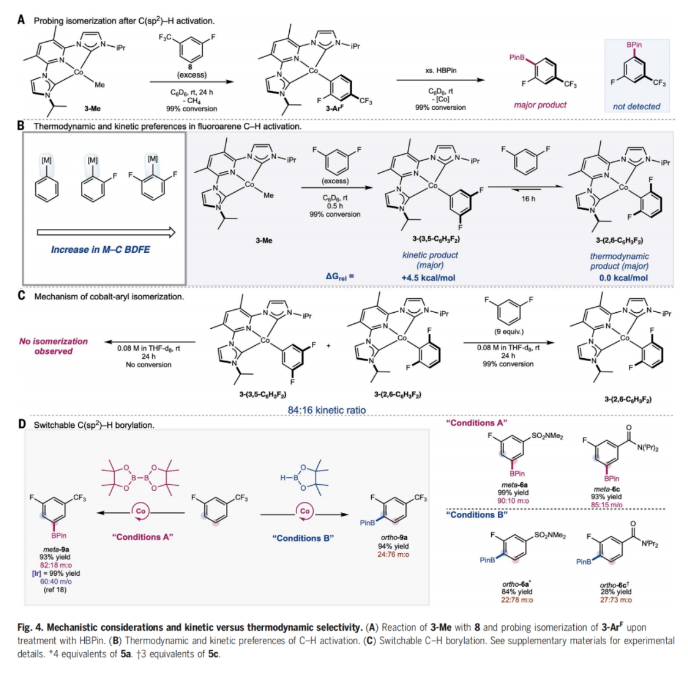
正文 C-H官能团化是化学合成中惰性键活化的最直接方法,并为药物、农用化学品和芳烃相关材料科学中的分子提供了一条直接的途径。然而,在金属催化的C-H官能团化反应中,位点选择反应的发展仍然是一个巨大的挑战。高位点选择性C(sp2)-H硼化反应是有机合成中最具影响力的C-H官能团化方法之一,主要是由于构建的C-B键可以很容易的发生选择性转化。到目前为止,铱催化的C(sp2)-H硼化反应广泛的发展。然而,目前所发展的铱催化,位点选择性C-H硼化主要依赖于导向基和配体的非共价相互作用。尽管配体设计的进步已经解决了固有的立体驱动位点选择性问题,但由于氟取代基的较弱配位能力以及与氢具有相似的几何大小,实现医学相关分子(如氟芳烃)的远端C(sp2)-H硼化仍然是一个重大挑战。最近,美国普林斯顿大学Paul J. Chirik课题组发展了利用廉价的钴催化,ACNC pincer配体促进的氟代芳烃选择性远程C(sp2)-H硼化反应(Fig. 1)。下载化学加APP到你手机,更加方便,更多收获。 (图片来源:Science) 首先,作者以93%的产率合成出了3-Br2(3,5-Me2-(iPrACNC)Co(Br)2),并通过与MeLi的进一步转化,以76%的产率得到了3-Me。且3-Me在室温下即可有效的实现苯的活化,以99%的转化率得到3-C6D5。相反,4-Me即使在加热到80 oC也不能实现苯的活化。作者通过对3-Me和4-Me的固态结构进行分析得出4-Me的翼尖对CNC pincer的XZ平面上下有明显的屏蔽作用。值得注意的是,4-Me的隐藏体积(buried volume)要明显高于3-Me(Fig. 2)。 (图片来源:Science) 鉴于3-Me具有快速活化芳环的能力,作者利用3-Me来探索C(sp2)-H硼化反应(Fig. 3)。通过一系列条件筛选,作者发现当使用芳烃(1.0 equiv),B2Pin2(1.0 equiv),3-Me(5 mol%),在THF(0.3 M)中室温反应24小时为最佳反应条件。此外,实验结果表明一系列取代的芳烃和杂芳烃底物均具有良好的普适性,以33-99%的产率得到相应的间位硼化产物6a-4z, 6aa-6ap。其中,包括卤素、烷基、烷氧基、酰胺基、磺酰胺基、硼酸酯、酯基、三氟甲氧基、醚等一系列官能团均可兼容。值得注意的是,当使用甲壳素合成抑制剂乙螨唑etoxazole (5ap)为底物时,可以以97%的产率实现间位硼化产物6ap的克级规模合成。此外,当使用B2(neo)2为硼试剂时,可以以93%的产率得到产物7,且产物结构通过单晶得到了确证。 为了深入了解C-H硼化选择性的起源,作者首先合成了与催化相关的钴(I)-氟芳基络合物。当使用过量的氟芳烃(8)与3-Me的氘代苯溶液在室温下反应,会经历氟原子邻位的C-H活化,形成相应的钴(I)-芳基络合物3-ArF(Fig. 4A)。且通过19F NMR未检测到相应的3-ArF异构体信号。值得注意的是,此催化过程中C-H键活化的首选位点本应是氟原子的间位,得到间氟硼酸酯产物。为了探究在生成钴络合物后经历了分子内或HBPin诱导的异构化,作者又检测了3-ArF与HBPin的反应。当用过量的HBPin与3-ArF反应时仅形成了氟原子邻位的硼化产物。且19F NMR未检测到芳基硼酸酯的其它异构体,从而排除了在C-B键形成之前发生异构化。为了合理解释形成化学计量实验与催化反应中所观察到的主要产物之间的差异,作者利用核磁共振波谱法监测了3-Me与一系列氟芳烃的化学计量反应。在整个实验过程中,作者通过19F NMR并没有检测到的对位异构体(Fig. 4B)。为了进一步理解钴-芳基异构化的反应机理,作者进行了动力学实验(Fig. 4C)。实验结果表明钴-芳基异构化的发生需要过量的氟芳烃参与。此结果支持了反应在动力学上倾向于在氟原子间位发生C-H活化和在热力学上倾向于形成邻位异构体。此外,作者通过实验证实与使用HBPin相比,使用B2Pin2时C-B键的形成速率更快。一系列机理实验表明,通过氟芳基钴中间体间位对第二个芳烃的分子间C-H活化,可以异构化为热力学上首选的钴芳基中间体。当作者使用5a和5c作为底物时,硼化反应的首选位点也发生了改变(Fig. 4D)。通过对两种市售硼试剂(HBPin和B2Pin2)之间简单地改变,作者即可以从单一催化剂获得两种不同的选择性。这些观察结果与传统的利用配体或过渡金属络合物来调控位点选择性的调控策略是完全不同的。 (图片来源:Science) 总结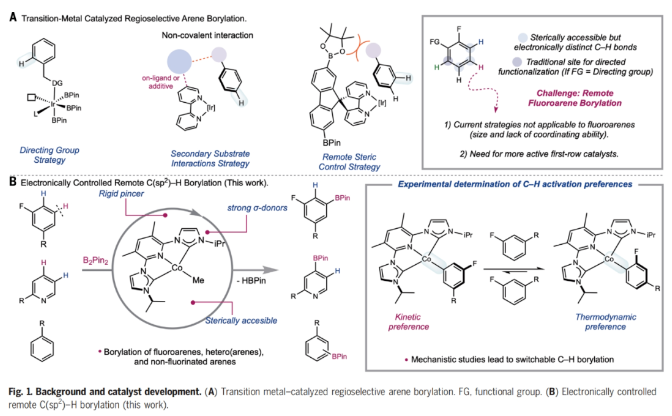
Paul J. Chirik课题组发展了钴催化,ACNC pincer配体促进的氟代芳烃选择性远程C(sp2)-H硼化反应。该反应对富电子芳烃、吡啶以及三氟、二氟甲氧基化的芳烃均具有良好的普适性,且具有良好的官能团兼容性。此外,作者还利用相同的钴催化剂,通过不同硼试剂的切换来调控芳烃位点选择性C-H硼化。机理研究表明在热力学上倾向于邻位C-H活化,而在动力学上倾向于间位C-H活化。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn