

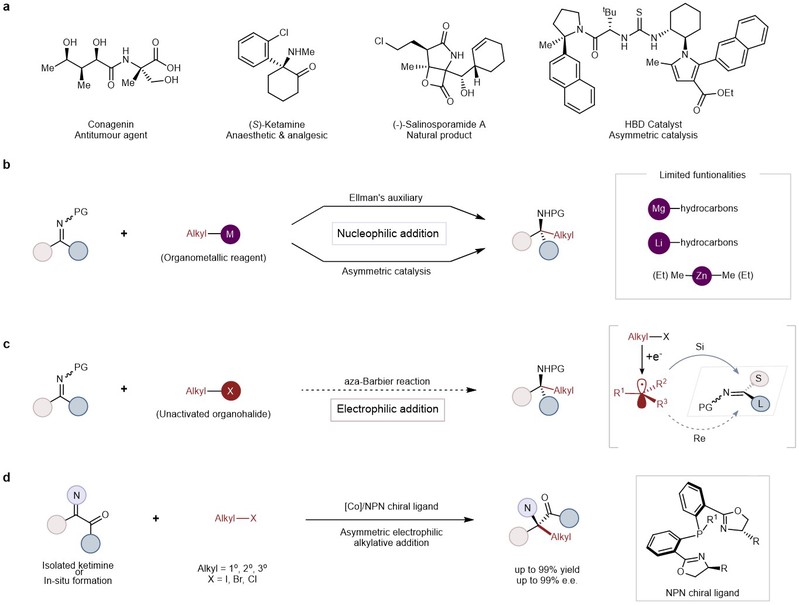
手性α-氨基酸广泛存在于活性天然产物及药物分子的核心骨架中,是一类十分重要的有机合成砌块,与人们的生活休戚相关。人类必需的20种氨基酸即蛋白源氨基酸,是生命体中多肽和蛋白质的基本组成单元,其大多数都包含α-二级手性碳。相比之下,具有良好的结构刚性及多样性的非蛋白源α-季碳氨基酸衍生物则难以通过自然界获得。由于季碳立体中心的空间拥挤,构建难度较大,有机金属试剂与α-酮亚胺酯的不对称加成反应是构建手性α-季碳氨基酸衍生物最为经典的方法之一,但该方法仍然存在着官能团容忍性差、底物适用性窄、原子及步骤经济低等局限。到目前为止,高效实用的非天然手性α-季碳氨基酸的合成方法依旧匮乏。
为解决上述的科学问题,陈宜峰课题组利用丰产金属钴催化不对称还原加成策略,通过非活化烷基卤代物与亚胺的不对称aza-Barbier型反应,以高达99%的收率及99%ee实现了手性α-季碳氨基酸衍生物的多样化高效合成。该方法具有操作简便、条件温和、底物适用性广等优点。其中,非活化的1°、2°和3°烷基碘代物、溴代物及氯代物均能参与反应,同时具有十分出色的官能团容忍性。除此之外,本研究通过新发展的方法还能够实现3至7元手性含氮杂环的模块化合成以及两类活性药物分子核心骨架的简洁构建,展示了该方法广阔的实际应用前景,为药物研发提供了新的思路。
该工作主要由华东理工大学化学与分子工程学院博士后伍贤青完成,通讯作者为陈宜峰教授,并得到了曲景平教授的悉心指导。研究工作得到了国家自然科学基金、上海市自然科学基金、上海市启明星计划、费林加诺贝尔奖科学家联合研究中心、材料生物学与动态化学教育部前沿科学中心、上海市扬帆计划、中央高校基本科研业务费等项目资金以及中国博士后科学基金等资助。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn