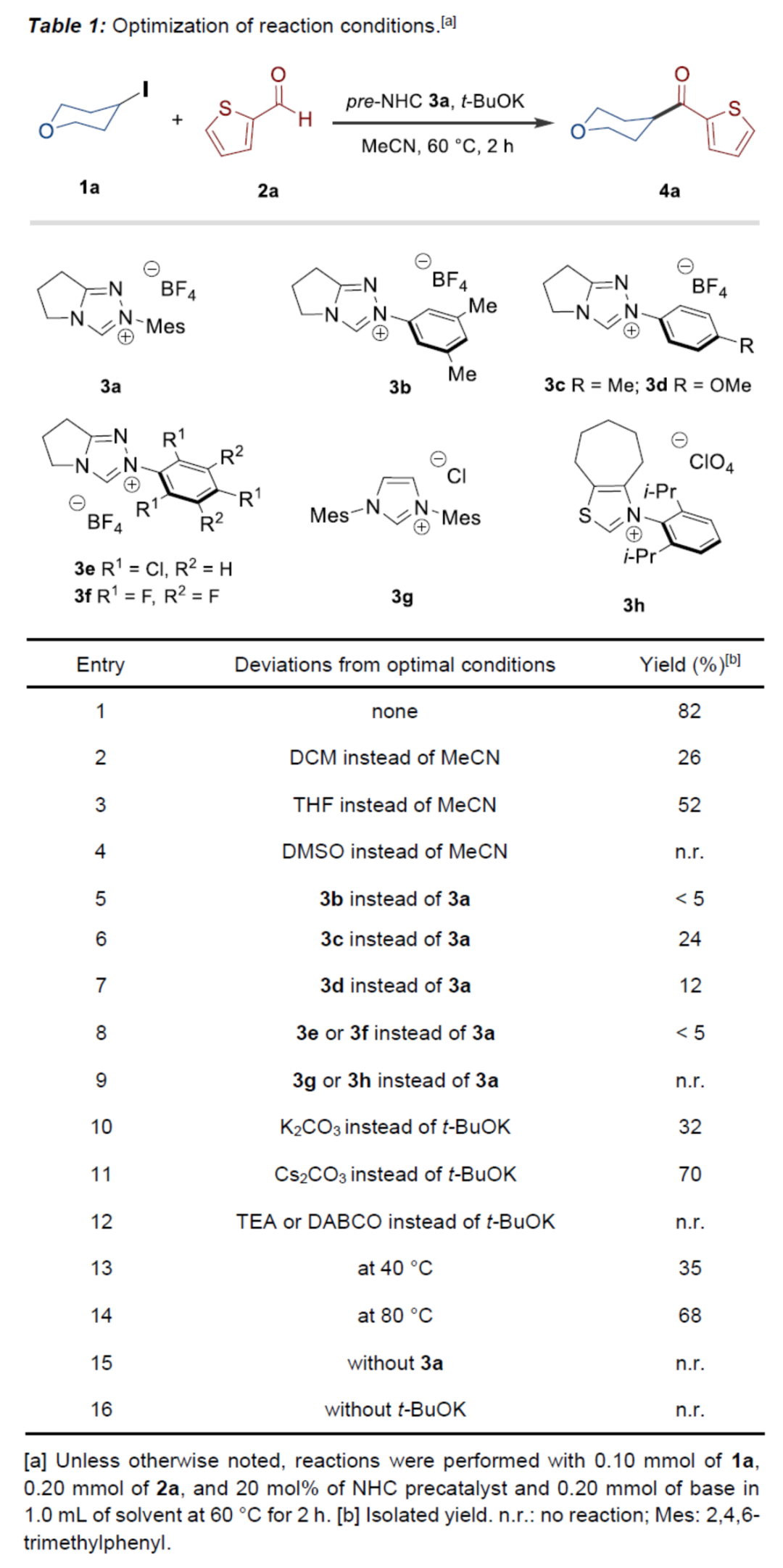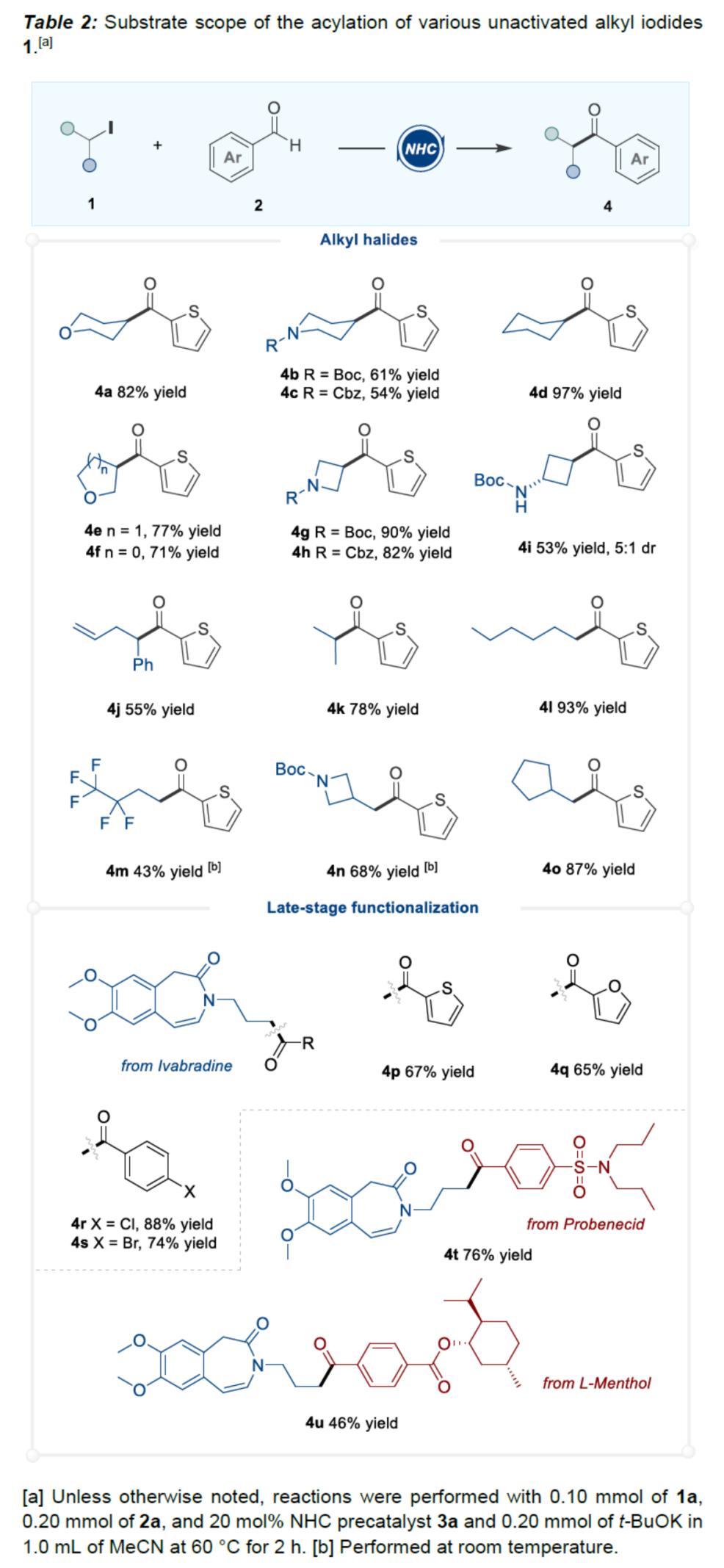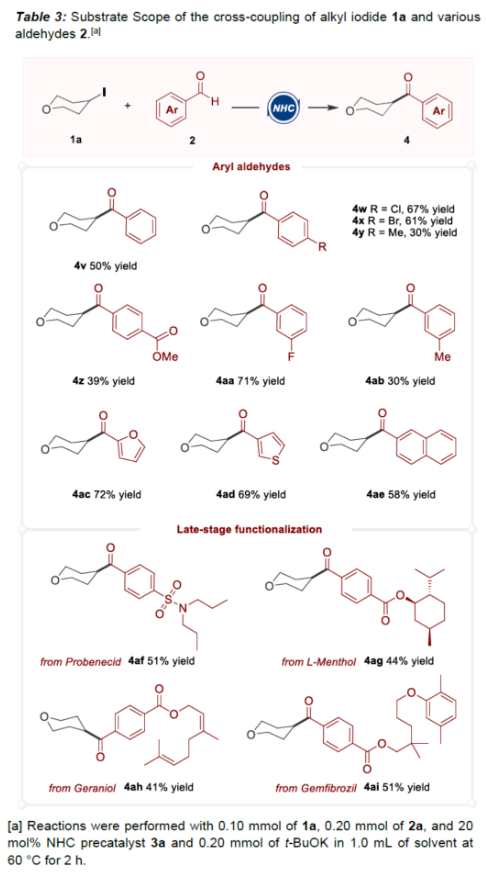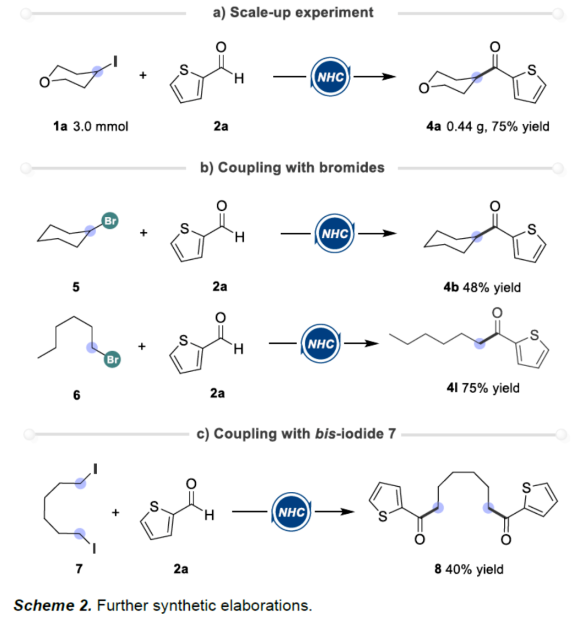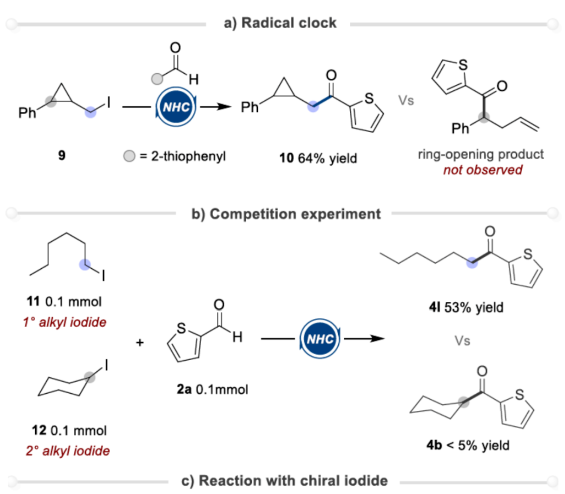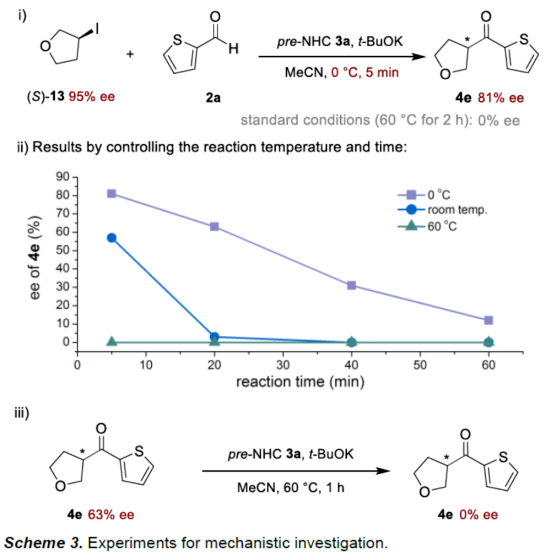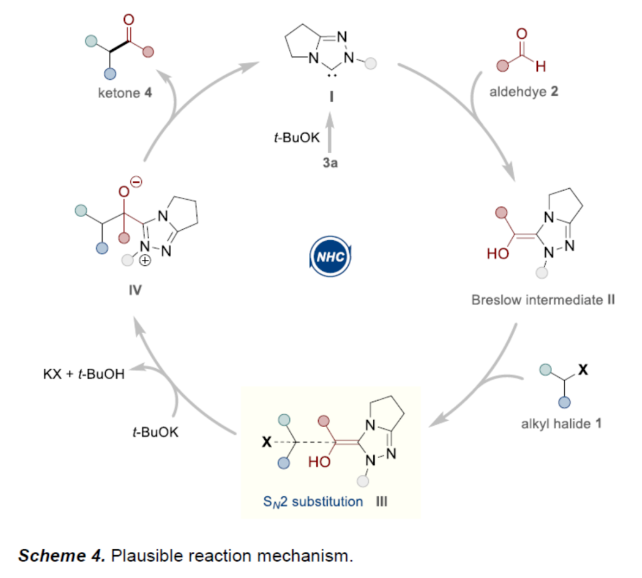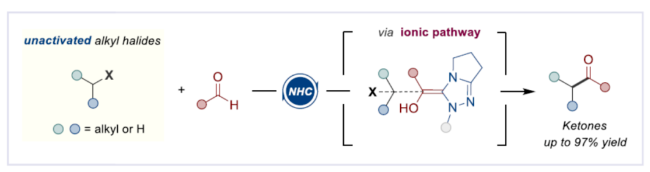
(图片来源:Angew. Chem. Int. Ed.)酮作为一类重要的分子骨架,广泛存在于众多天然产物、药物分子以及农用化学品中。同时,酮还是一种经典的合成砌块,能够参与多种途径的化学转化。因此,开发从简单易得的起始原料合成酮的高效方法仍然是一项具有挑战性的工作。其中,由结构多样且廉价易得的醛直接转化为酮更是一项极具吸引力的合成策略。传统由醛到酮的转化往往需要当量的金属有机试剂和多步反应的转化过程,比如:金属有机试剂对醛羰基进行亲核加成,然后再对所得醇进行氧化制备相应的酮等。近年来,C-H或C-B键与醛的直接酰化反应成为又一类合成酮的高效方法。然而,这些方法往往需要使用当量的氧化剂。此外,金属催化自由基途径的酰化偶联反应不需要使用氧化剂,但需要先预置氧化还原活性的反应位点(Scheme 1a)。下载化学加APP到你手机,更加方便,更多收获。sp2-杂化芳基卤化物作为一类重要的有机卤化物,在过渡金属催化醛的酰化反应中被广泛用作偶联底物。与之相反地是,烷基卤化物参与这类偶联反应却更具合成难度,这可能是因为金属催化剂对sp3-杂化碳卤键的氧化加成速率较慢以及更容易发生β-氢消除副反应等原因。此外,化学家们还利用有机小分子催化实现了烷基卤化物的酰化反应。然而,该合成策略受限于卤代物的电性制约,特别是对于非活化的中性烷基卤代物的酰化反应几乎未见报道。近来,实现醛与非活化卤代物的酰化策略主要是通过金属镍/光/有机的协同催化 (MacMillan, et al, J. Am. Chem. Soc. 2017, 139, 11353.),以及介离子卡宾自由基催化 (Bertrand, Yan, et al, Angew. Chem. Int. Ed. 2023, 62, e202303478.)等单电子反应途径,而双电子的极性反应途径还未见报道(Scheme 1c)。成都大学药学院、四川抗菌素工业研究所李俊龙教授团队长期致力于氮杂环卡宾催化的新反应开发(Angew. Chem. Int. Ed. 2020, 132, 1879; Angew. Chem. Int. Ed. 2022, 61, e202116629; Angew. Chem. Int. Ed. 2022, 61, e202207824; Chem. Sci. 2022, 13, 2584)。最近,该团队又报道了一例氮杂环卡宾催化醛与非活化卤代物直接酰化反应(Angew. Chem. Int. Ed. 2023, 62, e202309572.)。机理研究表明,该反应是通过双电子历程的亲核取代实现芳酰化过程(Scheme 1d)。(图片来源:Angew. Chem. Int. Ed.)首先,作者通过模板反应的筛选建立了以三氮唑类型的氮杂环卡宾前体3a为催化剂,叔丁醇钾(t-BuOK)作为碱,乙腈(MeCN)作为溶剂的最优反应条件(Table 1)。(图片来源:Angew. Chem. Int. Ed.)随后,作者对非活化烷基卤代物的底物适用范围进行了研究(Table 2)。在绿色温和的条件下,能够高效地实现芳基醛与多类非活化卤代烃的酰化偶联,展现出良好的底物普适性。此外,天然产物的后修饰也验证了该反应良好的官能团兼容性。(图片来源:Angew. Chem. Int. Ed.)(图片来源:Angew. Chem. Int. Ed.)为了进一步研究该策略的适用性,作者还进行了反应的克级放大实验,此反应放大到克级后,收率并没有显著地下降,显示出该方法具有一定的合成实用性。并且还验证了非活化烷基卤代物的范围可以扩展到溴代物以及双碘代化合物等(Scheme 2)。(图片来源:Angew. Chem. Int. Ed.)最后,作者还对反应机理进行了深入考察。首先,自由基钟实验,以及1°卤代物与2°卤代物的竞争实验,表明反应可能不是经过自由基历程,而是经过亲核取代的极性反应历程。除此之外,当手性烷基卤代物参与该反应时,能够得到手性保留的酰化产物,进一步证明该反应可能是通过SN2类型的亲核取代完成芳酰化过程。(图片来源:Angew. Chem. Int. Ed.)基于上述的机理实验研究,作者提出了一种可能的反应机理(Scheme 4)。首先,卡宾催化剂I和醛2反应生成富电的Breslow中间体II。随后,Breslow中间体II与烷基碘化物1完成SN2型亲核取代类型的偶联反应,最后,释放卡宾催化剂I,同时生成目标产物酮4,从而完成催化循环的过程。(图片来源:Angew. Chem. Int. Ed.)成都大学李俊龙教授团队报道了一例氮杂环卡宾催化醛与非活化卤代物直接酰化反应(Angew. Chem. Int. Ed. 2023, 62, e202309572.)。机理研究表明,该反应是通过双电子历程的亲核取代实现芳酰化过程,这与以往报道的自由基途径的反应不同,进一步扩宽了氮杂环卡宾催化酰化偶联的应用范围。文献详情:
Qing-Zhu Li, Rong Zeng, Peng-Shuai Xu, Xin-Hang Jin, Chuan Xie, Qi-Chun Yang, Xiang Zhang, Jun-Long Li*. Direct Acylation of Unactivated Alkyl Halides with Aldehydes through N-Heterocyclic Carbene Organocatalysis. Angew. Chem. Int. Ed. 2023, 62, e202309572, https://doi.org/10.1002/anie.202309572.