

(图片来源:J. Am. Chem. Soc.)
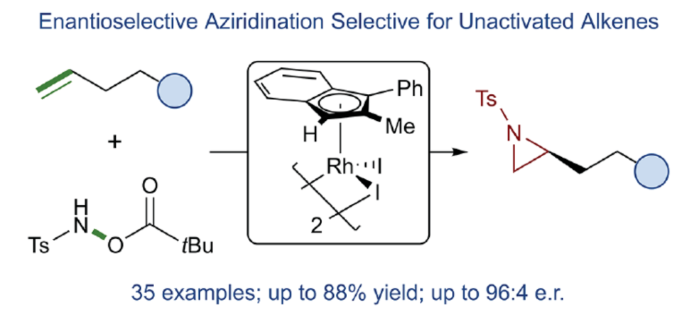
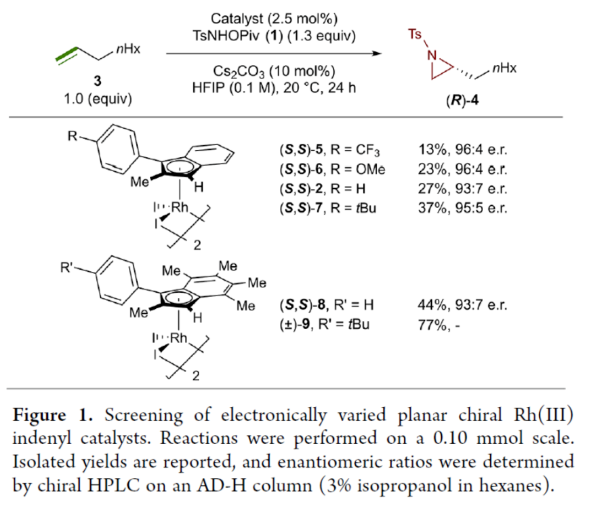
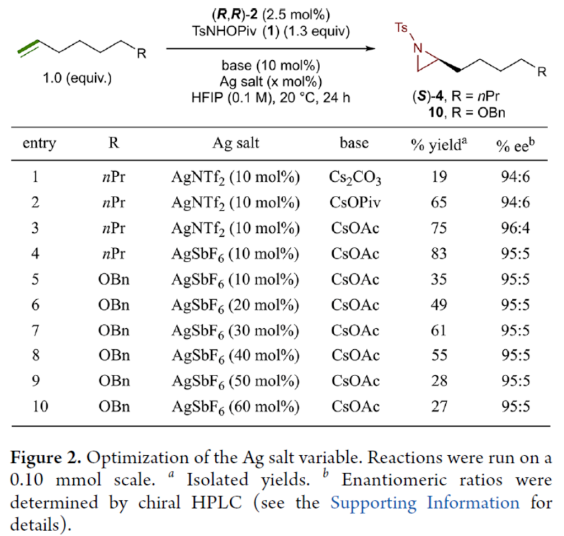
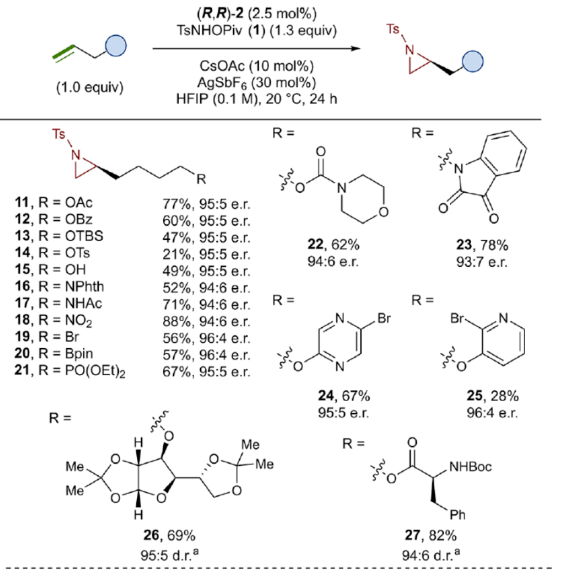
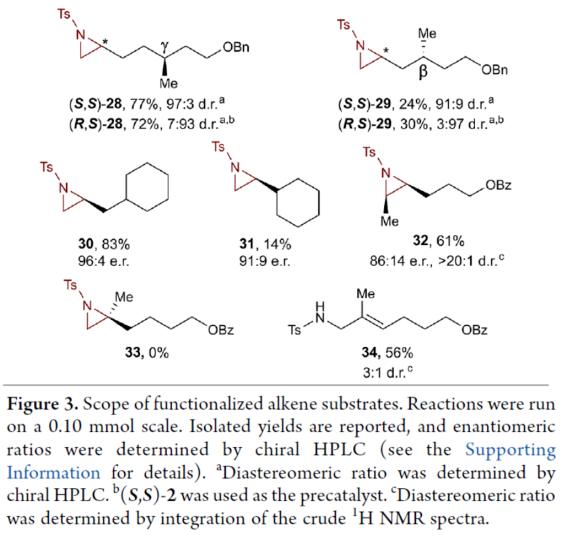
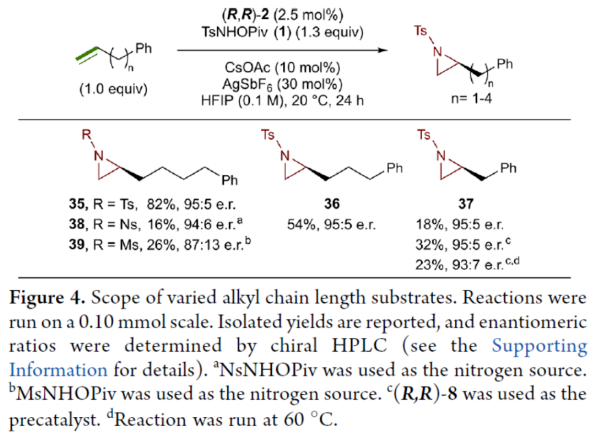
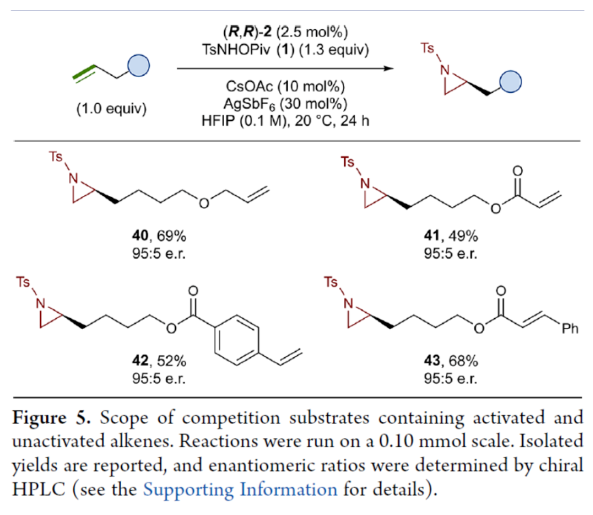
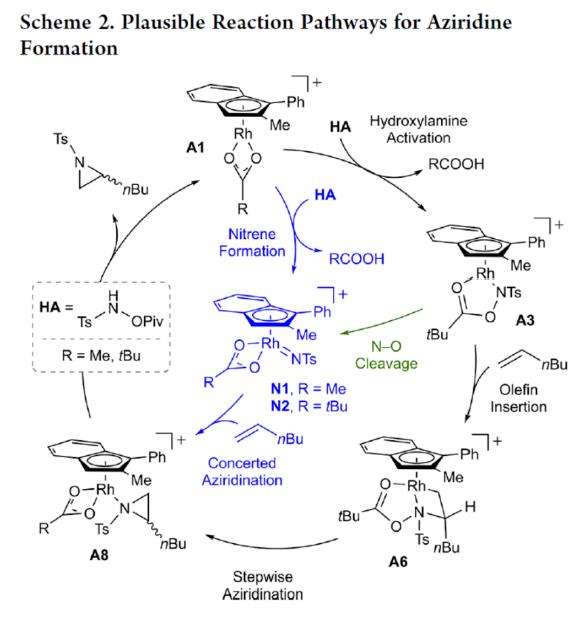
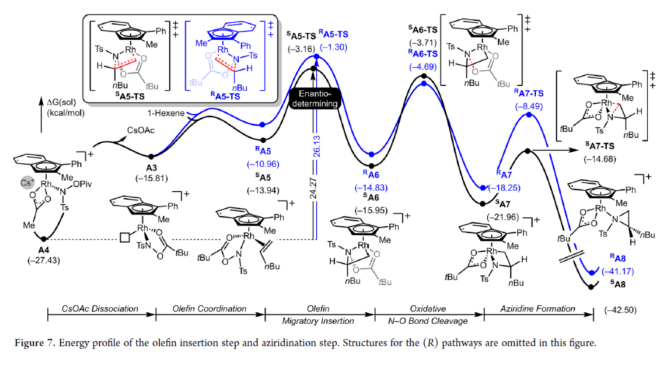
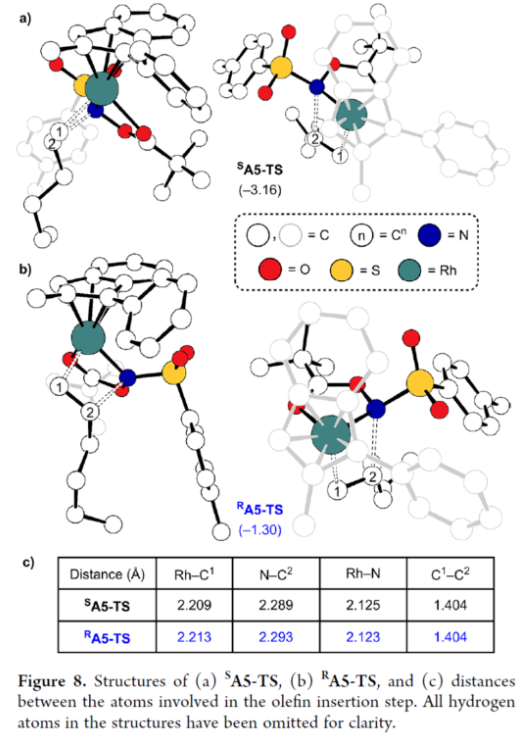
正文 氮杂环丙烷是一种具有价值的张力三元含氮杂环。其立体选择性合成可以通过三种不同的断裂方式来实现:(1)手性卤代胺或氨基醇的分子内缩合,(2)碳源到亚胺的立体选择性加成,(3)氮宾等价物与烯烃的立体选择性加成(最具吸引力)。目前,化学家们还开发了大量通过过渡金属催化立体选择性合成手性氮杂环丙烷的方法。然而,这些方法集中于活化烯烃(如苯乙烯和α,β-不饱和体系)的氮杂环丙烷化反应(Scheme 1a,top)。同时,具有烷基取代的非活化烯烃的立体选择性氮杂环丙烷化反应仍然具有挑战(Scheme 1a,bottom)。目前,仅只有四种方法实现了非活化烯烃的分子间对映选择性氮杂环丙烷化反应(Chem. Commun. 2009, 4266;Chem. Commun.2012, 48, 7188; J. Am. Chem. Soc. 2022, 144, 17156;J. Am. Chem. Soc.2023, 145, 7516.)。然而,上述的方法对于非活化底物通常具有较低的产率和对映选择性。2019年,Rovis课题组(J. Am. Chem. Soc. 2019, 141, 12536.)开发了一种Rh(III)-催化非活化末端烯烃的形式[4+1]环加成反应,合成了一系列吡咯烷的方法(Scheme 1b,top)。2020年,Blakey课题组(J. Am. Chem. Soc. 2020, 142, 13996.)设计一种用于区域与对映选择性烯丙基C-H胺化的平面手性铑茚基催化剂(Scheme 1b,bottom)。受此启发,韩国科学技术院Mu-Hyun Baik与美国埃默里大学Simon B. Blakey课题组报道了一种平面手性铑茚基催化剂促进非活化末端烯烃的对映选择性氮杂环丙烷化反应,合成了一系列对映体富集的手性氮杂环丙烷衍生物(Scheme 1c)。 下载化学加APP到你手机,更加方便,更多收获。 (图片来源:J. Am. Chem. Soc.) 首先,作者对平面手性Rh(III)茚基催化剂(Figure 1)以及反应的条件进行了筛选(Figure 2)。筛选结果表明,当以1-壬烯作为底物,TsNHOPiv(1,1.3 equiv)作为氮源,(R,R)-2(2.5 mol %)作为催化剂,AgSbF6(10 mol %)作为银盐,CsOAc(10 mol %)作为碱,在HFIP溶剂中20 oC反应24 h,可以83%的收率得到产物(S)-4,e.r.为95:5。同时,当以苄基保护的5-己烯-1-醇为底物时,需将银盐的负载量提高至30 mol %,可以61%的收率得到产物10,e.r.为95:5。 (图片来源:J. Am. Chem. Soc.) (图片来源:J. Am. Chem. Soc.) 在获得上述最佳反应条件后,作者对底物范围进行了扩展(Figure 3)。首先,一系列不同取代的末端烯烃底物,均可顺利进行反应,获得相应的产物11-21,收率为21-88%,e.r.为93:7-96:4。其中,烷基卤化物、硼酸酯和膦酸酯等活性的官能团,均与体系兼容。含有更为复杂取代的底物(如吗啉氨基甲酸酯、靛蓝、二嗪和吡啶),均为合适的底物,获得相应的产物22-25,收率为28-78%,e.r.为93:7-96:4。受保护的D-呋喃葡萄糖和L-苯丙氨酸衍生的烯烃底物,也与体系兼容,获得相应的产物26(收率为69%,d.r.为95:5)和27(收率为82%,d.r.为94:6)。其次,L-香茅醇衍生的烯烃,在使用两种不同构型的催化剂时,可分别获得相应的产物(S,S)-28(收率为77%,d.r.为97:3)和(R,S)-28(收率为72%,d.r.为7:93)。同时,将手性中心转移至β-位时,可分别获得相应的产物(S,S)-29(收率为24%,d.r.为91:9)和(R,S)-29(收率为30%,d.r.为3:97)。烯丙基环己烷和乙烯基环己烷,也是合适的底物,分别获得相应的产物30(收率为83%,e.r.为96:4)和31(收率为14%,e.r.为91:9)。此外,Z-二取代的烯烃,可顺利进行反应,获得相应的产物32(收率为41%,e.r.为86:14,d.r.> 20:1)。然而,1,1-二取代烯烃未能有效的进行反应(如33),但可获得末端烯丙基胺产物34(收率为56%,d.r.为 3:1)。 (图片来源:J. Am. Chem. Soc.) 紧接着,作者研究了烷基链长度对反应的影响(Figure 4)。研究发现,碳链长度为4时不会影响反应(如35),但将碳链长度降为3或1时,收率明显下降(如36和37)。值得注意的是,在碳链长度发生变化时,对映选择性不受影响。同时,当使用NsNHOPiv与MsNHOPiv作为氮源时,反应的收率也出现明显的下降,对映选择性略有降低,如38和39。 (图片来源:J. Am. Chem. Soc.) 接下来,作者对同时含有活化与非活化的烯烃底物进行了竞争性反应,用于研究烯烃的电性对于反应的影响(Figure 5)。研究发现,氮杂环丙烷化仅发生在非活化的烯烃上,而活化的烯烃保持完整,从而表明在对映选择性氮杂环丙烷化方法中具有全新的选择性水平。 (图片来源:J. Am. Chem. Soc.) 此外,作者提出了两种合理的催化循环过程(Scheme 2)。第一种机理涉及酰胺的形成以及随后的烯烃插入过程(黑色)。第二种机理涉及氮宾形成(蓝色和绿色)。由于其不切实际的高能量需求,从而排除了烯烃直接进行协同金属化-去质子化(CMD)的可能性。 (图片来源:J. Am. Chem. Soc.) 为了进一步证明上述机理的合理性,作者进行了相关的理论计算研究(Figures 6-8)。首先,羟胺HA与A1的配位生成18-电子的配合物A2。配合物A2经分子内去质子化,生成金属-酰胺配合物A3,并释放乙酸。配合物A3与碱基结合,生成铯-结合配合物A4。值得注意的是,在A4的形成过程中,两个中间体A2和A3有可能形成氮宾中间体N1和N2。然而,由于其所需的高能量表明反应不是通过氮宾中间体进行的。由于A4是饱和状态,它释放CsOAc并生成16-电子配合物A3(Figure 6)。 其次,配合物A3可与烯烃反应,生成配合物A6。由于A3的非对称结构,它为烯烃提供了两个不同的空位,这导致了对映选择性的C−N键的形成(SA5和RA5)。同时,(S)-产物的收率比(R)-产物高19-24倍。并且,发现这种迁移插入(第一个C−N键的形成)在整个催化循环中具有最高的活化能,它可能同时作为对映选择性和速率决定步骤(Figure 7)。值得注意的是,反应的立体选择性源于底物、磺酰胺和催化剂茚基配体上的苯基取代基之间的相互作用。同时,SA5-TS和RA5-TS之间能量差的主要来自空间相互作用(Figure 8a)。 随后,迁移插入后,中间体A6经氧化N−O键断裂,生成中间体A7。利用A7中的缺电子环境作为驱动力,SA7-TS和RA7-TS分别容易形成还原性的C−N键,生成中间体A8。最后,中间体A8通过解离后,生成目标产物,并再生活性催化剂A1,从而完成催化循环的过程。 (图片来源:J. Am. Chem. Soc.) (图片来源:J. Am. Chem. Soc.) (图片来源:J. Am. Chem. Soc.) 总结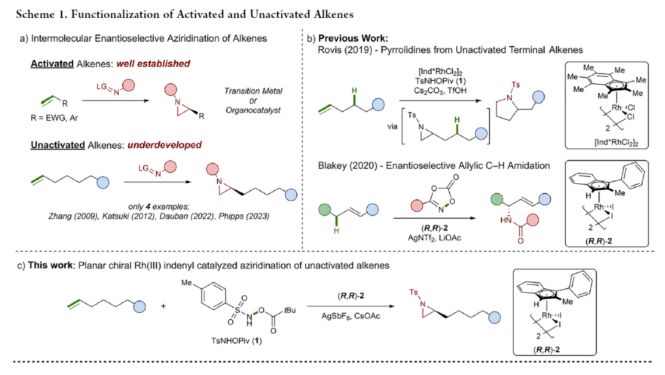

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn