

(图片来源:Nat. Chem.)
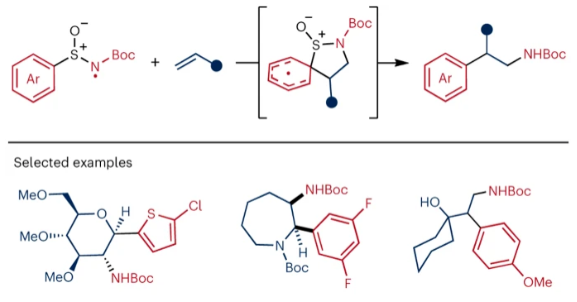
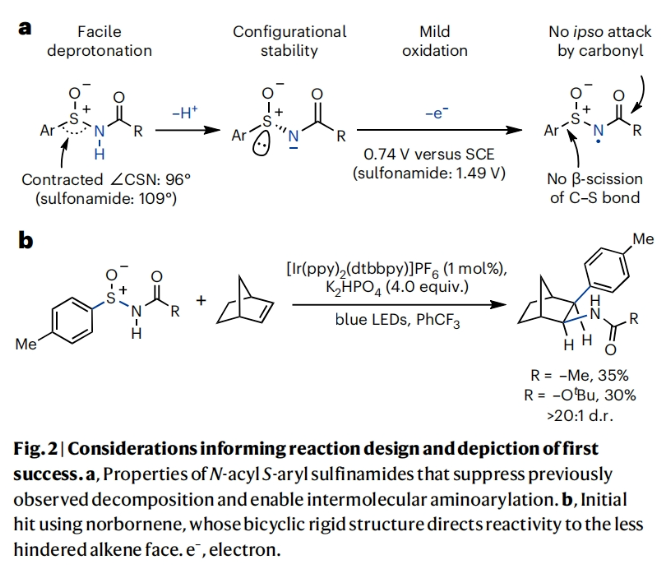
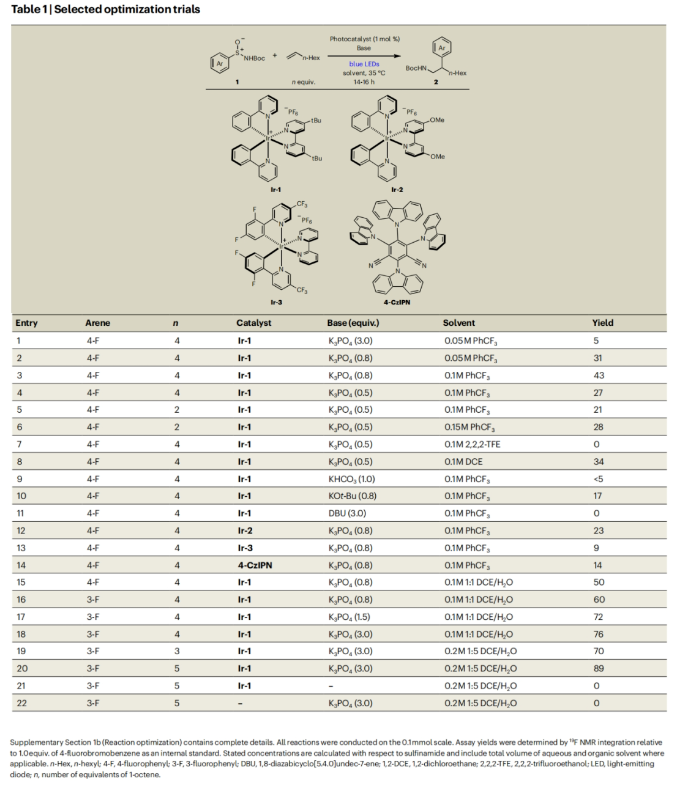
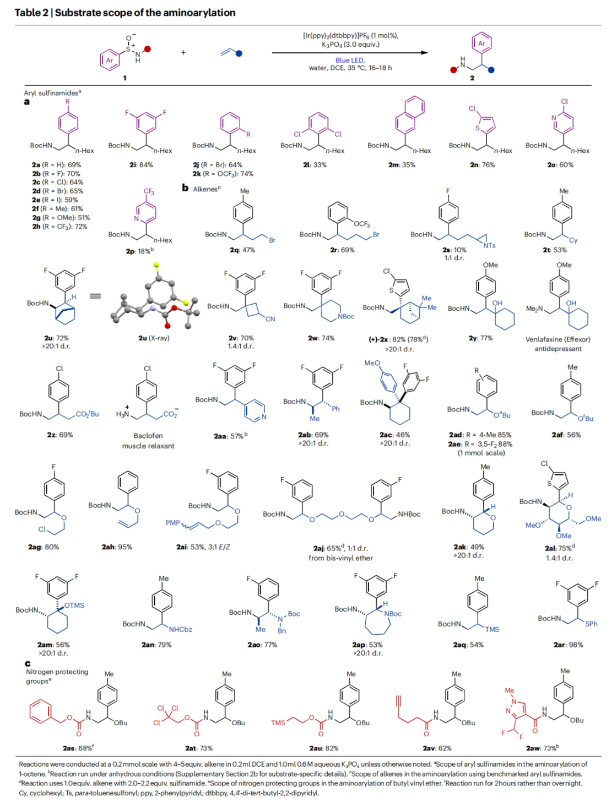
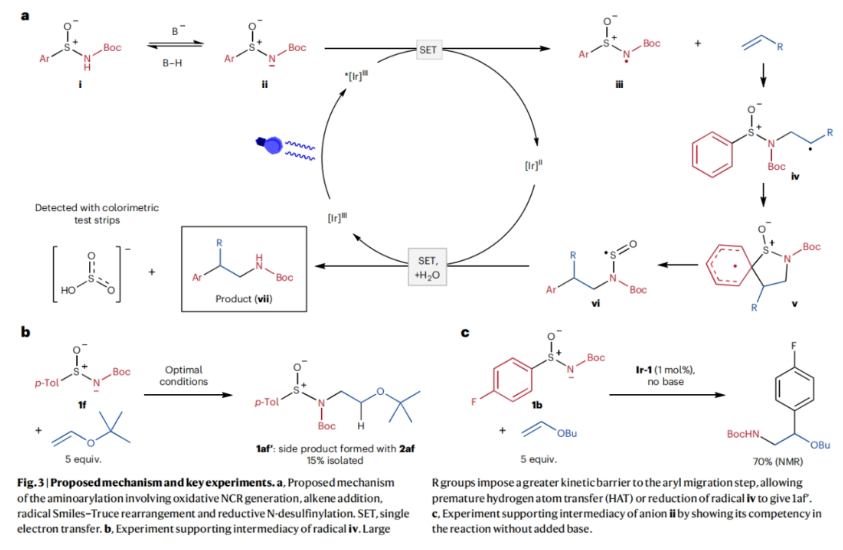
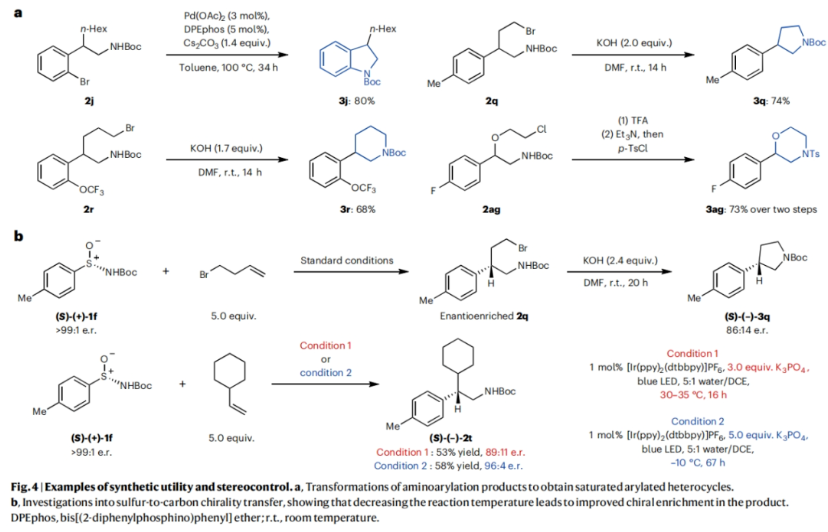
正文 芳基乙胺是生物活性分子中的常见结构单元,但其通常是通过一系列线性合成步骤制备而成。因此,利用烯烃一步模块化实现芳基乙胺的合成具有重要意义(Fig. 1a)。基于Corey R. J. Stephenson课题组对Smile-Truce重排反应的探索(Fig. 1b),最近,美国密西根大学Corey R. J. Stephenson课题组使用芳基亚磺酰胺试剂作为胺和芳烃供体,实现了烯烃的胺芳基化反应(Fig. 1c)。下载化学加APP到你手机,更加方便,更多收获。 (图片来源:Nat. Chem.) 作者推测S-芳基N-酰基亚磺酰胺可以经历连续的质子丢失电子转移(proton loss-electron transfer,SPLET)得到关键的氮自由基(N-centred radical,NCR)。由于形成芳基自由基在热力学上具有挑战性,因此该物种被认为能够抑制β-断裂过程发生。为了验证这一假设,作者对去质子化的亚磺酰胺进行了循环伏安实验,并测量了它的氧化电位,与饱和甘汞电极(SCE)相比,它的氧化电位非常低,仅为0.74 V,与N,N-二甲基苯胺的氧化电位大致相同(Fig. 2a)。与类似的磺胺阴离子相比,亚砜基的氧化电位降低了0.75 V。这一结果表明即使是弱氧化性的光催化剂也能提供所需的亚磺酰胺基NCR。因此,作者将市售的对甲苯亚磺酰胺乙酰化,并在降冰片烯的存在下使用改良的文献条件进行了反应尝试(Fig. 2b)。可以35%的产率成功分离到胺芳基化产物。此外,叔丁氧羰基(Boc)保护的亚磺酰胺也同样兼容转化,在相同的条件下,以30%的产率得到胺芳基化产物。 (图片来源:Nat. Chem.) 随后,作者对反应条件进行了优化,当使用[Ir(ppy)2(dtbbpy)]PF6 (1 mol%), K3PO4 (3.0 equiv),在H2O/DCE中,蓝光照射下35 oC反应16-18小时为最佳(Table 1)。控制实验表明碱和光催化剂再此转化中不可或缺。值得注意的是,在此反应条件下,以烯烃为限制试剂的反应也可成功实现。 (图片来源:Nat. Chem.) 接下来,作者对此转化的底物范围进行了考察(Table 2)。实验结果表明,一系列不同取代的芳基亚磺酰胺与活化和非活化烯烃均可兼容此转化,以10-95%的产率得到相应的芳基乙胺产物2a-2z,2aa-2aw。且产物2u的结构通过X-射线单晶衍射得到了证实。值得注意的是,此转化对一系列生物活性分子骨架如Venlafaxine、Baclofen等均可兼容,证明了此转化的良好兼容性。此外,此转化还可以放大至1.0 mmol规模而产率基本不受影响。 (图片来源:Nat. Chem.) 为了验证作者的SPLET假设,其首先使用亚磺酰胺1n作为分析物进行了Stern-Volmer发光淬灭研究,并观察到光催化剂的激发态并没有淬灭。这一结果为质子化的亚磺酰胺与激发态光催化剂之间的电子转移提供了证据。基于阴离子循环伏安实验数据,作者提出了如Fig. 3a所示的SPLET机理。亚磺酰胺I首先去质子化形成阴离子ii。光催化剂氧化ii生成亚磺酰胺基自由基iii,其与烯烃加成生成自由基加合物iv。为循环伏安法研究而合成的阴离子ii在无碱的条件下仍可以发生胺芳基化反应,可作为去质子化步骤的额外证据(Fig. 3b)。大位阻的烯烃取代基可以足以减缓加合物iv的Smile-Truce重排,从而实现被还原的光催化剂所还原(例如从叔丁基乙烯基醚的反应中分离出氢胺化产物1af’)(Fig. 3c)。否则,自由基iv可能会经历Smile-Truce重排以及螺环中间体(如v)的去芳构化。再次芳构化驱动C-S键均裂产生N-亚磺酰基自由基vi,其可以经历直接均裂或被还原的光催化剂还原裂解得到SO和相应的酰胺基自由基或阴离子。或者,自由基vi可以在S-N键断裂之前被还原和水解,这样就不会形成游离SO气体。 为了证明此转化的实用性,作者将将合成出的芳基乙胺产物转化为饱和氮杂环(Fig. 4a)。产物2j中的邻溴取代基可以通过分子内钯催化的C-N偶联反应以80%的产率合成吲哚啉产物3j。烷基溴2q和2r可以分别经历环化以74%和68%的产率得到吡咯烷产物3q和哌啶产物3r。在相同的条件下,烷基氯2ag不能直接环化,而是需要对其进行脱Boc保护得到游离胺后再环化。环化后通过原位对甲苯磺酰基化可有助于分离2-芳基吗啡啉产物3ag(73%)。 最后,基于文献报道,作者希望将硫手性转移到芳基乙胺产物中新构建的碳立体中心上。作者利用商业可得的Davis亚磺酰胺合成了(S)-(+)-1f,并将其用于4-溴-1-丁烯的胺芳基化反应。得到的对映体富集产物2q通过环化得到吡咯烷产物(S)-(-)-3q,且由手性超临界流体色谱测定其对映体比(er)为86:14(Fig. 4b)。这一结果鼓励作者要进一步完善决定对映体选择性的因素。通过乙烯基环己烷的胺芳基化反应可以以53%的产率得到产物(S)-(-)-2t(89:11 er)。尽管其存在一个较大位阻的叔碳取代基,但其对映选择性结果与(S)-(-)-3q类似。然而,当将乙烯基环己烷在-10 oC下进行相同的胺芳基化反应时,可以以58%的产率,96:4 er得到(S)-(-)-2t。因此,降低温度是一种方便的方法来提高这种转化的对映选择性。 (图片来源:Nat. Chem.) 总结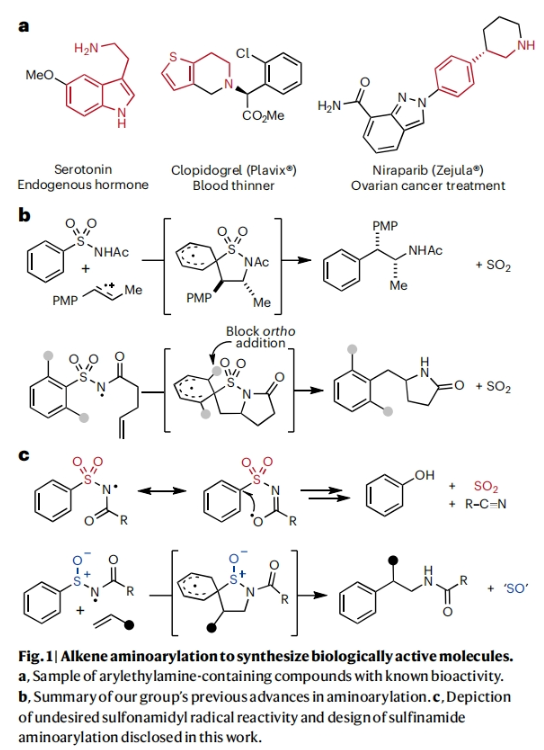
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn