

(图片来源:Nature)
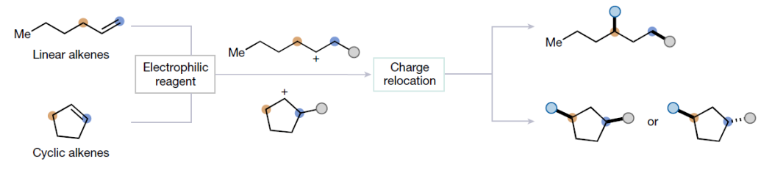
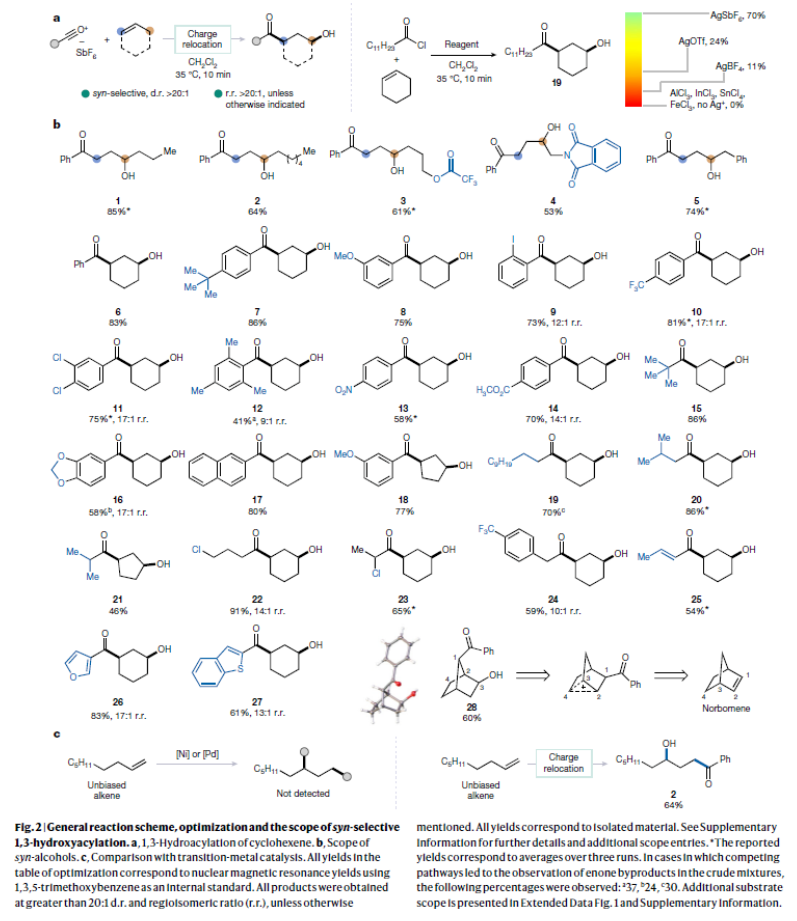
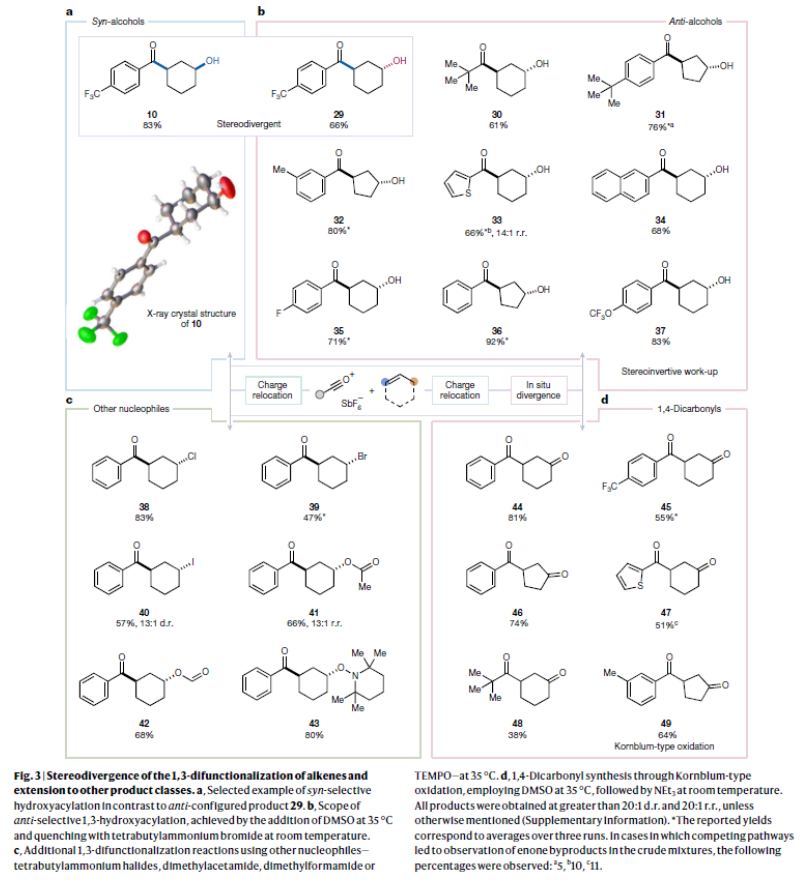
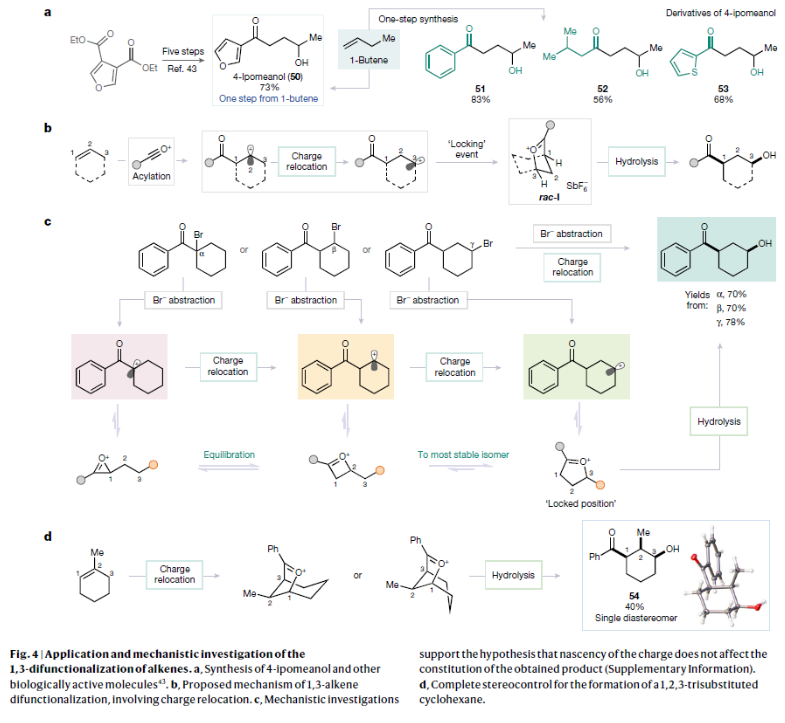
正文 烯烃的官能团化反应是每位本科生在化学学习过程中的重要内容,其可以大致分为两类:1)临时(烯烃复分解)或永久(臭氧分解)C=C键断裂的转化;2)产物保持原始C-C σ键连接的转化。在后者中,1,2-双官能化反应包括从经典的卤化反应到复杂的过渡金属催化反应。近些年,化学家们实现了远程官能团化反应。目前,文献中出现了许多利用过渡金属催化实现烯烃1,3-双官能化反应的例子。此类方法总是依赖于导向基团或“stopper”来实现区域选择性(Fig. 1a)。同样,烯烃的Friedel–Crafts类型反应也得到了广泛的探索(Fig. 1b)。但化学家们对控制这种转化的选择性或可预测性的因素知之甚少,而非活化和非官能团化烯烃的直接1,3-双官能团化仍是一个未解决的挑战。最近,奥地利维也纳大学Nuno Maulide课题组发展了一种基于“电荷重定位”概念的烯烃1,3-双官能团化反应。该转化利用非活化烯烃,在不需要导向基团的情况下,以立体发散的方式分别获得了顺式或反式构象的1,3-双官能团化产物(Fig. 1c)。下载化学加APP到你手机,收获更多商业合作机会。 (图片来源:Nature) 通过一系列尝试,作者发现使用环己烯与酰氯和六氟锑酸银原位生成的酰基正离子反应,通过水解可以选择性地形成相应的1,3-羟酰基化产物。随后,作者探索了此转化的底物范围(Fig. 2b),一系列线性烯烃在一系列链长范围展现出良好的收率(1, 85%和2, 64%)。此外,一系列官能团也可以兼容,以良好的收率得到相应的三氟乙酸酯(3, 61%)或邻苯二胺(4, 53%)产物。值得注意的是,使用4-苯基-1-丁烯(由于苄基存在而具有潜在偏倚的底物)时也仅得到了1,3-双官能团化产物5(74%),而苄位保持不变。此外,各种芳烃取代的酰基离子,无论其电性或空间位阻如何,均可得到相应的产物7-17(41-86%)。对于环戊烯衍生的酮醇18以及由脂肪族酰基离子加成所得的产物19-24也均观察到了相同的立体化学结果。值得注意的是,丙烯酰基衍生的酰基离子也以54%的产率得到目标产物25,且带有杂芳基的产物26(83%)和27(61%)也是如此。最后,当使用降冰片烯反应时,中间形成的带正电物种通过重排,以60%的产率得到28。 Fig. 2c展示了该方法与先前报道的方法分别实现烯烃的1,3-双官能团化比较。当使用1-壬烯为底物反应时,在镍或钯催化条件下并没有得到1,3-双官能团化产物,仅观察到Heck偶联产物或分解的产物。相比之下,利用此方法本可以以64%的分离产率得到1,3-双官能团化产物2。 (图片来源:Nature) 在随后的研究中,作者发现如果在后处理之前加入二甲基亚砜(DMSO),则可以以良好的立体选择性得到相应的反式-羟酰基化产物29-37(通常大于20:1 dr),从而能够以立体发散的方式实现任何一种异构体的合成(Fig. 3)。当在体系正弘加入其它亲核源如氯化物(38)、溴化物(39)或碘化物(40)时可以以47-83%的产率得到反式卤化产物38-40。有趣的是,当加入N,N-二甲基乙酰胺或甲酰胺等酰胺时,可以分别以66%和68%的产率得到反式酰氧基酰化产物41和42。更有趣的是,加入TEMPO时可以以80%的产率得到43。值得注意的是,当加入DMSO后再用三乙胺处理,可以以38-81%的产率得到1,3-酮酰化反应产物44-49。这也是首次实现了将简单烯烃转化为1,4-二羰基化合物。 (图片来源:Nature) 为了探索此1,3-双官能化反应的实用性,作者探索了其潜在的合成应用。4-ipomeanol (50)是一种具有蛋白质结合活性(N-乙酰半胱氨酸和N-乙酰赖氨酸)的肺原毒素,据报道其需要经历五步才能合成出来(Fig. 4a)。而利用作者所发展的烯烃1,3-双官能化反应可以从廉价的1-丁烯一步直接实现该化合物的合成。此外,利用此方法还可以实现其苯基类似物51(83%)和其它衍生物52(56%)和53(68%)的合成。从机理的角度来看(Fig. 4b),作者认为上述1,3-双官能化反应的实现是通过快速的异构化。在热力学控制下,亲电加成所形成的第一个中间体β-酮阳离子转化为重排的环氧碳正离子rac-I,而rac-I的形成可以防止进一步异构化和非选择性产物的形成。随后,这种中间体以水解方式(顺式构型产物)或者通过与其它亲核试剂在取代反应形成反式构型产物。 Fig. 4c所展示的机理实验可以很好的证明“电荷重定位”的概念。作者发现无论碳正离子最初是在哪里形成的,绝大多数起始原料均可以转化为预期的1,3-双官能化产物。即碳正离子被迁移到γ位,与它的生成状态无关。 (图片来源:Nature) 总结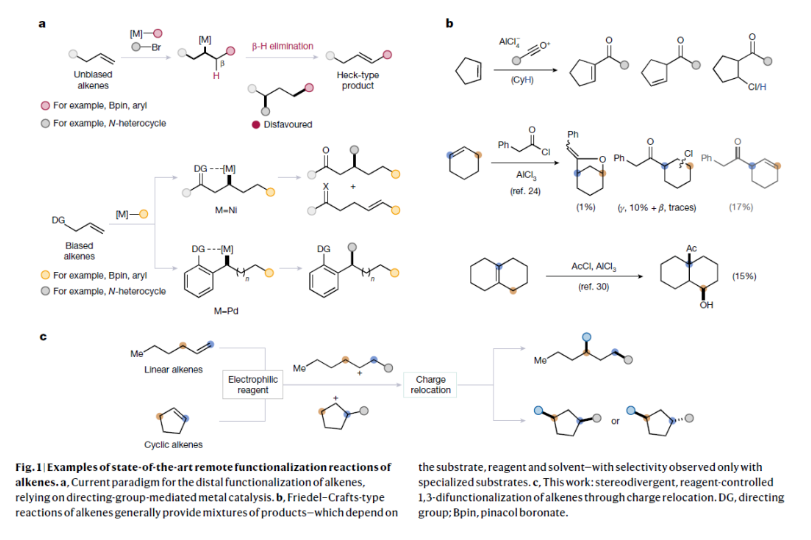
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn