

(图片来源:Science)
正文
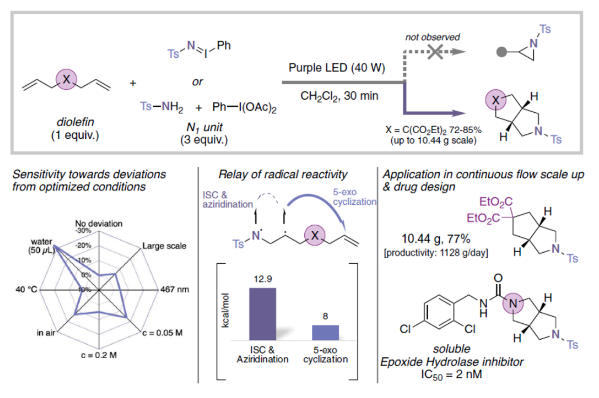
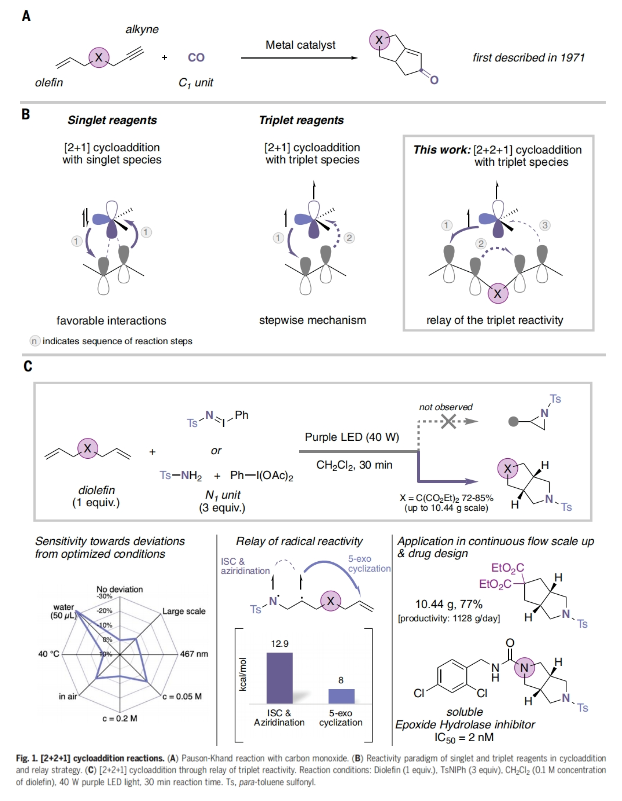
环加成反应是有机合成化学的基础。在一系列复杂的环加成反应中,钴催化的[2+2+1]环加成反应或Pauson-Khand反应最为突出。自1971年发现以来的50多年里,Pauson-Khand反应仍然是利用两个不饱和键和一个C1片段,通过环加成反应构建环戊烯酮的少数例子之一(Fig. 1A)。尽管Pauson-Khand反应得到了化学家们的广泛使用,但它基本上仅限于使用一氧化碳作为C1片段。虽然利用N1片段取代C1片段可以实现吡咯烷型氮杂环的合成。但此过程仍然极具挑战性,因为竞争性的[2+1]环加成反应会生成氮杂环丙烷副产物。最近,德国亚琛工业大学Rene M. Koenigs课题组报道了光催化,利用乃春作为N1片段的Pauson-Khand类型反应,实现了哌啶、吗啡啉和哌嗪等一系列常见饱和杂环的双环生物电子等排体的合成(Fig. 1B)(Fig. 1C)。下载化学加APP到你手机,收获更多商业合作机会。。
首先,作者以双烯丙基丙二酸二乙酯1作为底物,iminoiodinane 2作为N1合成子,二氯甲烷作溶剂,紫光照射下反应30 min,可以以85%的产率得到相应的双环产物3。值得注意的是,此转化可以放大至10 mmol规模合成。此外,作者通过对粗反应混合物进行核磁分析,并未观察氮杂环丙烷化副产物的生成,这支持三线态乃春的双自由基性质传递到了π-体系中的假设(Fig. 1C)。
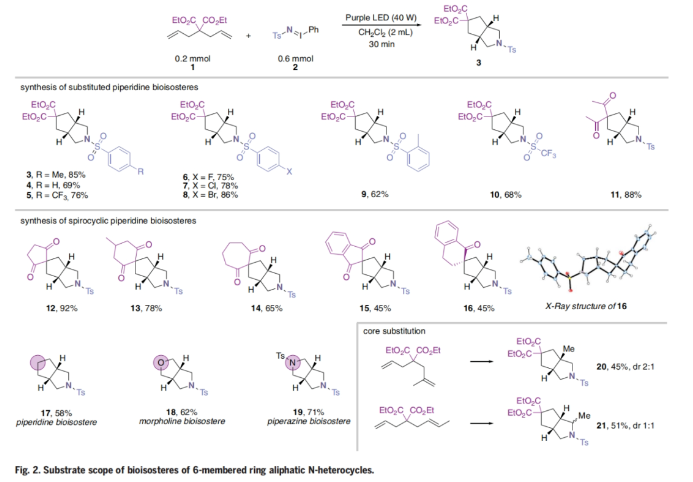
随后,作者对此转化的底物范围进行了考察(Fig. 2)。不同的iodinane试剂可以与双烯丙基丙二酸二乙酯和3,3-二烯丙基戊烷-2,4-二酮反应,以62-88%的产率得到相应的芳基磺酰基保护的3-氮杂双环[3.3.0]-辛烷衍生物3-11。此外,环状二烯丙基化合物在最优条件下反应,也可以以65-92%的产率得到相应2-氮杂双环-[3.3.0]-辛烷螺环衍生物12-14的合成。然而,苯并环的引入导致了产物15和16的产率轻微降低(45%)。随后,作者尝试了庚-1,6-二烯、二烯丙基醚和Ts保护的二烯丙基胺的[2+2+1]环加成反应。利用该反应可以直接实现哌啶、吗啡啉和哌嗪生物电子等排体的合成。实验结果表明这些转化均可顺利进行,以58-71%的产率得到相应的Ts保护的双环化合物17-19。此外,不同的烯烃取代也具有良好的兼容性,以45-51%的产率得到相应的2-氮杂双环-[3.3.0]-辛烷产物20-21。在这两种情况下,环化产物的非对映体比例均大幅下降,作者认为这与初始乃春加成步骤中两个烯烃单元之间的差异较小有关。
(图片来源:Science)
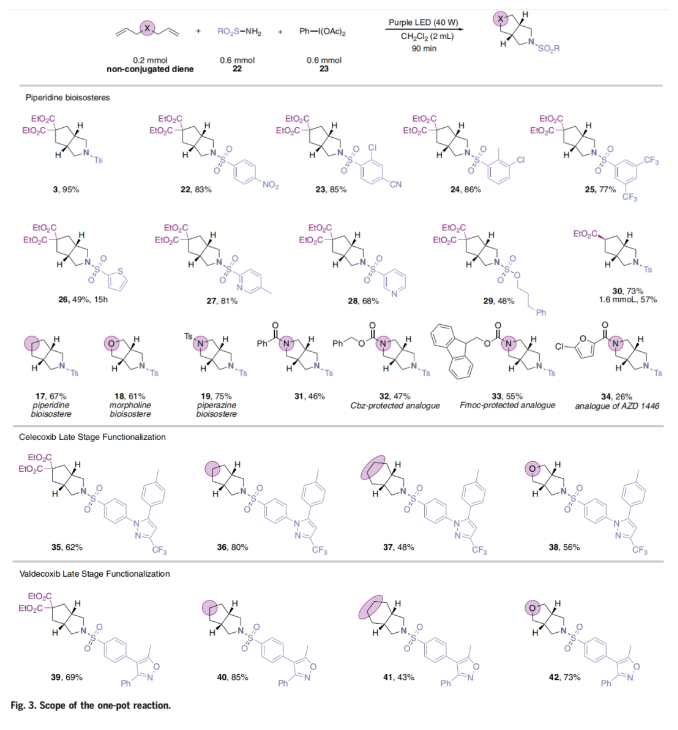
接下来,为了避免iodinane试剂的分离,作者探索了一锅法反应策略(Fig. 3)。实验结果表明,一系列磺酰胺(包括硝基取代的芳基磺酰胺,邻位取代的芳基磺酰胺,杂芳基取代的芳基磺酰胺,氨基磺酸盐)均可兼容,以48-95%的产率得到取代的哌啶生物电子等排体3, 22-30。此外,此三组分反应策略还可以实现吗啡啉和哌嗪生物电子等排体17-19的合成(61-75%)。重要的是,具有两个氮保护基的哌嗪31-33也可以在一步中以46-55%的产率获得。此外,作者还可以一步以26%的产率合成AZD-1446前体34。值得注意的是,药物分子Celecoxib和Valdecoxib均可以经历高效的[2+2+1]环加成反应(35-42),一步在药物分子中高效引入氮杂环生物电子等排体。
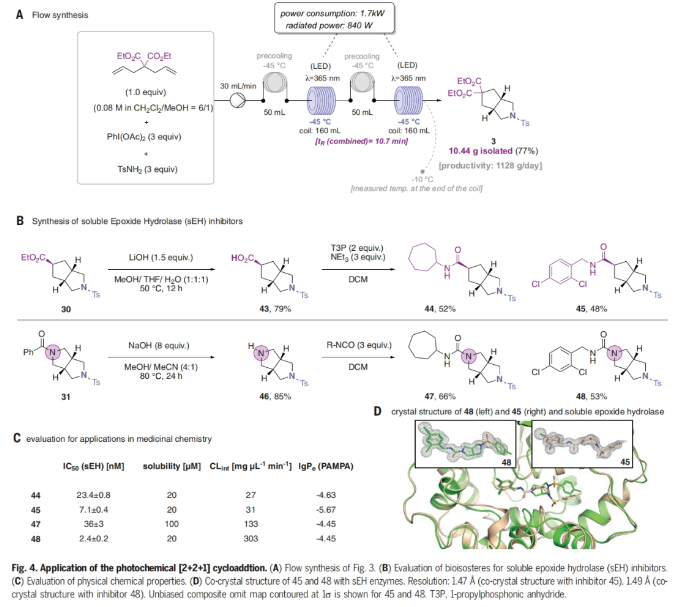
在成功实现六元环脂肪族杂环生物电子等排体的克级规模合成后,作者接下来将注意力转向流动化学以扩大合成规模(Fig. 4)。当使用二氯甲烷和甲醇混合溶剂时,可以有效解决流动化学中所面临的溶解度问题。为了实现流动合成,作者使用了两个光反应器(每个体积160 mL, 840WLED, 365 nm,流速30 mL min-1),且每个光反应器都配备了预冷装置,以减少反应混合物的非必要加热。当作者使用所有三种试剂的0.08 M预混溶液反应时,能够产生10.44 g (77%)的3-氮杂双环-[3.3.0]-辛烷3,相当于每天 > 1.1 kg的生产力(Fig. 4A)。为了评估3-氮杂双环-[3.3.0]-辛烷作为生物电子等排体的功效,作者将该结构骨架引入到sEH抑制剂的药效团中(Fig. 4B),并对其在药物化学中的应用进行了研究(Fig. 4C)。实验结果表明,3-氮杂-双环-[3.3.0]-辛烷可以作为药物化学的有用组成部分。
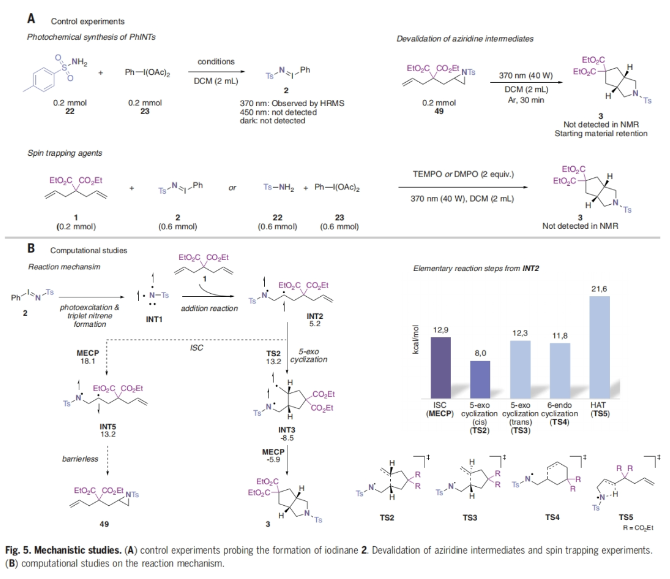
最后,作者对此转化的反应机理进行了探索(Fig. 5)。通过一系列控制实验(Fig. 5A),作者得出:1)自由基捕获实验表明反应中涉及自由基中间体;2)体系需要近紫外光来启动三组分反应;3)假定的氮杂环丙烷中间体在反应条件下很稳定且并没有经历开环。接下来,作者通过计算推测出此过程的反应机理(Fig. 5B)。从三线态乃春INT1开始,作者计算出烯烃单元末端碳的加成反应有利于得到INT2, 且INT2仍处于三线态。从这个三线态中间体可以产生四个不同的基元反应步骤:1)系统间交叉可导致氮杂环丙烷产物49的形成,但该转化的最小能量交叉点为12.9 kcal mol−1;2)5-exo-trig环化过程发生,其碳中心自由基与邻近的烯烃单元中的近端碳原子相连,形成一个三线态中间体,得到顺式构型的INT-3(活化能为8.0 kcal mol−1)或通过TS3形成反式构型的中间体(活化能为12.3 kcal mol−1);3)通过6-endo环化得到六元环中间体;4)通过氢原子转移形成烯酰胺。综上所述,初始加合物INT2在系统间交叉的高能垒抑制了三线态活性的传递,从而有利于5-exo-trig环化,并促进了[2+2+1]环加成过程,实现了3-氮杂双环-[3.3.0]-辛烷3骨架的形成。
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn