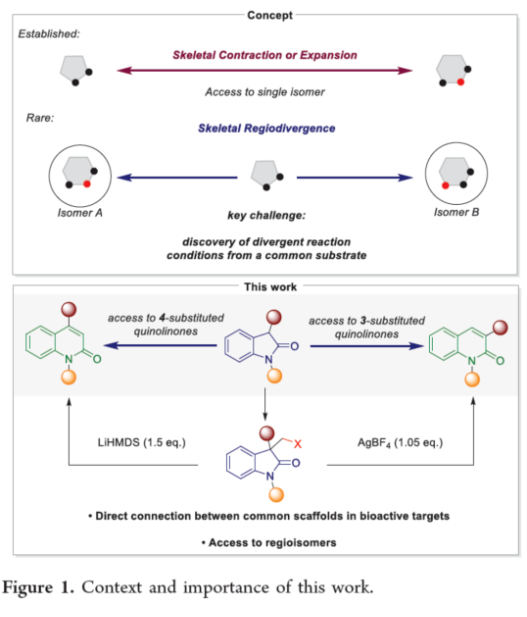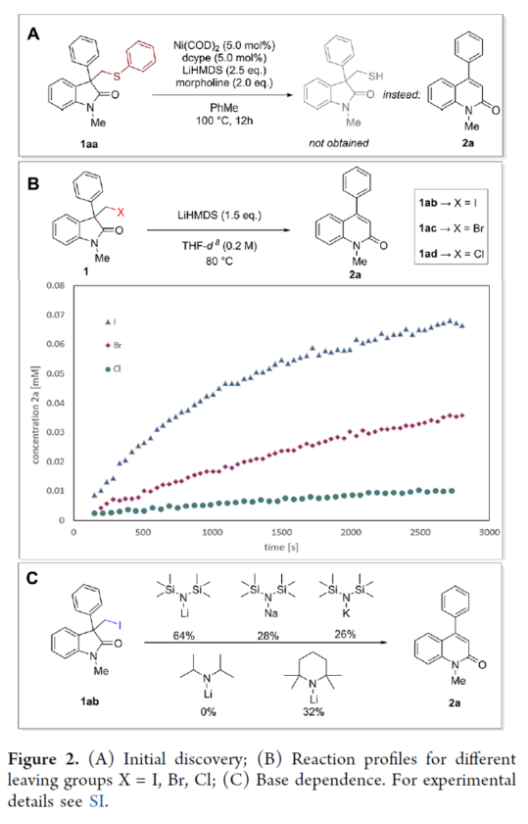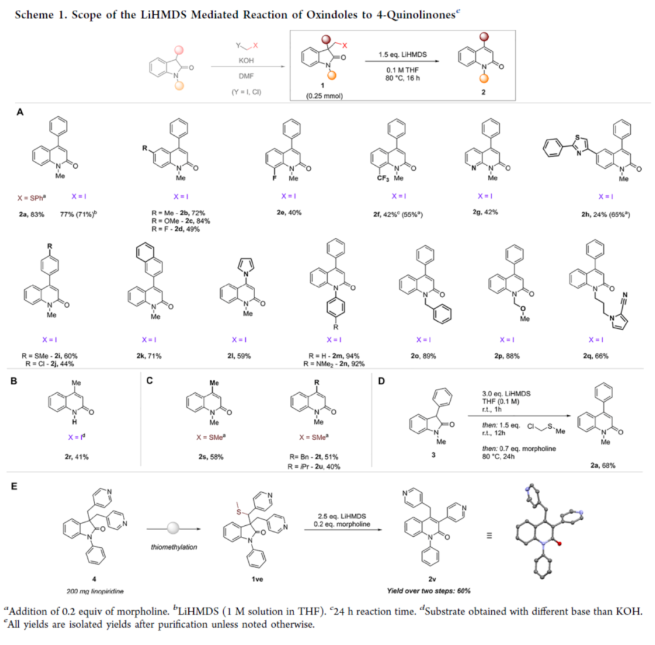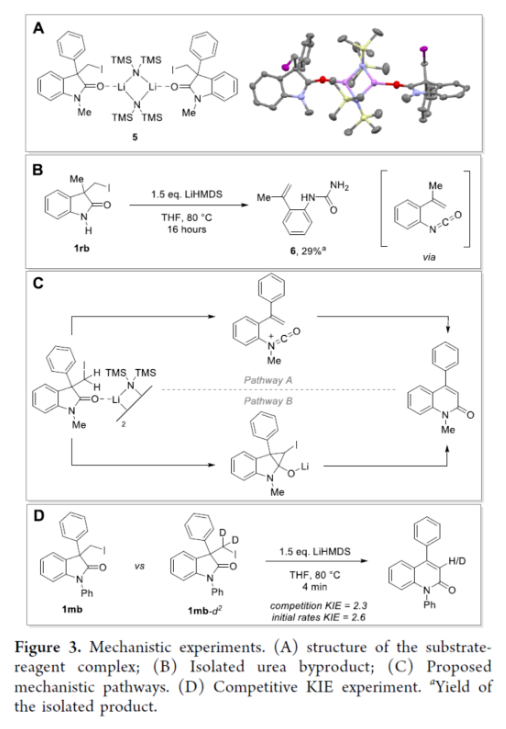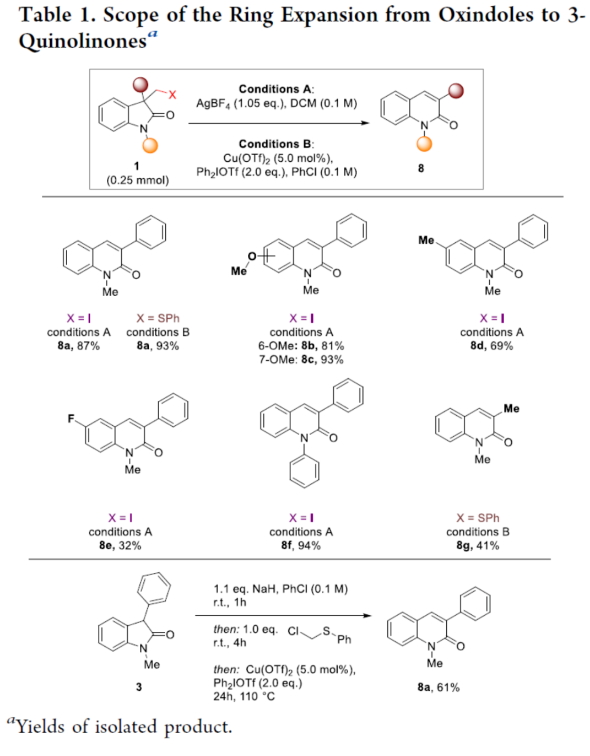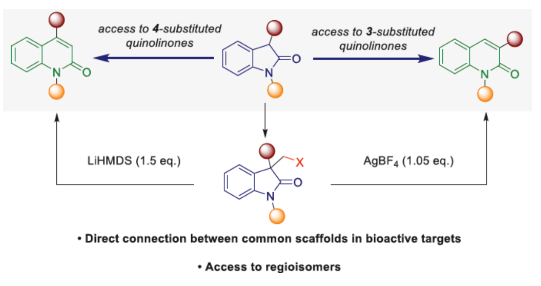
近年来,直接编辑核心骨架的新方法,如切割和缝合(cut-and-sew),以及骨架编辑策略,备受关注。然而,许多生物活性骨架目前不适合这种骨架的修饰,因此仍需开发一种更为高效的方法。到目前为止,除了经典的氮插入外,只有很少的方法可以选择性地获得骨架区域异构体。下载化学加APP到你手机,收获更多商业合作机会。羟吲哚和喹啉酮骨架是两种特殊的药物结构单元,这两种结构都有大量的衍生物可用于各种治疗用途,从治疗细菌感染到抗病毒应用和癌症治疗。因此,建立一种将羟吲哚转化为喹啉酮的直接合成途径,具有鉴定新型生物活性化合物的潜力。如果可以从常见的羟吲哚起始底物中直接获得喹啉酮的区域异构体,从而进一步简化结构-活性关系研究,那么这种分子多样化策略将特别有吸引力。前期,将羟吲哚转化为喹啉酮的尝试仅限于含有强吸电子基团的底物或其他特定的起始底物,从而限制了喹啉酮产物的多样性。同时,对于通过简单的C1插入从相同的起始底物选择性地获得结构不同的喹啉酮的方法,仍有待进一步的探索。近日,苏黎世联邦理工学院Bill Morandi课题组开发了一种羟吲哚的区域发散性扩环反应,分别合成了一系列3-或4-取代的喹啉酮衍生物(Figure 1)。前期,Bill Morandi课题组(ACS Catal. 2022, 12, 6081.)研究发现,在镍催化羟吲哚1aa的转移胺化后,可获得4-取代的喹啉酮2a,而不是游离的硫醇(Figure 2A)。进一步的研究发现,仅需LiHMDS和催化量的吗啉即可实现这种无过渡金属的转化。同时,在未添加吗啉的情况下,也可以观察到相同的反应性,这进一步增加了该工艺的合成吸引力。其次,离去基团的性质在这种转化中起着重要作用(Figure 2B)。进一步的对照反应表明,HMDS碱基对实现所需的扩环反应至关重要,其中Li代表了优越的抗衡离子(Figure 2C)。在进一步优化反应条件后发现(see SI,Table S1),当以3-碘甲基羟吲哚1ab为底物,LiHMDS(1.5 equiv)作为碱,在THF溶剂中80 oC反应16 h,可以77%的收率得到产物2a。在获得上述最佳反应条件后,作者对合成4-取代喹啉酮衍生物的底物范围进行了扩展(Scheme 1)。首先,羟吲哚底物的芳基上含有不同电性取代基以及杂环衍生物时,均可顺利进行反应,获得相应的产物2a-2h,收率为40-84%。3-取代的羟吲哚以及羟吲哚的酰胺氮上含有不同的取代基时,均与体系兼容,获得相应的产物2i-2q,收率为44-94%(Scheme 1A)。然而,3-烷基取代的羟吲哚仅导致起始底物发生脱碘(Scheme 1B)。其次,使用-SMe代替-I的羟吲哚,也是合适的底物,获得相应的产物2s-2u,收率为40-58%(Scheme 1C)。值得注意的是,与之前的多步合成2a的反应相比,该策略具有简单性和适用性(Scheme 1D)。此外,该策略还可用于小分子药物利诺吡啶(4)的后期修饰,可以两步60%的总收率得到二取代喹啉酮产物2v(Scheme 1E)。紧接着,作者对反应的机理进行了研究(Figure 3)。首先,通过对底物-试剂配合物5之间的分子间相互作用分析发现,所使用的碱与底物中的羰基氧配位。锂碱和酰胺的类似相互作用也很突出,它们利用这种相互作用活化酰胺部分,从而实现随后的亲核进攻或去质子化(Figure 3A)。同时,在N−H羟吲哚1rb的反应中,成功分离了一种尿素衍生物6(Figure 3B)。从机理上讲,这种副产物可以通过去质子化后分子内消除串联反应形成异氰酸酯中间体来解释。随后,通过环化从而获得所需产物。或者,在副反应中,异氰酸酯中间体可以被LiHMDS亲核进攻,然后在后处理中水解,从而解释所观察到的尿素的形成。基于上述的研究,作者提出了一种合理的反应机理(Figure 3C)。在pathway A中,涉及形成一种高能的阳离子异氰酸酯中间体的过程。在pathway B中,涉及形成一种环丙基醇化物中间体的过程。为了区分这两种反应的机理,作者进行了相关的对照实验。在阳离子异氰酸酯中间体的情况下,LiHMDS必须以Lewis酸的形式与酰胺结合,以使C2−C3键能够相应地断裂。然而,由于没有其他更常见的Lewis酸能够实现所需的反应性,并且Hammett分析没有表明氮上有正电荷积聚,因此这种机理似乎不太可能。竞争性的KIE实验结果表明,C−H键的断裂是决速步骤(Figure 3D)。此外,通过对反应条件的再次优化后发现,当在AgBF4/DCM或Cu(OTf)2/ Ph2IOTf/PhCl条件下,一系列不同取代的羟吲哚底物,均可顺利反应,获得相应的3-取代喹啉酮产物8a-8g,收率为32-94%(Table 1)。同时,与之前的合成8a的多步反应相比,该策略的操作更为简单与高效。最后,作者对反应的实用性进行了研究(Scheme 2)。首先,多拉西坦(Doliracetam)衍生物9经两步反应,可分别以64%的总收率得到4-取代的喹啉酮化合物2w,以43%的总收率得到3-取代的喹啉酮化合物8h。其次,YWI92(10,一种由3-羟基-3-取代的羟吲哚组成的癫痫抑制剂)经三步反应,可分别以53%的总收率得到4-取代的喹啉酮化合物2x,以78%的总收率得到3-取代的喹啉酮化合物8i。此外,以1yb为底物,可直接合成替吡法尼类似物(Tipifarnib)2y,收率为79%,这也是其最短的合成路线。苏黎世联邦理工学院Bill Morandi课题组开发了一种全新的方法,通过区域发散性骨架的编辑实现了羟吲哚至3-或4-取代的喹啉酮衍生物的转化。同时,该方法在生物活性羟吲哚的后期官能团化反应中具有出色的兼容性,并适用于喹啉衍生物的合成。文献详情:
Hendrik L. Schmitt, Den Martymianov, Ori Green, Tristan Delcaillau, Young Seo Park Kim, Bill Morandi*. Regiodivergent Ring-Expansion of Oxindoles to Quinolinones. J. Am. Chem. Soc. 2024, https://doi.org/10.1021/jacs.3c12119