

2-氮杂双环[3.1.0]己烷骨架因其独特的结构优势,广泛应用在药物分子、生物活性分子以及有机合成领域,其中三元环的存在可以降低分子的亲脂性以及调节N-中心的碱性。目前这类骨架的合成主要方法有Simmons-Smith环丙烷化、Kulinkovich环丙烷化、钯催化分子内碳氢活化、以及分子内环异构化实现。但这些多数都集中在其消旋体的构建,以及N上通常需要保护。
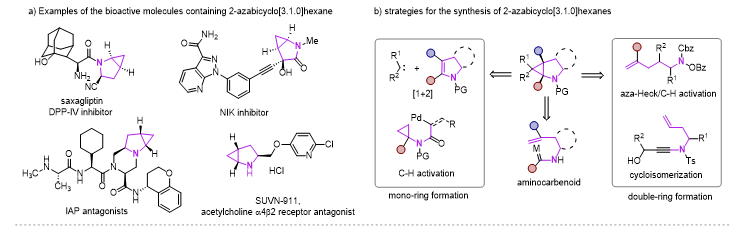
图1 2-氮杂双环[3.1.0]己烷化合物的应用及合成方法
近年来,Cu-H催化的烯烃的1,2-氢官能化反应取得了飞速的发展,尤其是在对映选择性氢胺基化领域,Buchwald课题组做了开创性的并且系统性的工作 (Acc. Chem. Res. 2020, 53, 1229−1243)。但是与此形成鲜明对比的是,Cu-H催化的异腈的1,1-氢官能化反应模式相对单一,这主要是由于形成的甲酰亚胺铜中间体是亲核性的,只能发生亲核取代和亲核加成反应。在此前的报道中,一些过渡金属诸如Ni,Co,很容易与异腈配位形成亚胺金属络合物。在酸性条件下,这类物种更倾向于异构形成一类新型的氨基金属卡宾(Organometallics., 2003, 22, 2817−2819; Organometallics., 2021, 40, 968−978),但这类物种活性尚未被广泛研究。
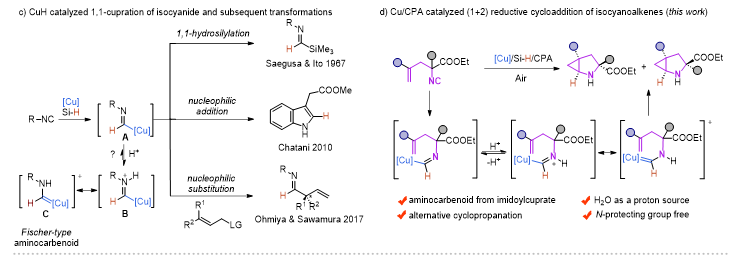
图2 实验设计
受此启发,朱强/罗爽课题组设计了在铜/手性磷酸催化下,硅烷插入异腈形成的甲酰亚胺铜(I)物种可以有效地异构形成α-氨基卡宾铜中间体,随后与分子内烯烃发成(1+2)环加成反应,从而构建含一系列含N−H的2-氮杂双环[3.1.0]己烷化合物。
最初,在铜和手性配体的催化条件下,仅使用叔丁醇做质子源,反应效率非常低,而加入手性磷酸后,反应效率则大大提升。随后在以(R)-C13为最优磷酸下,以1-1为模型底物,Cu(OAc)2·H2O(10 mol%)为催化剂,PhSiH3(3.0 equiv)为氢负来源,PPh3(20 mol%)为添加剂,H2O(3.0 equiv)为质子源时,可以94:6 er,90%的产率获得产物2-1(entry 1)。后续对该反应参数进行了微调,其中铜催化剂和硅烷是必需的(entry 2-3),手性磷酸缺乏会大大降低产率(entry 4),改变质子源和添加剂的当量会略微降低反应的对映选择性(entry 5-7)。此外,当在空气中进行反应时,对映选择性可提高至95:5 er,收率仍可继续保持。这表明了该反应的非凡实用性(entry 8)。相反,在Cu-H催化的烯烃的氢官能化反应中通常需要在手套箱中进行,严格控制无氧和无水条件。
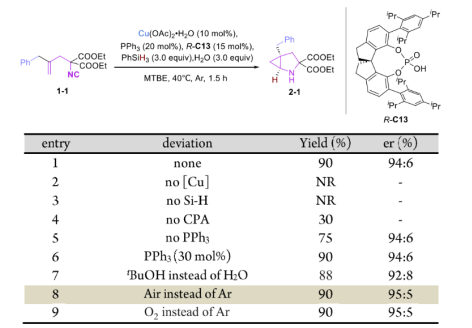
图3 条件筛选
在最佳条件下,作者首先研究了含有α,α-二乙酯(COOEt)的各种烯基异腈的底物适用性。总体来说,在最优的反应条件下,绝大多数底物在此反应体系中兼容性较好,以良好至优异的产率和较好的对映选择性得到相应的目标产物。除了苄基,对其他端烯取代基诸如H、Me、Ph和 (CH2)2Ph等进行了探索,仍能以良好的产率形成相应的产物2-(15−18),但这些底物的对映选择性均有所下降。重要的是,除了二取代的端烯之外,环戊烯和环己烯取代的α,α-二乙酯异腈也可顺利的进行反应,并以良好的产率和对映选择性获得了氮杂三环产物2−19和2−20。接下来,一些具有对称的烯丙基取代的异腈底物也被探索,在标准条件下,一系列具有烯丙基取代的2-氮杂双环[3.1.0]己烷2-(21-23)可以优异的收率、对映选择性以及非对映选择性被获得。其中烯丙基的存在可为进一步转化提供可能。
此外,当使用外消旋的1−24为底物,(R)-C13为手性磷酸时,非对映异构体2-24a和2−24b可以44% 收率,98.5:1.5 er和55% 收率,90:10 er通过柱分离方法分别获得。仅需要改变手性磷酸构型,另一对非对映异构体2-24c和2-24d也可分别获得。因此,所有的四种不同手性的立体异构体2−24(a−d)可以很便捷的从外消旋的异腈1−24中获得,其中,2-25(a-d)也可以相似方法获得。这些控制实验也表明了手性磷酸的构型是控制环丙烷构型的决定性条件。从手性异腈底物出发,改变磷酸构型,则可高收率的得到相应的单一构型的产物。
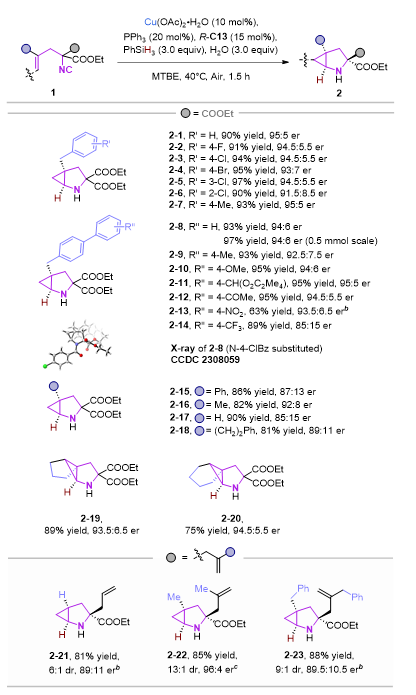
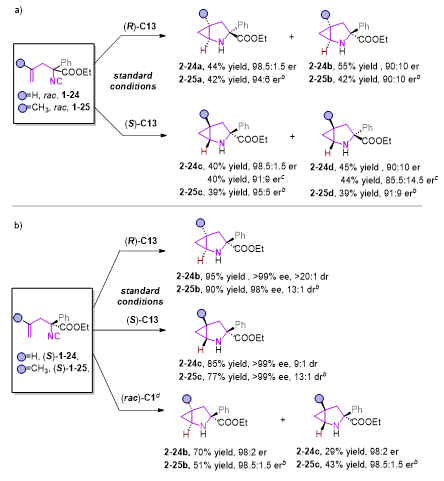
图4 底物拓展
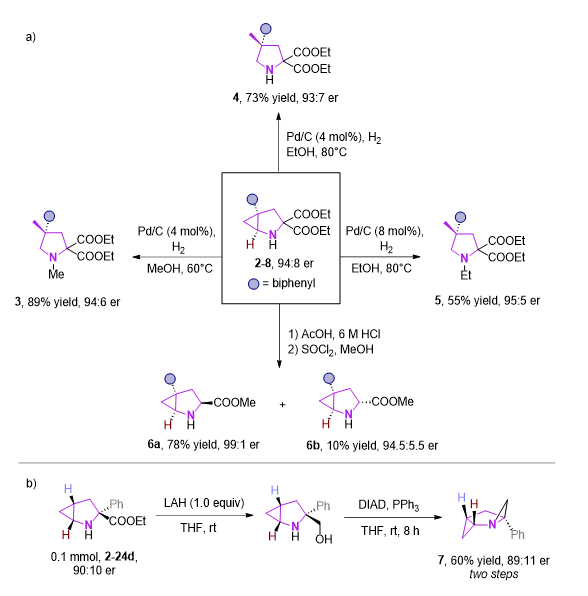
图5 底物衍生化
作者也对产物进行了一些衍生化,其中环丙烷结构可在Pd/C,H2条件下开环,控制不同的条件,可分别得到相应的N-H,N-Me,N-Et产物。2-8在经历脱羧,酯化两步过程后,可得到脯氨酸类似物6a和6b。此外,通过对2-24b的还原,再发生分子内mitsunobu反应,可以获得结构新颖的反式双(三环)并吡咯烷化合物7。
为了更深入的了解该反应的机制,作者对产物2-19的形成进行了DFT计算。在这里,从甲酰亚胺铜(I)物种2−19-A开始,计算了两种可能的途径:分步插入过程(红色途径)和卡宾插入过程(黑色途径)。分步过程涉及甲酰亚胺铜(I)物种通过四元环过渡态(TS-1,35.6kcal/mol)迁移插入烯烃,形成烷基铜中间体C。然而,该步骤的能垒太高,使得在既定的反应温度下不太可能发生,从而排除了分步途径。相反,卡宾过程的能垒为23.7 kcal/mol(TS-I),比分步途径的能垒低11.9 kcal/mol。基于我们的实验观察和文献报道,提出了一种可能的反应途径(图5a)。首先,铜(I)/CPA络合物I迅速与异腈配位,得到中间体II。接下来,硅烷对异腈进行亲核加成形成配位的CuH中间体III。形成关键的甲酰氨基铜(I)物种IV质子化产生中间体V,该中间体可快速异构成α-氨基铜卡宾VI。随后,与分子内烯烃发生(1+2)的环加成同时构成两个环。最后,中间体VII的配体交换释放产物2-1,并重新生成络合物I以重新进入催化循环。
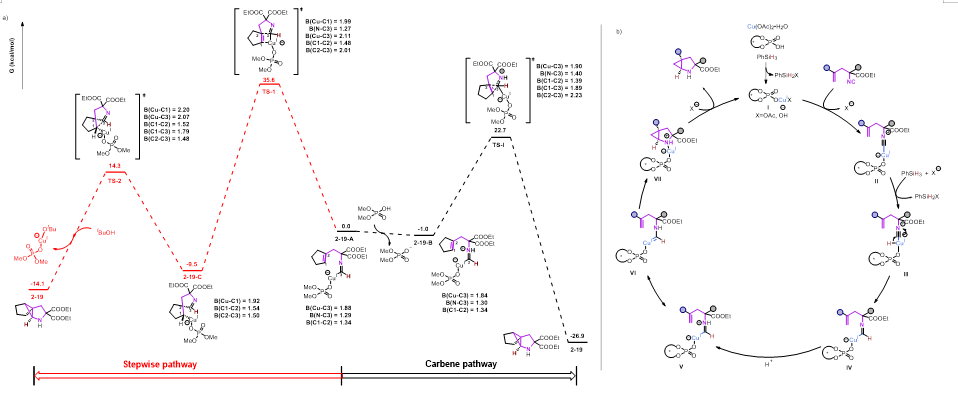
图6 机理研究
综上所述,朱强/罗爽课题组报道了在铜/手性磷酸催化下,硅烷插入异腈形成的甲酰亚胺铜(I)物种可以有效地异构形成α-氨基卡宾铜中间体,从而与分子内烯烃发成(1+2)环加成反应。这种新型的环丙烷化方法可在空气和含水条件下进行,并以良好的产率和对映选择性合成结构多样化的含N−H的2-氮杂双环[3.1.0]己烷化合物。此外,含有两个手性中心的所有四个立体异构体都可以通过外消旋烯基异腈与构型相反的手性磷酸从两个平行反应中对映选择性的获得。目前该方法不仅为对映选择性构建2-氮杂双环[3.1.0]己烷及其衍生物提供了一种有效的方法,也证明了α-氨基卡宾铜中间体在不对称合成中的潜力。
广州健康院朱强研究员、罗爽研究员(理论计算部分)以及李婧博士为共同通讯作者,广州健康院2022级博士研究生程思迪为文章第一作者。该项目得到了国家自然基金、广东省自然科学基金、广西自然科学基金等项目的支持。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn