

(图片来源:Nature)
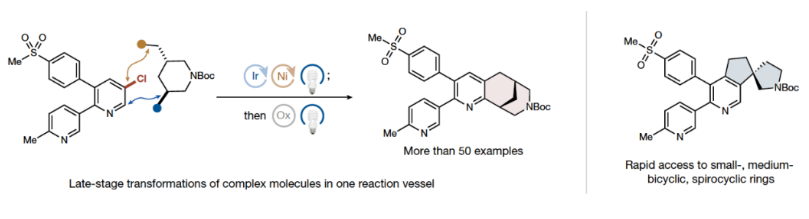
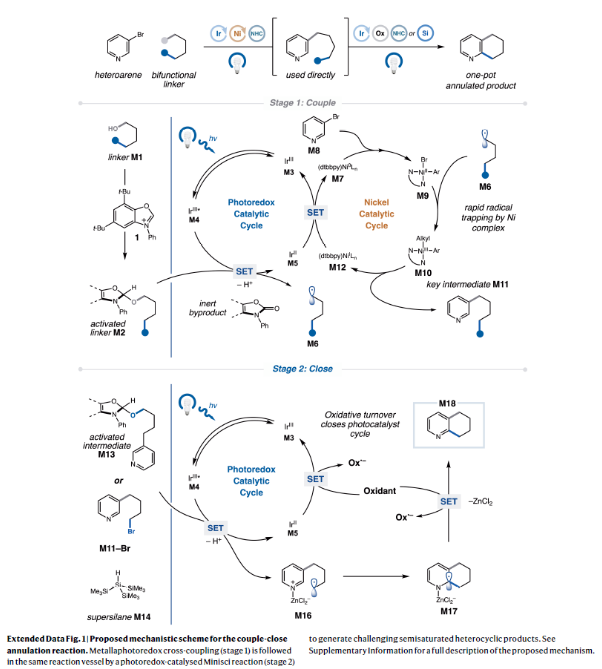
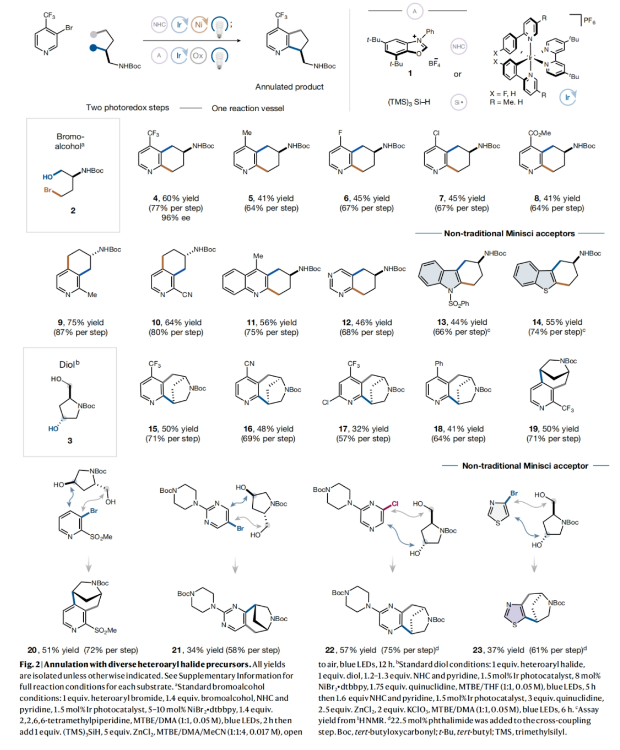
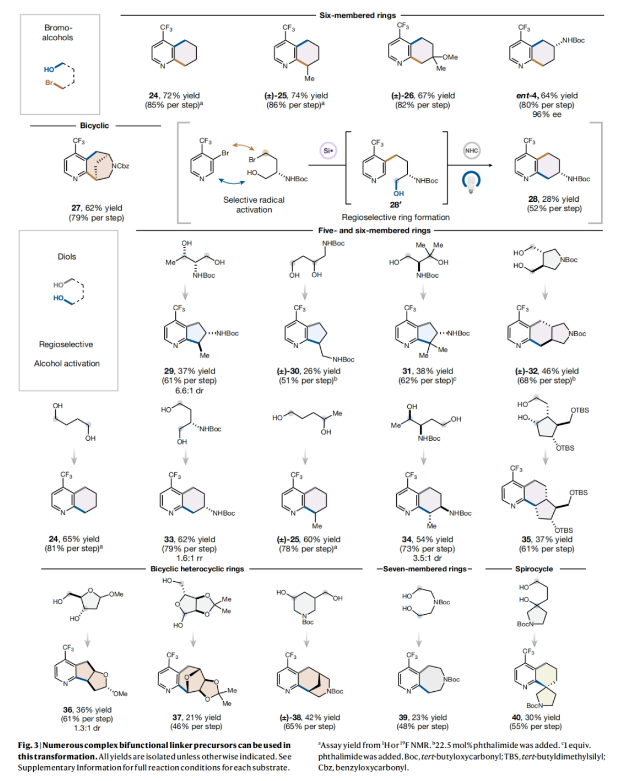
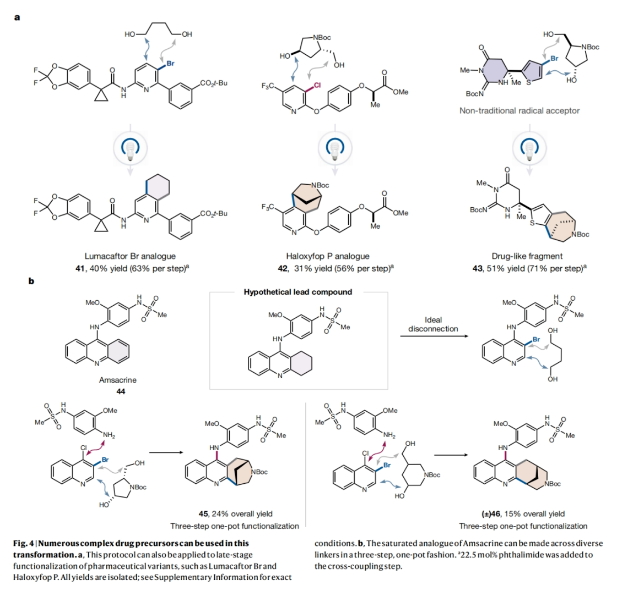
正文 杂芳烃是生物活性分子中普遍存在的结构骨架,其比它们的芳烃对应物具有更好的物理性质。特别是,半饱和杂芳烃具有更好的溶解度和较多的sp3碳骨架,这可以有效提高分子的结合亲和力和特异性。然而,由于目前合成方法的限制,此类结构骨架仍然很少见。事实上,目前半饱和杂环化合物大多是通过非模块化的合成方法艰难地制备出来的,这就降低了产率并限制了其化学多样性。最近,美国普林斯顿大学默克催化中心David W. C. MacMillan课题组发展了一种简单的、模块化的双自由基偶联-关环方法来高效构建半饱和环体系。该转化将金属光氧化还原C(sp2)-C(sp3)交叉偶联与分子内Minisci型自由基环化相结合,快速构建了统方法难以合成的多种螺环、桥环和取代的饱和环(Fig. 1)。下载化学加APP到你手机,收获更多商业合作机会。 (图片来源:Nature) 作者设想此偶联-关环反应可能通过Extended Data Fig. 1所示的机理进行。1)金属光氧化还原偶联:在光照之前,M1被NHC试剂1原位活化得到中间体M2。在光照下,铱光催化剂M3吸收一个光子,得到激发的三线态中间体M4,其随后氧化M2得到还原的铱络合物M5。M2被氧化后可以发生去质子化和β-断裂,并释放烷基自由基M6。同时,Ni0络合物M7与杂芳基溴M8发生氧化加成得到芳基NiII物种M9。此镍物种(M9)随后迅速捕获自由基中间体M6,生成烷基芳基NiIII络合物M10,并经历还原消除得到关键的烷基吡啶中间体M11和NiI络合物M12。最后,M12和M5通过单电子转移完成了两个催化循环。2)光氧化还原Minisci环化:当使用二醇作为反应试剂时,中间体(羟烷基)吡啶被额外的NHC(1)活化,形成活性中间体M13。当使用溴醇作为反应试剂时,需要将三(三甲基硅基)硅烷(M14)加入到反应混合物。在光照时,M3再次被激发并氧化M13或M14。与上一反应阶段类似,M14释放出烷基自由基M16。对于溴醇参与的反应,M16还可以通过M14的卤原子转移(XAT)生成。由于使用氯化锌作为Lewis酸,可以促进Minisci环化,最终通过氧化得到产物M18。此外,IrII物种M5可以通过单电子氧化得到M3。 随后,作者通过对反应条件进行筛选。当使用溴醇为双自由基前体时,最优条件为:杂芳基溴(1 equiv),溴醇(1.4 equiv),NHC(1.4 equiv),吡啶(1.4 equiv),Ir光催化剂(1.5 mol%),NiBr2•dtbbpy(5-10 mol%),2,2,6,6-四甲基哌啶(1.4 equiv),在MTBE/DMA (1:1, 0.05 M)中,蓝光照射下反应2小时。随后加入 (TMS)3SiH(1.0 equiv),ZnCl2(5 equiv),在MTBE/DMA/MeCN (1:1:4, 0.017 M)中,空气氛围下蓝光照射下反应12小时。当使用二醇为双自由基前体时,最优条件为:杂芳基卤(1.0 equiv),二醇(1.0 equiv),NHC(1.2-1.3 equiv),吡啶(1.2-1.3 equiv),Ir光催化剂(1.5 mol%),NiBr2•dtbbpy(8 mol%),quinuclidine(1.75 equiv),在MTBE/THF (1:1, 0.05 M)中,蓝光照射下反应5小时。随后加入NHC(1.6 equiv),吡啶(1.6 equiv),Ir光催化剂(1.5 mol%),quinuclidine(3.0 equiv),ZnCl2(2.5 equiv),KClO3(2.0 equiv),在MTBE/DMA (1:1, 0.05 M)中,蓝光照射下反应6小时。 (图片来源:Nature) 在发展了一锅自由基环化反应的最优条件后,作者对这两种反应的底物范围进行了考察。当以N-Boc-(S)-2-氨基-4-溴丁醇2为溴醇底物,N-Boc-反式-4-羟基-l-脯氨醇3为二醇底物时,一系列不同结构以及不同电性的杂环均可成功实现环化,以34-75%的产率得到相应的环化产物4-23(Fig. 2)。其中包括吡啶、喹啉、嘧啶、吡嗪、吲哚、苯并噻吩、噻唑等杂环均可兼容。值得注意的是,作者利用此方法所合成出的分子骨架在文献中很少报道,并且难以用其它方法来合成。其中结构相似的并环或桥环体系通常需要半选择性的氢化或多步杂环合成才可构建,由此突显出此策略的优势。 接下来,作者考察了双功能自由基前体的兼容性(Fig. 3)。高兴的是,一系列不同取代的溴醇均可作为环化试剂,以62-74%的产率得到相应的环化产物24-27,ent-4。值得注意的是,使用溴醇2的S-对映体反应可以得到含胺的对映体产物ent-4 (64%,每步80%),且立体化学完全保留(96% ee)。此外,不同取代的二醇同样可以经历区域选择性环化,以21-65%的产率得到相应的环化产物24, 25, 29-40。重要的是,通过改变官能团的活化顺序,可以使用相同的底物组合生成不同的区域异构体产物。即首先对溴醇2进行脱溴交叉偶联,随后进行脱氧自由基环化以完全的区域控制得到7-氨基四氢喹啉产物28(28%,每步收率为52%)。此外,同样的策略同样可以适用于其它溴醇底物。值得注意的是,利用此策略可以分别实现五元、六元、七元杂环,双环杂环以及螺环的构建。 最后,作者考察了复杂药物分子在此环化反应中的兼容性(Fig. 4)。实验结果表明,包括治疗囊性纤维化的Lumacaftor半饱和类似物41(40%)、除草剂Haloxyfop P类似物42(31%)以及噻吩X13 43(51%)均可通过此过程实现合成(Fig. 4a)。为了进一步证明该反应的合成价值,作者利用此策略,采用一锅三步的方式制备了抗癌剂Amsacrine 44的部分饱和类似物45(24%)和46(15%)(Fig. 4b)。 总结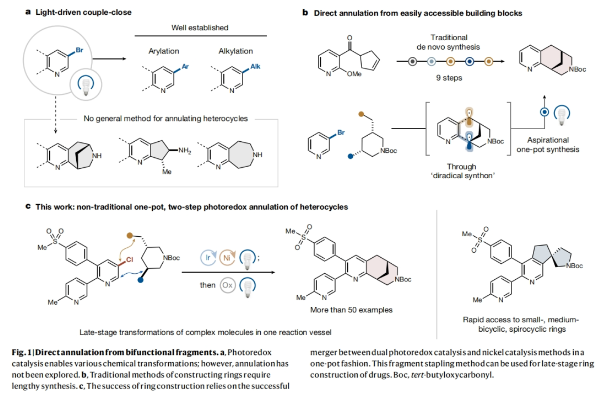
David W. C. MacMillan课题组报道了一种会聚性反应策略,通过双自由基环化的方式实现了具有挑战性的半饱和杂环体系的构建。该反应使用商业易得的卤代杂环和溴醇或二醇作为起始原料,首先经历镍催化的自由基交叉偶联,随后是杂芳基骨架的自由基烷基化。此转化避免了繁琐的合成步骤,可以兼容手性起始原料和生物活性分子衍生的起始原料,能够合成出一系列不同取代的半饱和骨架,其中包括许多以前难以合成的环体系和药物衍生物,具有重要的应用价值。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn