


(图片来源:J. Am. Chem. Soc.)
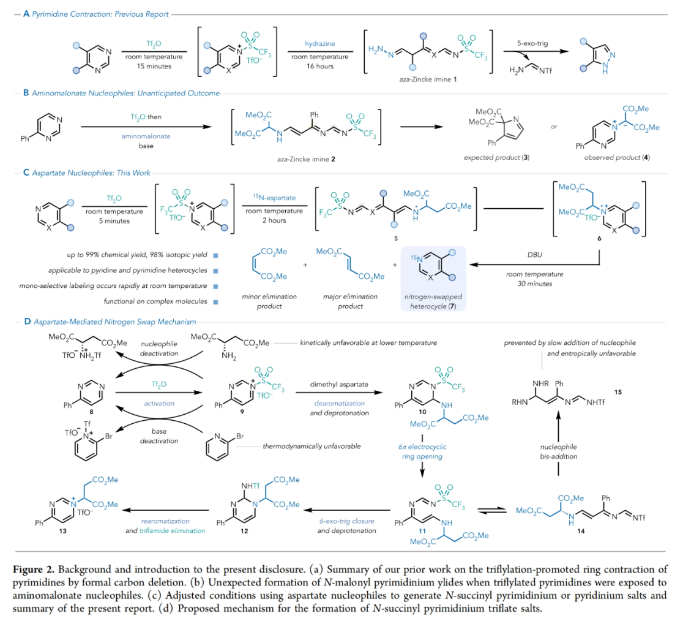
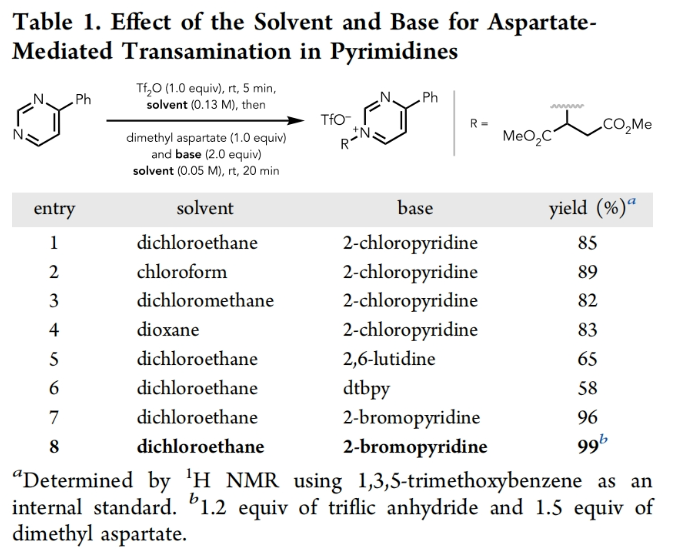
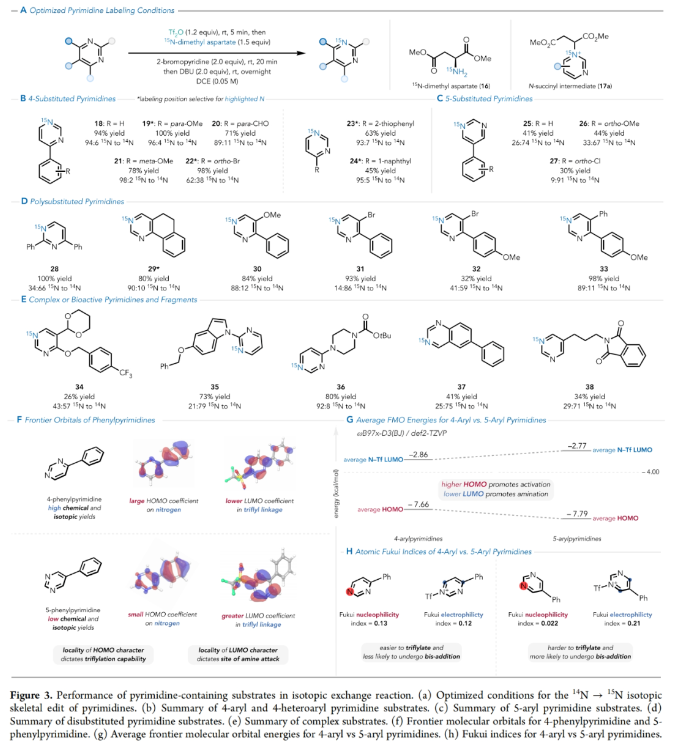
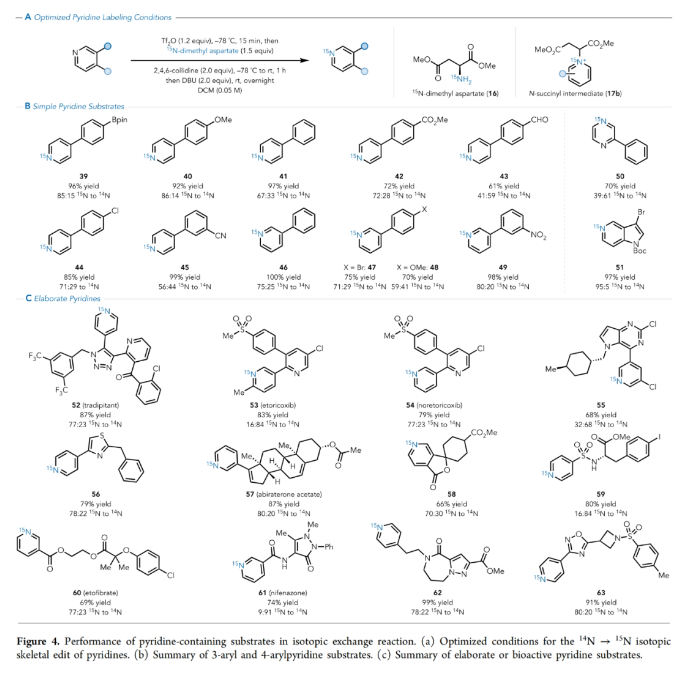
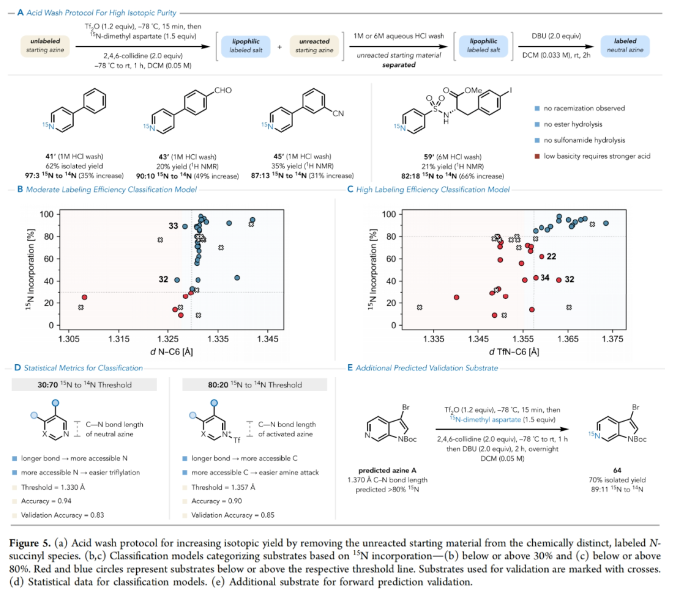
正文 在有机分子中引入可追踪的同位素在化学、生物学和材料科学中有着重要的应用。特别是15N标记,其可以在含氮化合物中诱导偶极核磁共振活性,从而使各种强大的分析技术得以利用(Figure 1A)。鉴于氮杂环在功能分子尤其是药物中的普遍存在,以及同位素标记在生物分子核磁共振、结构分析、体内代谢组学、机理阐明、溶液态力学、自旋超极化等应用中的重要意义(Figure 1B),发展一种直接的氮杂芳烃同位素标记方法是非常有价值的。 近年来,骨架编辑领域一直在迅速发展(Figure 1C)。而直接通过原子交换而不改变其结构形态的方法仍然很少,尽管不断有实现这一目标的报道出现(Figure 1D,E)。2023年,Levin课题组发展了一种由二乙烯基二溴前体实现13C标记苯酚的简单合成方法(Figure 1F)。最近,美国犹他大学Matthew S. Sigman, 美国默克公司Charles S. Yeung和美国加州大学伯克利分校Richmond Sarpong课题组联合发展了芳香族氮杂环的14N→15N同位素交换方法,在温和条件下以较高的产率和同位素标记率得到相应的15N标记氮杂环产物。下载化学加APP到你手机,收获更多商业合作机会。 (图片来源:J. Am. Chem. Soc.) 利用作者之前发展的形式碳原子删除策略,可以将嘧啶转化为吡唑(Figure 2A),作者认为N-三氟甲磺酰化的嘧啶环与氨基丙二酸酯亲核试剂反应时,会经历亲核试剂的加成、开环和闭环,以实现形式上的氮原子删除,从而得到3(Figure 2B)。然而,实际反应结果却得到了N-丙二酰基叶利德产物4,且产物结构通过X-射线单晶衍射得到了证实。作者认为可能是由于丙二烯基片段的C-H酸性较高所引起的。而当作者利用天冬氨酸二酯代替氨基丙二酸酯时(Figure 2C),仍可以以高达99%的产率得到6。此类亲核试剂也为N-烷基中间体的脱烷基化创造了条件(这在类似的吡啶体系中是史无前例的),从而得到一个交换了氮原子的嘧啶环(Figure 2D)。 首先,作者对反应条件进行了优化(Table 1)(Figure 3A)。当使用嘧啶(1.0 equiv),Tf2O (1.2 equiv),在DCE中室温反应5分钟后,加入天冬氨酸二甲酯(1.5 equiv),2-溴吡啶(2.0 equiv),在DCE中室温反应20分钟可以以99%的核磁产率得到相应的氮原子交换产物。 (图片来源:J. Am. Chem. Soc.) 在得到了最优反应条件后,作者对此转化的底物范围进行了探索(Figure 3)。实验结果表明包括4-取代嘧啶(Figure 3B)、5-取代嘧啶(Figure 3C)以及多取代嘧啶(Figure 3D)在内的一系列底物均可顺利兼容,以30-100%的产率得到相应的15N标记产物18-33。值得注意的是,一系列复杂的或具有生物活性嘧啶类化合物同样可以顺利实现14N→15N同位素交换,以34-80%的产率得到相应的15N标记产物34-38(Figure 3E)。此外,嘧啶环所固有的低亲核性经常导致分子上的其他更活跃的位点发生竞争性三氟甲磺酰基化,从而阻止所需的反应发生或诱导副反应发生。相对于C5-芳基取代的嘧啶,4-芳基嘧啶底物在杂环氮原子上具有更大的HOMO系数,表明其亲核性增强。事实上,5-芳基嘧啶底物的HOMOs在杂环氮原子上的定位效应极小(Figure 3F)。5-芳基嘧啶的N-三氟甲磺酰基衍生物在杂环碳原子上也具有更大的LUMO特征,并且在这些位点上的空间位阻更小,这表明双亲核试剂加成的可能性更高(Figure 3G)。这些数据分别由中性和三氟甲磺酰化物种的氮原子和碳原子的Fukui亲核性和亲电性指数所证实(Figure 3H)。 高兴的是,除了嘧啶之外,吡啶也可以实现此类转化,得到相应的15N标记吡啶产物(Figure 4)。虽然该反应在室温下是成功的,但在-78 oC下进行可以显著提高反应效率(Figure 4A),以61-100%的产率得到相应的14N→15N同位素交换吡啶产物39-51(Figure 4B)。此外,一系列含有吡啶杂环的复杂分子和生物活性分子(tradipitant, etoricoxib, noretoricoxib, etofibrate, nifenazone)均可顺利实现转化,以66-99%的产率得到相应的15N标记吡啶产物(Figure 4C)。 (图片来源:J. Am. Chem. Soc.) 在实现氮原子交换后,使用温和的酸洗来去除未反应的起始原料则可分离出具有高同位素标记纯度的吡啶产物(Figure 5)。例如,对于底物43’, 45’和59’,可以利用此方法可以有效的提高同位素标记纯度。最后,为了阐明中等同位素标记率和高同位素标记率的底物结构特征,作者进行了DFT计算。计算结果表明随着N-C6距离的增加,氮原子变得更亲核,从而更有效地进行三氟甲磺酰化。此外,更长的N-C6键也表明氮的空间位阻降低,可进一步促进三氟甲磺酰化。 总结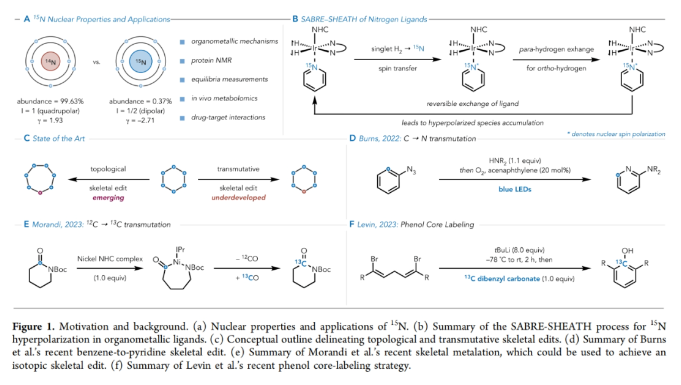
 a
a
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn