- 首页
- 资讯
JACS:首例位点选择性电化学芳烃C−H胺化反应
来源:化学加原创 2024-03-27
导读:近日,美国西北大学Christian A. Malapit课题组报道了一种高选择性芳香族C−H键的胺化反应。其中,该电化学策略涉及阴极还原生成高度亲电的双阳离子N-中心自由基,该自由基可有效地参与芳香族C-H官能团化与并引导芳香族取代的区域选择性。氮自由基阳离子−π(nitrogenradical cation−pi)与芳烃的相互作用导致电荷转移机理,随后形成芳香族C−N键。这种电化学过程以优异的产率和区域选择性获得芳基DABCOnium盐。同时,该反应具有广泛的底物范围以及出色的官能团耐受性。此外,利用芳基DABCOnium盐加成物还可直接合成各种芳基哌嗪。同时,通过光氧化还原催化可将环外芳基C(sp2)−N键化学选择性地断裂,生成芳基自由基,并可参与芳基C−C和C−P键形成。文章链接DOI:10.1021/jacs.3c11506.

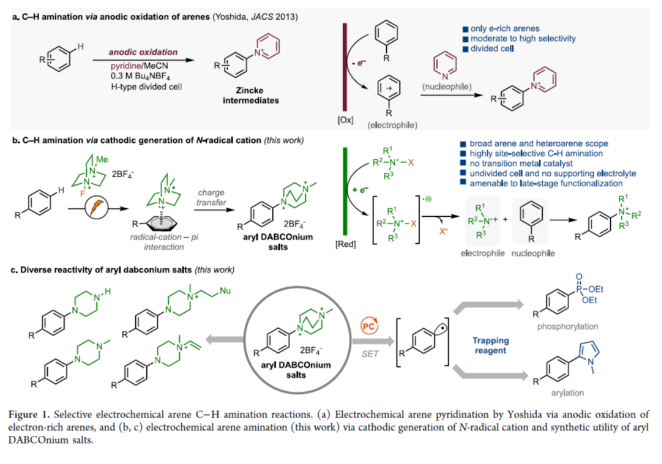
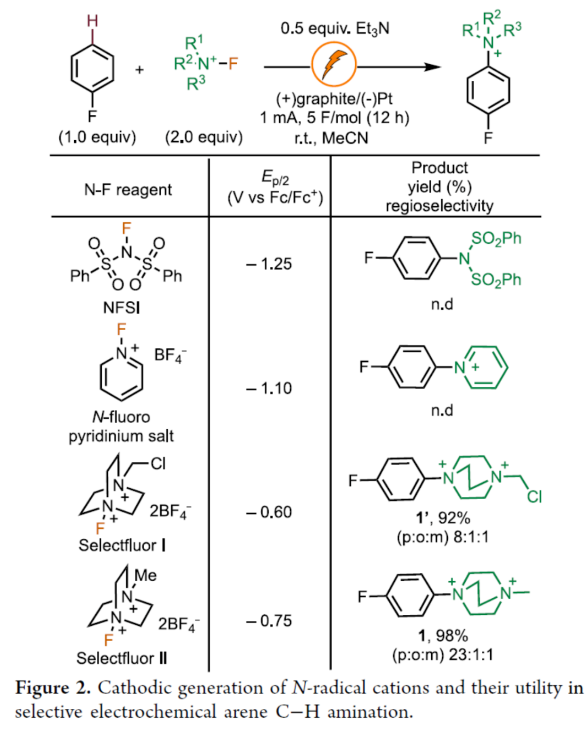
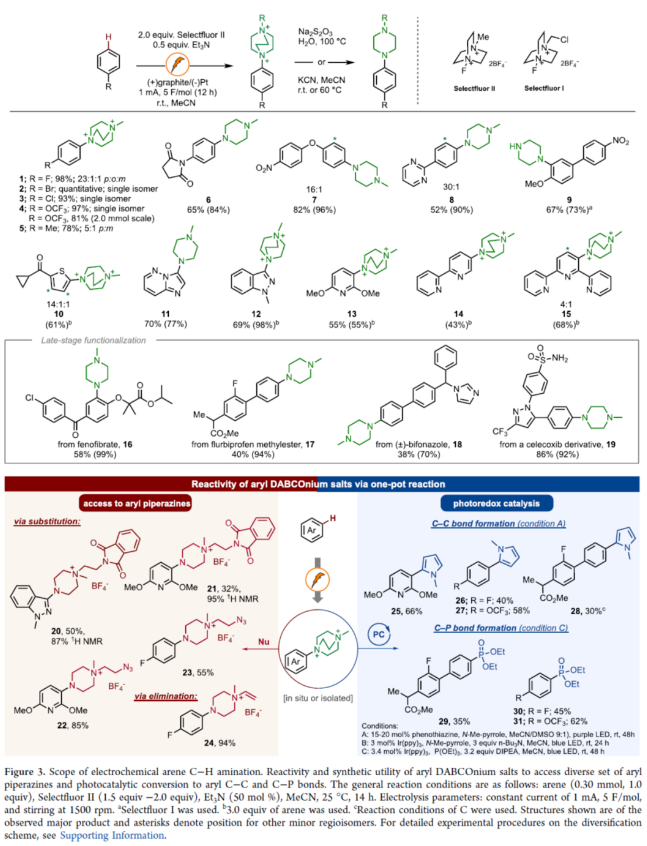
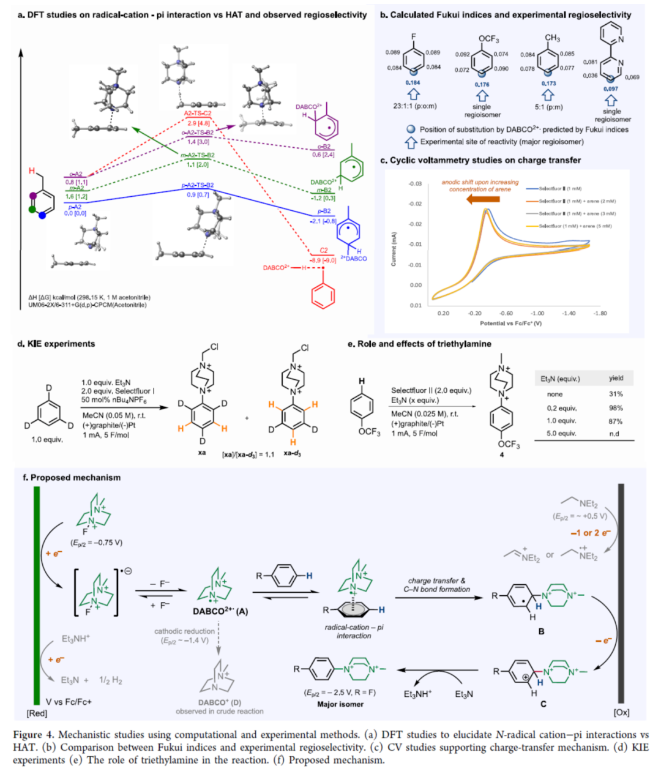
芳香族C−H键转化为C−N键具有重要的价值。传统上,非导向芳香族C−H胺化方法依赖于串联硝化/还原/烷基化过程,但存在位点选择性差和底物相容性差等问题。随后,化学家们还探索了几种利用过渡金属催化、化学计量反应试剂以及光催化方法来提高选择性和扩大底物范围的替代方法。2013年,Yoshida课题组(J. Am. Chem. Soc. 2013, 135, 5000.)首次报道了一种电化学芳烃C−H胺化反应,涉及通过将芳烃阳极氧化为自由基阳离子,然后与吡啶(作为亲核试剂和共溶剂)形成C−N键,从而形成芳基吡啶鎓盐(Figure 1a)。近日,美国西北大学Christian A. Malapit课题组报道了一种通过Selectfluor的直接阴极还原生成一个以氮为中心的双阳离子自由基,该自由基经历电荷转移,随后与芳烃形成C−N键,形成芳基DABCOnium盐(Figure 1b)。机理研究表明,对不同芳烃的位点选择性和通用性是通过自由基-阳离子-π相互作用促进电荷转移机理实现的。此外,芳基DABCOnium盐可与一系列亲核试剂进行反应生成一系列芳基哌嗪衍生物。同时,芳基DABCOnium盐通过光氧化还原催化策略,还可实现芳基C−C和C−P键形成(Figure 1c)。下载化学加APP到你手机,收获更多商业合作机会。首先,作者认为N−X试剂的阴极还原将生成可用于芳烃C−H胺化的氮中心自由基。因此,作者探索了各种可作为氮自由基阳离子源的N−X试剂(如NFSI、N-氟吡啶鎓盐和Selectfluors I和II),并以氟苯作为电化学芳烃C−H胺化的模型底物(Figure 2)。研究结果表明,当使用Selectfluor II作为氮自由基阳离子源时,可以98%的收率得到芳基DABCOnium盐1,p:o:m为23:1:1。紧接着,作者对底物范围进行了扩展(Figure 3)。首先,具有不同电性取代的芳烃均可顺利反应,获得相应的产物1-9,收率为52-100%。其中,对于简单的单取代芳烃,对位是有利的。对于对位同时含有取代基的二取代芳烃,给电子性更强的取代基邻位C−H键优先进行官能团化。对于多芳烃体系,具有较高电子密度的芳烃优先进行官能团化。其次,一系列杂环化合物,如噻吩、吡啶、联吡啶、三联吡啶、吲唑和咪唑并吡啶等,均与体系兼容,获得相应的产物10-15,收率为43-98%。值得注意的是,该策略还可用于一些药物分子的后期衍生化,如非诺贝特、甲基氟比洛芬、联苯苄唑以及塞来昔布衍生物,获得相应的产物16-19,收率为38-86%。此外,在一锅法中,所得芳基DABCOnium盐可以很容易地转化为芳基哌嗪20-24,收率为32-94%。同时,芳基DABCOnium盐通过光氧化还原催化策略,还可实现芳基C−C和C−P键的构建,获得相应的产物25-31,收率为30-66%。紧接着,作者对反应机理进行了研究(Figure 4)。首先,通过DFT计算对N-自由基阳离子-π相互作用与HAT过程进行了对比研究(Figure 4a)。计算结果表明,阴极生成N-自由基二价离子配合物后,N-自由基-阳离子−π进行相互作用。DABCO2+•自由基阳离子中间体(Einteraction(A2))在芳环上不同位置的相互作用能,进一步支持了加成至甲苯的对位。同时,这些能量计算与实验区域选择性中观察到的能量计算相匹配(Figure 4a and 4b)。DFT研究支持N-自由基-π相互作用的中间性,然后形成C−N键,与苄基HAT过程的TS能量相比,这是一个更有利的过程(Figure 4a)。为了理解和预测反应的区域选择性,计算了所选底物的Fukui指数,发现Fukui指数是预测该反应观察到的区域选择性的主要参数(Figure 4b)。具体而言,Fukui指数最高的芳烃中的碳会发生C−H键胺化。此外,空间效应也可能起作用,如在甲苯中观察到的那样,其中获得了5:1(p:m)的区域选择性,并且没有观察到邻位胺化产物。其次,CV实验结果表明,电化学生成的双阳离子N-自由基与芳烃之间存在电荷转移机理(Figure 4c)。KIE实验结果表明,芳香族C−H键的断裂不是限速步骤(Figure 4d)。通过对三乙胺在反应中的作用研究发现,三乙胺作为碱可将中间体C转化为芳基DABCOnium产物。同时,三乙胺也可以通过阳极氧化作为牺牲还原剂,促进Selectfluor的还原。在高负载量下的三乙胺(如5当量)进行反应,不产生任何产物,因为三乙胺的阳极氧化完全超过中间体B到C的阳极氧化(Figure 4e)。基于上述的研究,作者提出了一种合理的催化循环过程(Figure 4f)。首先,Selectfluor进行阴极还原生成N-自由基双阳离子,其参与了与芳烃的电荷转移步骤与C−N键形成,生成的自由基中间体B。中间体B经阳极氧化后,生成中间体C。在碱(Et3N)存在下,中间体C可进行去质子化,从而生成芳基DABCOnium产物。美国西北大学Christian A. Malapit课题组首次报道了一种通过阴极产生N-自由基阳离子进行芳香族C−H胺化的还原电化学方法。同时,该反应对对位C−H官能团化具有高到优异的区域选择性,并且这种区域选择性由参与芳烃的电荷转移机理的双阳离子N-自由基中间体的亲电性决定。该反应具有广泛的底物范围,在各种N-杂环和药物的后期官能团化中具有显著的反应性和选择性。此外,结合电化学位点选择性芳香族C−H胺化,该策略证明了芳基DABCOnium盐的合成效用:作为合成各种芳基哌嗪的前体,以及作为小分子药物的串联光催化C−H磷酰化和芳基化中的芳基自由基前体,展示了它们在选择性芳烃C−H功能化领域的未来发展潜力。文献详情:
Eva Maria Alvarez, Griffin Stewart, Mohammed Ullah, Remy Lalisse, Osvaldo Gutierrez, Christian A. Malapit*. Site-Selective Electrochemical Arene C−H Amination. J. Am. Chem. Soc. 2024, https://doi.org/10.1021/jacs.3c11506
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn