

(图片来源:J. Am. Chem. Soc.)
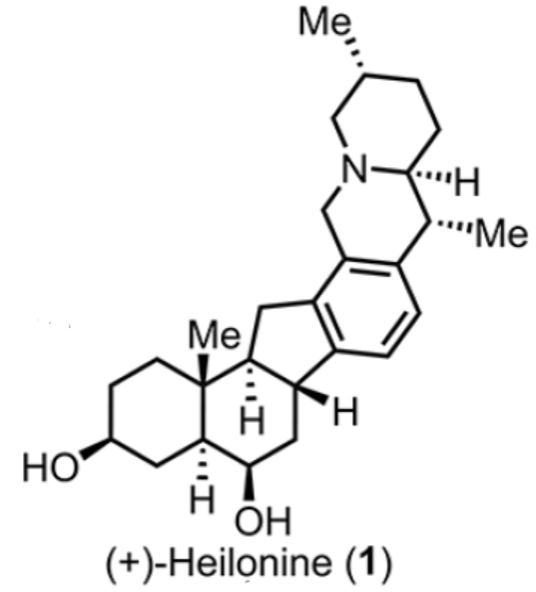
正文 Heilonine(1,Figure 1)由Kaneko等人于1989年从Fritillaria ussuriensis Maxim(也叫平贝母)中分离得到。Heilonine属于藜芦(Veratrum)甾体生物碱家族,其成员具有常见的C-nor D-homo甾体骨架(Figure 1A)。根据哌啶E环周围的连接模式,藜芦甾体生物碱可进一步分为三个亚科:Cevanine(1−5)、Jervine(6和7)和Veratramine(8和9)。其中,Cyclopamine(7)是最值得注意和研究的一种。它被鉴定为Hedgehog信号通路抑制剂,其类似物Patidegib目前正在进行癌症治疗的人体临床试验。下载化学加APP到你手机,收获更多商业合作机会。 由于藜芦甾体生物碱的结构多样性、复杂性和治疗潜力,自20世纪60年代以来,它们的合成引起了人们的广泛关注。1967年,Masamune课题组(J. Am. Chem. Soc. 1967, 89, 4521.)和Johnson课题组(J. Am. Chem. Soc. 1967, 89, 4523.)分别报道了47步的Jervine(6)和41步的Veratramine(8)的突破性全合成。这两种合成都可以追溯到Hagemann’s酯。随后,Kutney等课题组还报道了几种Veratrum甾体生物碱的合成,包括1968年通过31步合成Verarine(9)与1977年通过28步合成Vetine(3)。2009年,Giannis课题组(Angew. Chem., Int. Ed. 2009, 48, 7911.)报道了一种由脱氢表雄酮分20步实现了Cyclopamine的半合成。2023年,Baran课题组(J. Am. Chem. Soc. 2023, 145, 21760.)通过16步LLS对Cyclopamine进行了汇聚式和对映选择性全合成,随后高栓虎等课题组(J. Am. Chem. Soc. 2023, 145, 25086.)在23步LLS进行了全合成。同年,罗佗平课题组(J. Am. Chem. Soc. 2023, 145, 20202.)经37步LLS首次全合成了高氧化的Zygadenine(5)。2021年,Rawal和Cassaidy课题组(J. Am. Chem. Soc. 2021, 143, 16394.)报道了唯一一例Heilonine的全合成报道,涉及21个LLS步骤(总共30步;Figure 1B)。它们优雅的合成特点是通过对映选择性有机催化的Diels−Alder反应构建具有三个手性中心的B环(10+11→12)和Rh-催化[2+2+2]环加成构建芳香D环(13→14)。近日,美国埃默里大学代明骥课题组报道了一种由Wieland−Miescher酮和苯乙炔经11或13步LLS实现了(+)-Heilonine的汇聚式全合成。 同时,作者进行了相关的逆合成分析(Figure 1C)。砌块15作为合成Heilonine(1)的高级中间体。砌块16经Nazarov环化,可实现砌块15中C环的构建。砌块17与砌块18经钯催化羰基化偶联反应,可实现砌块15的合成,涉及AB环和DEF环的联接。砌块18可由手性Wieland−Miescher酮(23),在C6处进行选择性的C−H羟基化反应制备。砌块18可由砌块19经C-H官能团化反应制备。砌块19可由砌块20经胺导向钯催化羰基化C−H内酰胺化反应制备。对于具有三个手性中心的砌块20可由化合物21与化合物22经Boc-导向与非对映选择性的C−H锂化以及钯催化Negishi交叉偶联反应制备。化合物21可以通过相应胺的Boc保护合成,化合物22可以通过苯乙炔的区域选择性碘化制备。 (图片来源:J. Am. Chem. Soc.) 砌块26的合成(Scheme 1A):以化合物21和22为初始底物,在s-BuLi/TMEDA/ZnCl2进行非对映选择性的C−H锂化反应以及在CPhos Pd G3/ CPhos条件下进行钯催化Negishi交叉偶联反应,可得到中间体24。同时,化合物24以高度区域选择性和非对映选择性的方式在C22处产生所需的立体化学。中间体24在TFA条件下脱除Boc后,可以两步52%的总收率得到胺中间体25。中间体25在Crabtree’s cat./ H2条件下进行导向和催化氢化反应,可以88%的收率得到单一非对映体中间体20。20在Pd(OAc)2/Cu(OAc)2/CO/air条件下进行氧化羰基化C−H内酰胺化反应,可以82%的收率得到中间体19。中间体19在[Ir(cod)(OMe)]2/L1/B2pin2条件下经铱催化的C−H硼化反应,可以60%的收率得到含有Bpin基团的中间体17a。中间体19在[RhCp*Cl2]2/AgSbF6/NIS/PivOH条件下经铑催化C−H碘化反应,可以85%的收率得到含有碘基团的中间体17b。其中,以中间体17b为底物,在BH3•THF条件下经还原反应,可以95%的收率得到中间体26。 砌块29的合成(Scheme 1A):以Wieland−Miescher酮23为底物,在LiHMDS/HMPA/ Comins’试剂条件下进行三氟甲磺酰基化反应,可以40%的收率得到中间体27。27在Pd(PPh3)4/(Me3Sn)2/LiCl条件下进行反应,可以83%的收率得到中间体28。通过对反应条件的尝试后发现,中间体28与中间体26在Pd(PPh3)4/LiCl/CuCl/CO条件下进行钯催化羰基化偶联反应,可以68%的收率得到中间体29。 然而,中间体29在光化学(254 nm)条件下进行环化反应,可以25%的收率得到螺环化合物30,dr为2.7:1,而非目标产物。同时,中间体29在TfOH/HFIP条件下进行Nazarov环化反应,可得到中间体33(收率43%)、34(收率41%)和35(收率11%)的混合物。并且在体系无HFIP的情况下,可得到中间体33(收率58%)和34(收率23%)。这些结果表明,角甲基在C8处几乎没有发挥立体化学控制作用。 基于对上述的总结,作者设计了一种汇聚式合成(+)-Heilonine的路线(Scheme 1B)。以Wieland−Miescher酮23为底物,在p-TsOH•H2O/HOCH2CH2OH条件下进行反应,可以91%的收率得到单缩酮中间体36。中间体36在Na2-Eosin Y/456 nm LED/O2条件下进行光氧化还原C-H氧化反应,可以45%的收率得到中间体37。中间体37在KOH/MeOH/H2O条件下进行异构化反应,可以38%的收率得到中间体38。中间体38在LiAl(Ot-Bu)3H/HCl条件下进行还原与脱保护反应,在TBSOTf/2,6-二甲基吡啶条件下进行羟基的保护,可以两步90%的总收率得到中间体40。40在NaHMDS/Comins’ reagent条件下进行三氟甲磺酰基化反应,可以75%的收率得到中间体41。中间体41在Pd(PPh3)4/LiCl/(Me3Sn)2条件下进行钯催化的锡化反应,可以97%的收率得到中间体42。中间体42与中间体26在Pd(PPh3)4/LiCl/CuCl/CO条件下进行Stille羰基化反应,可以73%的收率得到中间体43。中间体43在hυ (370 nm)/AcOH以及KOH条件下反应,可以69%的收率得到中间体44和45的混合物,44(cis)/45(trans)为1/1.7。同时,中间体44在i-Pr2NH/MeOH条件下进行差向异构化反应,可以59%的收率转化为中间体45。中间体45分别在在NaBH4/MeOH/THF条件下进行还原反应、在NaHMDS/CS2/MeI/THF条件下进行羟基硫酯化反应以及在Et3B/n-Bu3SnH进行脱硫酯反应,可以三步64%的总收率得到中间体46。中间体46在TfOH条件下进行羟基的脱保护后,可以86%的收率得到(+)-Heilonine(1)。同时,中间体45在Zn/HCl条件下以及TfOH条件下反应,可以两步24%的总收率直接得到(+)-Heilonine(1)。 (图片来源:J. Am. Chem. Soc.) 总结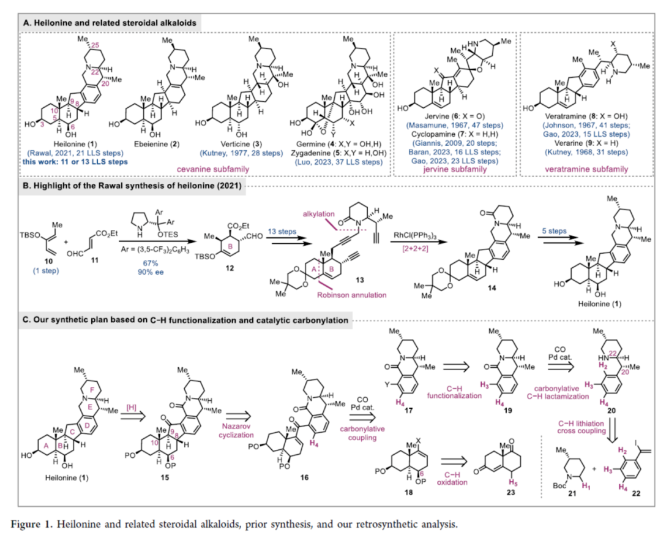
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn