- 首页
- 资讯
JACS:硼化碳环的合成方法
来源:化学加原创 2024-04-01
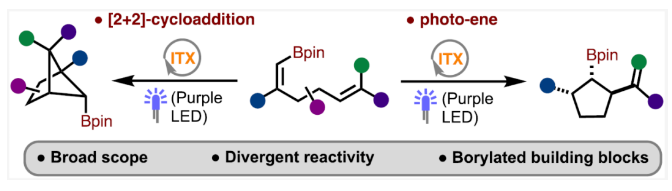
导读:近日,瑞士SpiroChem AG Christophe Salome与美国印第安纳大学(Indiana University)M. Kevin Brown课题组合作,通过交叉[2+2]-环加成策略实现了硼化双环[2.1.1]己烷的合成。由于C−B键的存在,其可以很容易地通过衍生化来制备一系列其它方法难以获得的结构骨架。此外,作者还发展了一种罕见的光-ene反应,其可以高非对映选择性的实现多种三取代硼化环戊烷的合成。相关成果发表在J. Am. Chem. Soc.上,文章链接DOI:10.1021/jacs.4c01557。
(图片来源:J. Am. Chem. Soc.)
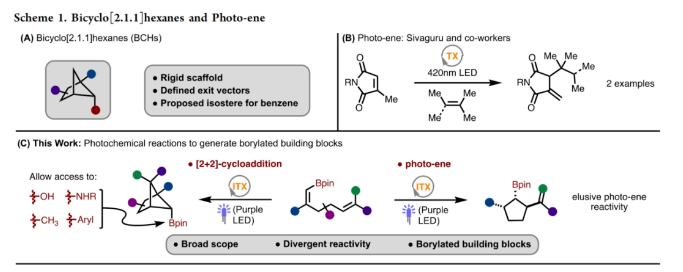
饱和双环化合物是农用化学品和药物开发过程中的重要合成砌块。其中双环[2.1.1]己烷骨架由于具有刚性骨架结构,使得其在药物化学中得到了广泛的应用(Scheme 1A)。然而,实现此类骨架的合成通常具有一定的挑战性。目前,双环[2.1.1]己烷的合成主要通过以下三种策略:1)缩环;2)张力释放的形式环加成;3)交叉[2+2]环加成。虽然其合成目前已经取得了重要进展,但许多不同取代模式的化合物的制备仍然具有极大的挑战性。最近,瑞士SpiroChem AG Christophe Salome与美国印第安纳大学(Indiana University)M. Kevin Brown课题组分别通过交叉[2+2]-环加成反应和光-ene反应实现了硼化双环[2.1.1]己烷和硼化环戊烷的合成(Scheme 1B)(Scheme 1C)。下载化学加APP到你手机,收获更多商业合作机会。首先,作者使用硼取代的1,5-二烯1作为模板底物对光诱导的[2+2]环加成反应进行探索,并对反应条件进行了优化(Table 1)。当使ITX (2-Isopropylthioxanthone, 10 mol%),在MeCN (0.2 M)中,395 nm光照下反应12小时可以以93%的核磁产率得到相应的环加成产物2a(entry 9)。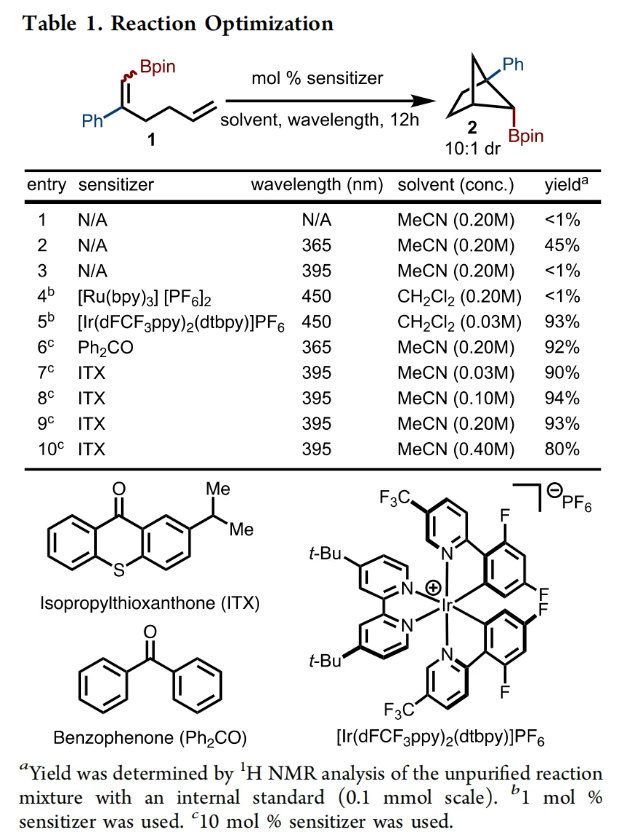
(图片来源:J. Am. Chem. Soc.)
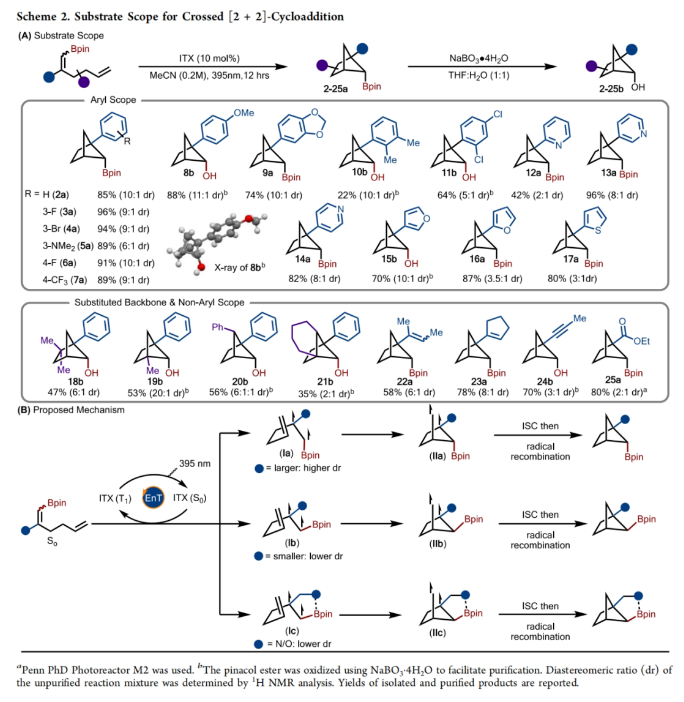
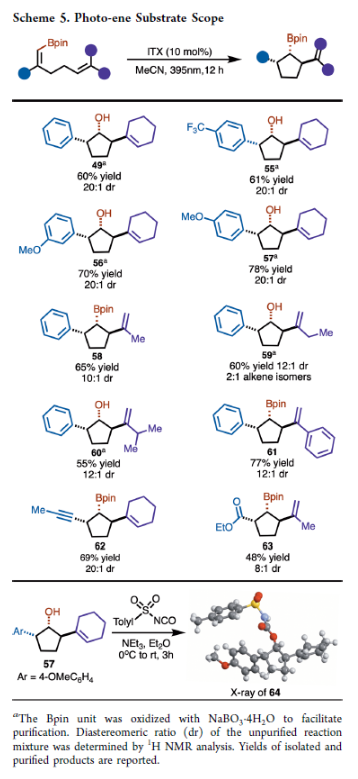
在得到了最优反应条件后,作者对此转化的底物范围进行了考察(Scheme 2A)。实验结果表明,此转化具有良好的官能团兼容性,以22-96%的产率得到相应的产物2-17(dr: 2:1-15:1)。其中芳基部分可以连有吸电子基(7、11)、供电子基(5、8)、卤素(4)等基团。此外,此转化还可以兼容杂芳基,如呋喃(15、16)、噻吩(17)和吡啶(12-14)等。对于1,5-二烯的饱和碳链也可以在其α-、γ-和δ-位取代,得到多取代产物18−21。最重要的是,芳基并不是必需的。烯基、炔基和酯基均具有良好的耐受性,得到产物22−25。机理上,此[2+2]-环加成反应可能涉及光激发的ITX与底物之间的Dexter能量转移,从而产生三线态I(Scheme 2B)。随后通过5-exo-trig的自由基加成生成中间体II,其通过ISC和自由基重组生成双环[2.1.1]己烷。反应中所观察到的非对映选择性可能是发生在5-exo-trig关环过程或自由基重组过程中,这取决于哪一步是对映选择性的决定步骤。当芳基这样的大基团存在于底物中时一般具有良好的非对映选择性(Ia和IIa),而像连接炔基这样的小基团则选择性较差,其中涉及Ib和IIb的两个途径具有一定的竞争性。在生成12、16、17和25的反应下,作者观察到较差的非对映选择性,这可能是由于近端Lewis碱原子与硼的空p轨道配位所造成的,如Ic或IIc 所示。(图片来源:J. Am. Chem. Soc.)
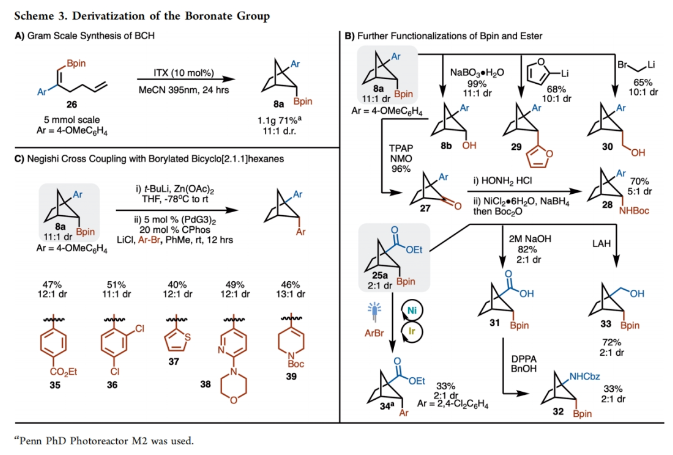
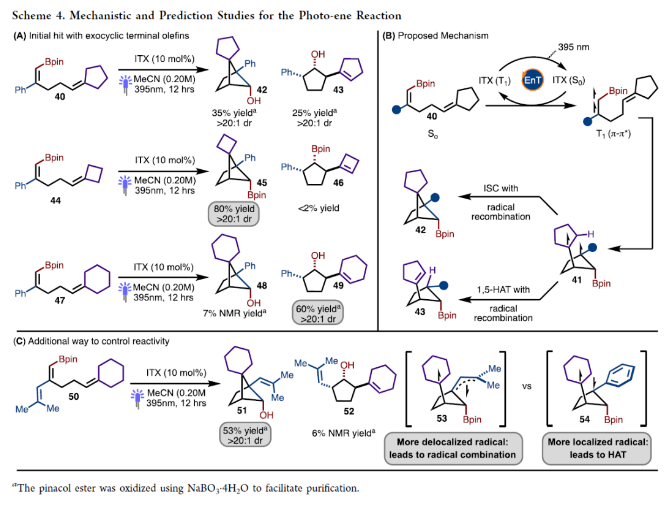
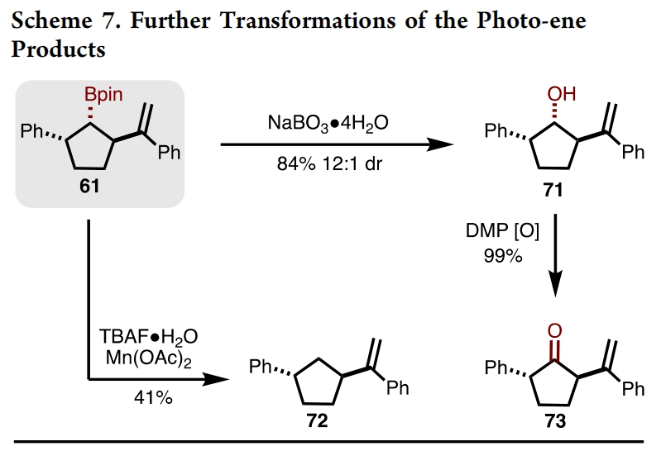
当反应在5.0 mmol规模上进行时,仍可以71%的产率得到超过1克的产物8a(Scheme 3A)。为了证明此转化的实用性,作者进行了一系列合成转化(Scheme 3B)。首先,8a通过NaBO3.H2O氧化可以以99%的产率得到相应的醇8b;而8b可以通过进一步氧化以96%的产率得到相应的酮27,其可以通过还原胺化以70%的产率得到28。然而,作者尝试将8通过直接胺化的方法来制备28并不成功。另外,8a与呋喃进行的无金属参与交叉偶联效果良好,以68%的产率,得到29。此外,Matteson同系化过程进展顺利,以65%的产率,10:1 dr得到产物30。由于反应对酯基具有良好的兼容性,作者又对产物25a中的酯基进行了衍生化。在NaOH水溶液的存在下,25a可以以82%的产率水解为相应的羧酸31。而31可以通过Curtius重排以33%的产率得到Cbz-保护的胺32。此外,25a中的酯基还可以通过LiAlH4还原,以72%的产率得到相应的醇33。最后,25a还可以通过氨基自由基转移(ART)交叉偶联以33%的产率得到34。接下来,作者将8a转化为有机锌试剂,在钯催化下与芳基溴发生Negishi偶联,可以以40-51%的产率得到相应的偶联产物35-39(Scheme 3C)。作者合成40的最初想法是想得到复杂螺环双环[2.1.1]己烷42。然而,反应除了生成了预期的螺环双环[2.1.1]己烷42(35%)以外,还以25%的产率生成了光-ene过程产物43,且dr > 20:1(Scheme 4A)。此外,利用环丁烷44反应可以以80%的产率得到单一的螺环双环[2.1.1]己烷产物45。而利用环己烯47反应的主要产物是光-ene产物49(60%),而48仅有7%。作者认为反应通过光敏化、5-exo-trig环化以及ISC或自由基重组得到双环[2.1.1]己烷42,或者通过1,5-氢原子转移得到环戊烷产物43。在环丁烷44的反应中,交叉[2+2]-环加成产物的形成可能是由于在46形成的过渡态中产生了环张力,这不利于光-ene反应途径,从而得到产物45。作者认为41为控制反应活性和选择性的关键中间体(Scheme 4B)。且作者推测,定域的苄基自由基对促进HAT过程是至关重要的,而使用非定域的烯丙基自由基可以改变产物的选择性。当作者使用50反应时,可以以53%的产率得到51,却仅得到了痕量的52,从而证明了这一假设(Scheme 4C)。基于最优反应条件,作者对光-ene过程的底物范围进行了考察(Scheme 5)。实验结果表明,不同取代的芳基以及炔基和酯基取代均具有良好的兼容性,以48-70%的产率得到相应的产物49-63。基于Scheme 4和Scheme 5的研究结果,作者提出了预测反应性的准则:(1) HAT过程需要末端烯烃的偕二取代;(2)光-ene的过渡态环张力将促进交叉[2+ 2]-环加成过程发生;(3)自由基的离域将有利于交叉[2+ 2]-环加成过程。 除了环外末端烯烃以外,作者还对环内烯烃的兼容性进行了考察(Scheme 6)。在这些例子中,光-ene和交叉[2 + 2]-环加成过程是竞争的,因为两者都形成了相当数量的相应产物。值得注意的是,产物中具有较大张力的三环-[3.3.0.0]辛烷66、68和70都是较为罕见的。最后,为了证明光-ene反应的实用性,作者对产物61进行了衍生化(Scheme 7)。61可以通过脱硼化以41%的产率得到了1,3-反式环戊烷产物72。此外,61的Bpin还可以通过氧化以84%的产率得到相应的醇71,且其通过进一步DMP氧化可以以99%的产率得到酮73。Christophe Salome与M. Kevin Brown课题组通过交叉[2+2]-环加成反应实现了一系列硼化双环[2.1.1]己烷的合成。此外,通过对C−B键的转化,可以实现一系列其它方法难以合成的结构骨架。值得注意的是,作者还利用光-ene反应高非对映选择性的实现一系列三取代硼化环戊烷的合成。 文献详情:
Jarett M. Posz, Neetu Sharma, Paige A. Royalty, Yanyao Liu, Christophe Salome* Thomas C. Fessard, M. Kevin Brown*. Synthesis of Borylated Carbocycles by [2 + 2]-Cycloadditions and Photo-Ene Reactions. J. Am. Chem. Soc., 2024, https://doi.org/10.1021/jacs.4c01557.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn