- 首页
- 资讯
董广彬课题组Nat. Catal.:铑催化非张力芳基-芳基键的分裂交叉偶联反应
来源:化学加原创 2024-04-08
导读:近日,美国芝加哥大学(University of Chicago)董广彬课题组发展了一种分裂(split)交叉偶联策略,通过将常见的2,2'-双酚的非张力芳基-芳基键进行“切割”,使其可以与不同的芳基碘化物进行双芳基化发反应。该反应由铑催化,并由可移除的亚磷酸酯导向基团和有机还原剂四(二甲胺)乙烯来促进。实验和计算研究表明反应涉及一个由Lewis酸助催化剂加速的还原消除步骤。值得注意的是,此偶联策略在非对称2,6-二芳基化苯酚的模块化和简化合成中以及苯基单元的骨架插入中得到了应用。相关成果发表在Nat. Catal.上,文章链接DOI:10.1038/s41929-024-01120-9。
(图片来源:Nat. Catal.)
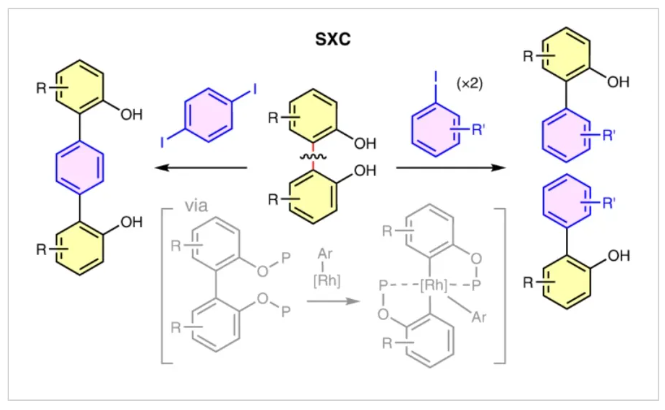
非张力芳基-芳基键是有机分子中最稳定的共价键之一。虽然它们广泛存在于一系列天然产物和合成化合物中,但芳基-芳基键很少可以作为官能团化的活性位点来参与化学转化。由于此类化学键的非极性性质使得它们难以与亲核试剂或亲电试剂反应,并且在非张力双芳基化合物中,较高的键解离能(≥110 kcal mol−1)并不会促进自由基介导的官能团化反应发生。迄今为止,非张力芳基-芳基键的断裂通常是在氢化和复分解反应中才能实现(Fig. 1a)。然而,通过这些惰性化学键的有效转化来得到有用的结构骨架仍然是一个重大的挑战。下载化学加APP到你手机,收获更多商业合作机会。杂环联芳烃广泛存在于药物、农用化学品和有机材料的核心骨架中。而过渡金属催化的交叉偶联反应是制备杂环联芳烃骨架的重要手段。传统的交叉偶联反应通常涉及两个预先官能团化的芳烃底物以等摩尔比相互反应(Fig. 1b)。最近,美国芝加哥大学董广彬课题组发展了一种新的交叉偶联反应模式。其通过将简单易得的2,2’-双酚所衍生的双芳基底物进行“切割”,并与两当量的共同芳基卤化物实现偶联从而得到相应的杂联芳基产物。值得注意的是,这种所谓的分裂交叉偶联(split cross-coupling, SXC)反应是通过铑催化非张力芳基-芳基键的活化而实现的。实现此SXC过程的关键是如何选择性的控制反应每个阶段被活化的化学键(Fig. 1c)。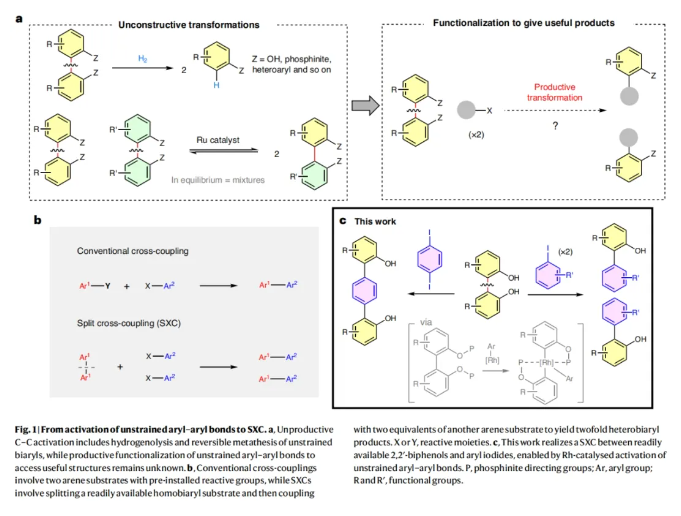
(图片来源:Nat. Catal.)
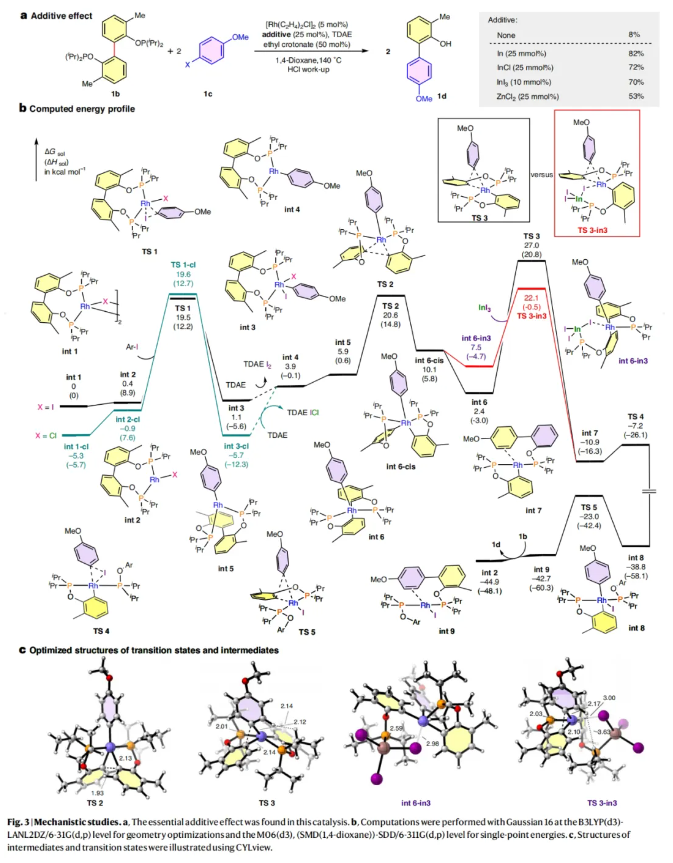
接下来,作者选择双磷酸酯底物1b和4-碘-苯甲醚1c作为模板底物对反应条件进行了筛选(Table 1)。当使用1b (0.1 mmol), 1c (0.5 mmol), [Rh(C2H4)2Cl]2 (5 mol%), In (25 mol%), TDEA (tetrakis(dimethylamino)ethylene) (0.3 mmol), 丁烯酸乙酯(50 mol%),在1,4-二氧六环中,140 oC反应,并用HCl后处理可以以82%的核磁产率,72%的分离产率得到芳基化的苯酚产物1d(entry 1)。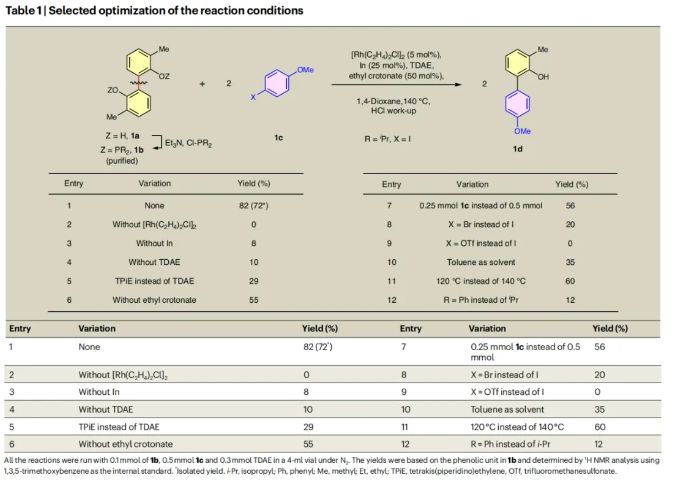
(图片来源:Nat. Catal.)
在得到了最优反应条件后,作者对此转化的底物范围进行了探索(Fig. 2)。实验结果表明,一系列不同取代的2,2’-双酚化合物和芳基碘化物均可顺利实现此转化,以40-88%的产率得到相应的偶联产物1d-46d(52-91%)。其中2,2’-双酚化合物可以兼容氯(10d和14d)、溴(16d)、氟(11d和14d)、酯基(9d)、苄基(6d)、保护的醇(13d)和噻吩(12d)等基团。此外,甲氧基醚(20d和27d)、叔胺(46d)、酮(19d和39d)、腈(32d)、三氟甲基(45d)、氯(22d和40d),溴(35d),氟(43d),酯基(31d),三氟甲氧基(25d)、炔基(33d)、烯烃(34d)、硅醚(40d)以及噻吩(36d)、吲哚(37d)、喹啉(38d)、吡唑(41d)、咔唑(44d)等杂芳烃和萘(30d)、芴(42d)等多环芳烃均可顺利兼容。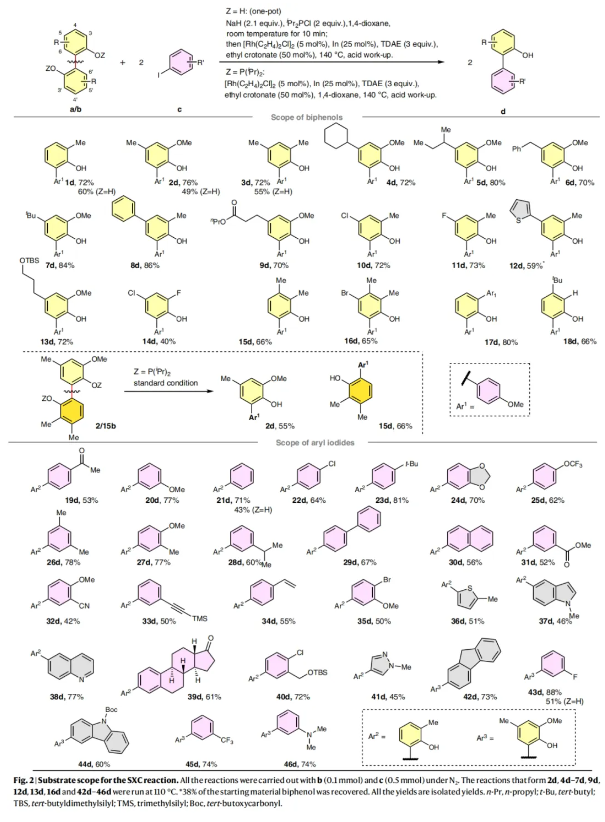
(图片来源:Nat. Catal.)
接下来,为了深入理解反应机理,作者进行了控制实验和DFT计算(Fig. 3):控制实验表明,除了In之外,其它的金属催化剂如InCl, InI3和ZnCl2也可实现此转化,可能是由于In的Lewis酸形式可以促进铑催化剂的循环(Fig. 3a)。DFT计算表明(Fig. 3b):反应首先通过由[Rh(C2H4)2Cl]2与双亚膦酸酯1b络合得到的氯化铑二聚体int 1-cl解离得到铑单体int 2-cl,此过程吸收4.4 kcal mol−1的热量。在其与对碘苯甲醚1c发生氧化加成后,过量的TDAE可以将双亚膦酸酯配位的苯基铑(III)二卤化物还原为苯基铑(I)物种。随后通过C(芳基)-C(芳基)键的旋转和配体的异构化(int 4到int 5),两个亚膦酸酯导向基团由顺式转变为反式,从而缩短了金属铑与C(芳基)-C(芳基)键之间的距离。接下来,C(芳基)-C(芳基)键发生氧化加成,相对于int 3-cl的静息态,此过程的活化能垒为26.3 kcal mol−1。C-C键活化后,通过int 6-cis向int 6的无障碍异构化减小了苯甲醚和邻酚基团之间的键角。在没有Lewis酸的情况下,C-C还原消除(TS 3)展现出较高的能垒(32.7 kcal mol−1)。随后的几何学分析表明,苯甲醚上的H与亚膦酸酯导向基团上的异丙基之间的距离较短(2.14 Å)是导致活化能增加的原因(Fig. 3c)。总体来讲,计算结果表明该反应在热力学上是有利的(44.9 kcal mol−1),且第一个C-C还原消除可能是反应的周转限制步骤。由于2,6-二芳基酚常存在于生物相关化合物中,因此作者首先探索了此类SXC反应在2,6-二芳基酚合成中的应用(Fig. 4a)。通过将C-H芳基化反应与SXC反应串联,可以以27-61%的产率得到不同取代的2,6-二芳基酚产物1e-10e。此外,利用此策略可以实现邻位二芳基化酪氨酸的合成,其可以作为重要的砌块来构建不同的肽(Fig. 4b)。目前使用这种C-H/C-C芳基化策略,可以从相同的酪氨酸前体通过三步即可制备出非对称的邻位二芳基化酪氨酸。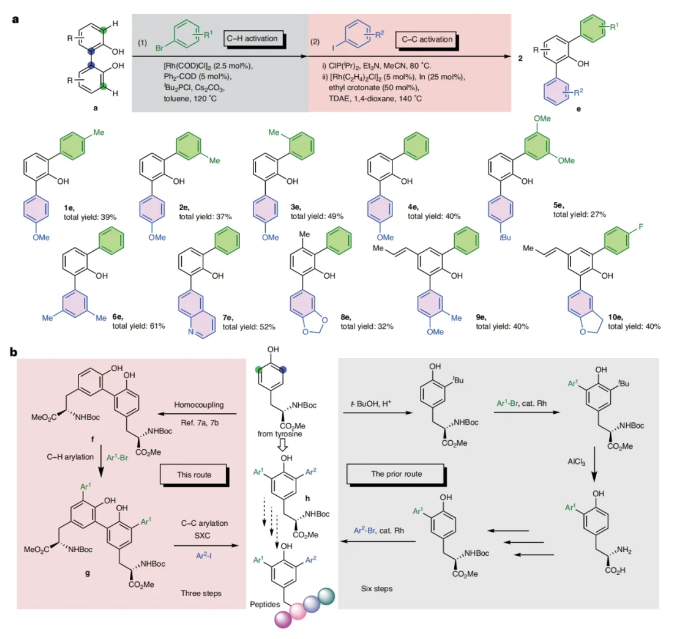
(图片来源:Nat. Catal.)
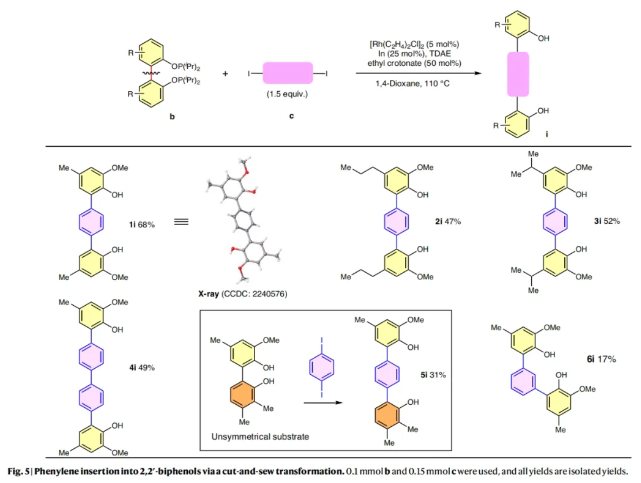
除了分裂偶联之外,作者利用芳基二碘化物作为反应试剂也可以实现cut-and-sew类型的转化,这为通过插入苯基单元来实现惰性芳基-芳基键的编辑提供了一种独特的方法(Fig. 5)。实现此转化的关键是在第一次偶联后产生的单芳基碘化物中间体要比双碘化物反应物更具反应活性。实验结果表明,在标准反应条件下,无论对称的双酚底物还是非对称的双酚底物均可顺利实现转化,以17-68%的产率得到相应的产物1i-6i。董广彬课题组发展了铑催化2,2' -双酚类化合物的SXC反应,实现了基于非张力芳基-芳基键的催化活化以及转化。与传统的交叉偶联反应相比,SXC反应提出了一种概念上的创新,其可以从简单易得的二聚底物合成两倍的联芳基产物。通过与C-H活化相结合,利用此策略还可以实现非对称邻二芳基化酚骨架的构建。此外,此策略还可以通过苯基单元的插入来实现独特类型的骨骼编辑。机理研究所表明Lewis酸添加剂的重要作用,可能对其它C-C活化反应的发展有进一步的影响。文献详情:
Congjun Yu, Zining Zhang, Guangbin Dong*. Split cross-coupling via Rh-catalysed activation of unstrained aryl–aryl bonds, Nat. Catal., 2024, https://doi.org/10.1038/s41929-024-01120-9.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn