

(图片来源:Nat. Chem.)
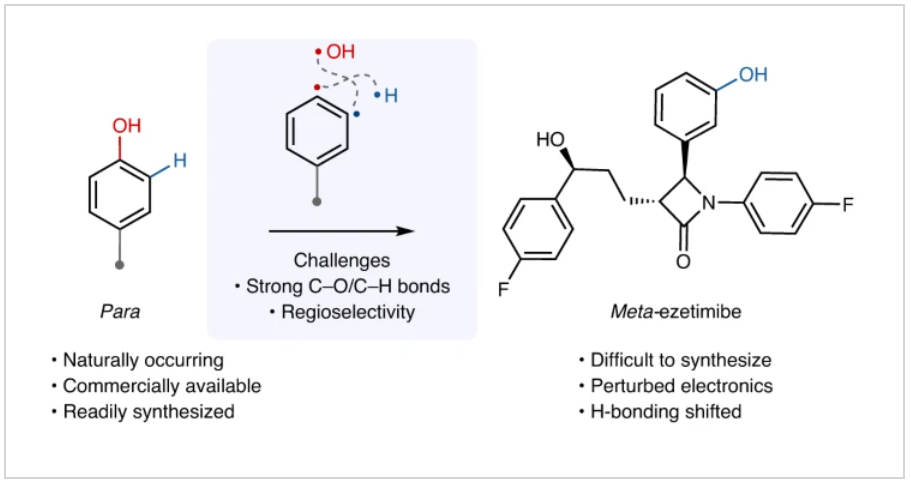
正文
(图片来源:Nat. Chem.)
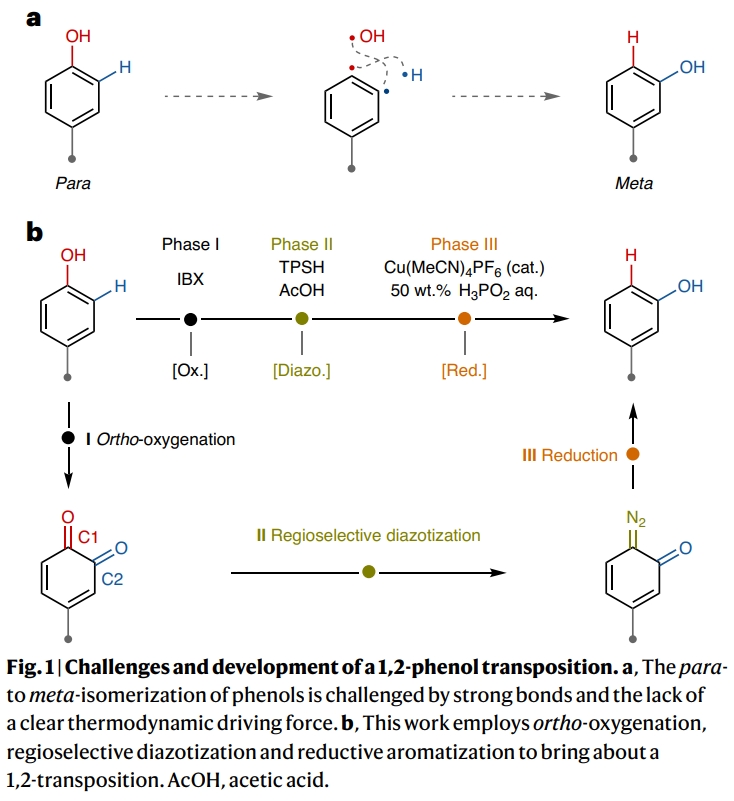
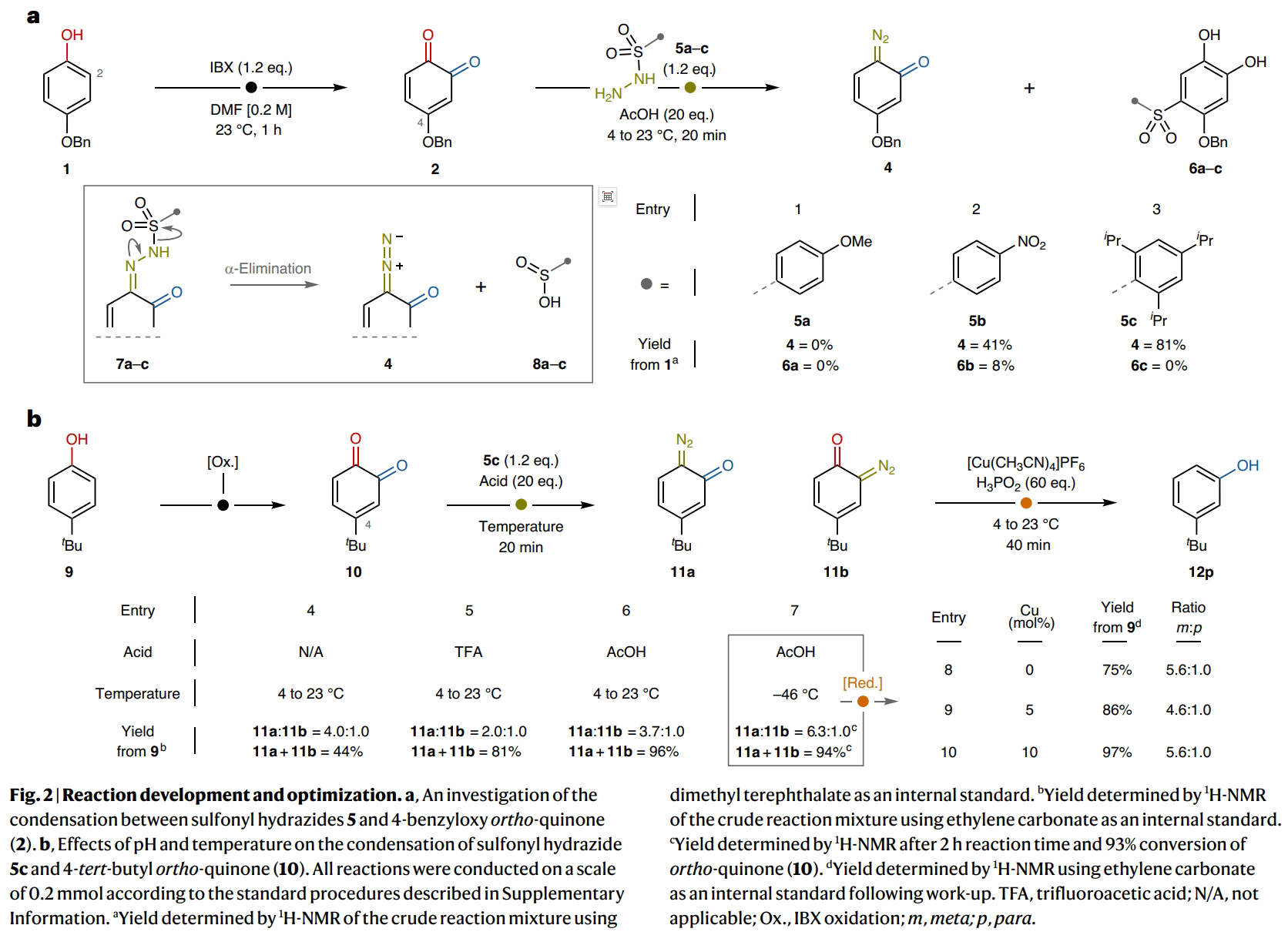
首先,作者以对叔丁基苯酚9作为起始原料对反应进行探索(Fig. 2)。通过一系列条件筛选,作者发现当使用1 (0.5 mmol), IBX (0.6 mmol), 在DMF (2.5 ml)中室温反应1 h;随后冷却至−46 °C并加入TPSH (2,4,6-triisopropylbenzenesulfonyl hydrazide) (0.6 mmol), AcOH (10 mmol), 在DMF (0.75 ml)中反应2 h, 并将体系温度升至4 °C;接下来加入Cu(MeCN)4PF6 (10 mol%), 50% wt. H3PO2 aq. (30 mmol), 室温搅拌 40 min,可以以97%的核磁收率得到间位叔丁基取代的苯酚产物12p (m:p = 5.6 : 1.0)。
(图片来源:Nat. Chem.)
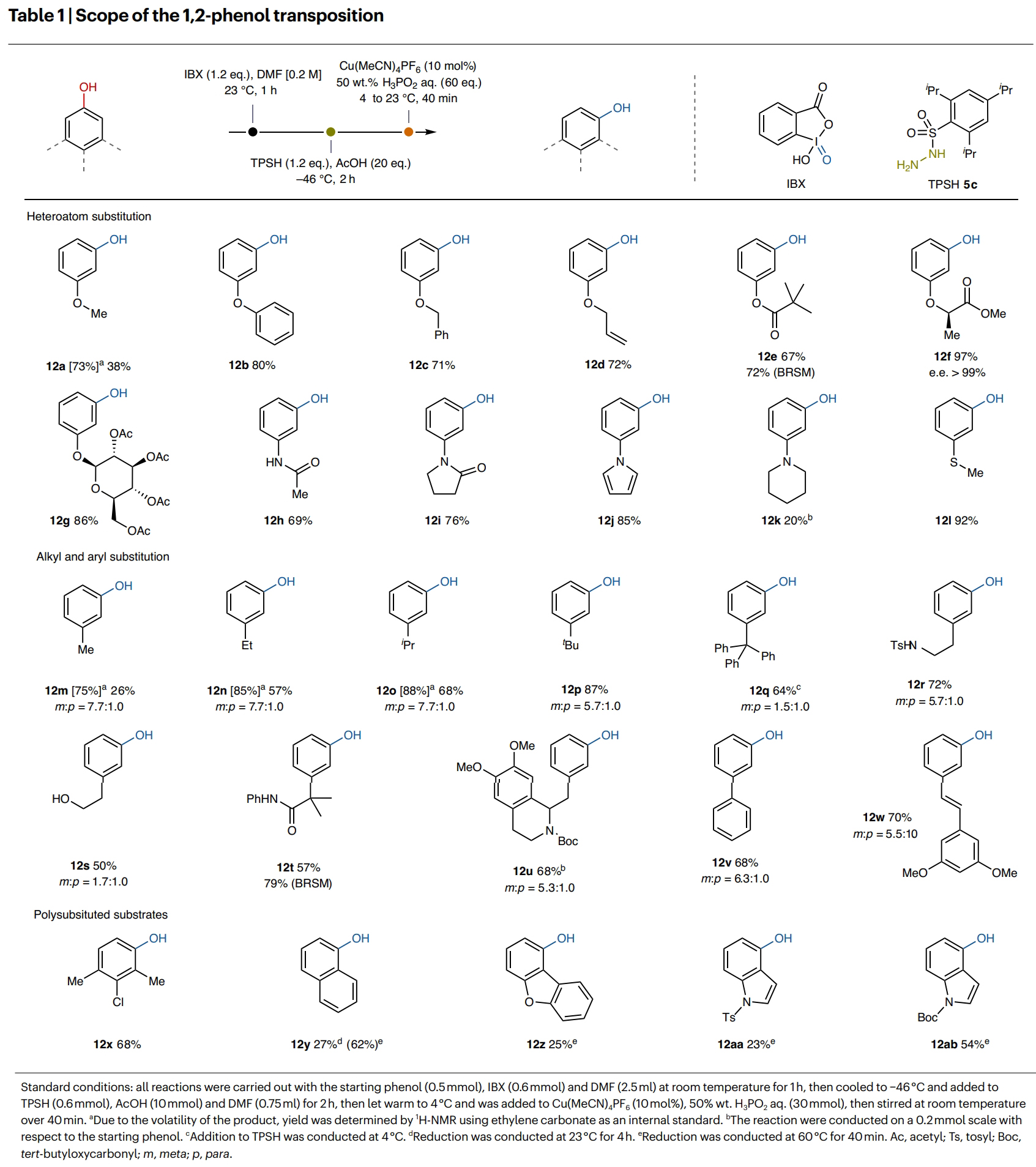
在得到了最优反应条件后,作者对此转化的底物兼容性进行了考察(Table 1)。实验结果表明杂原子取代、烷基取代、芳基取代以及多取代的苯酚均可顺利兼容此转化,并以20-97%的核磁收率得到相应的间取代苯酚产物12a-12z, 12aa, 12ab。其中包括烷基、烷氧基、苯氧基、烯丙基、酯基、酰胺基、糖基、吡咯、哌啶、硫醚、羟基、卤素等一系列骨架和基团均可兼容,证明了此转化具有广泛的底物范围。
(图片来源:Nat. Chem.)
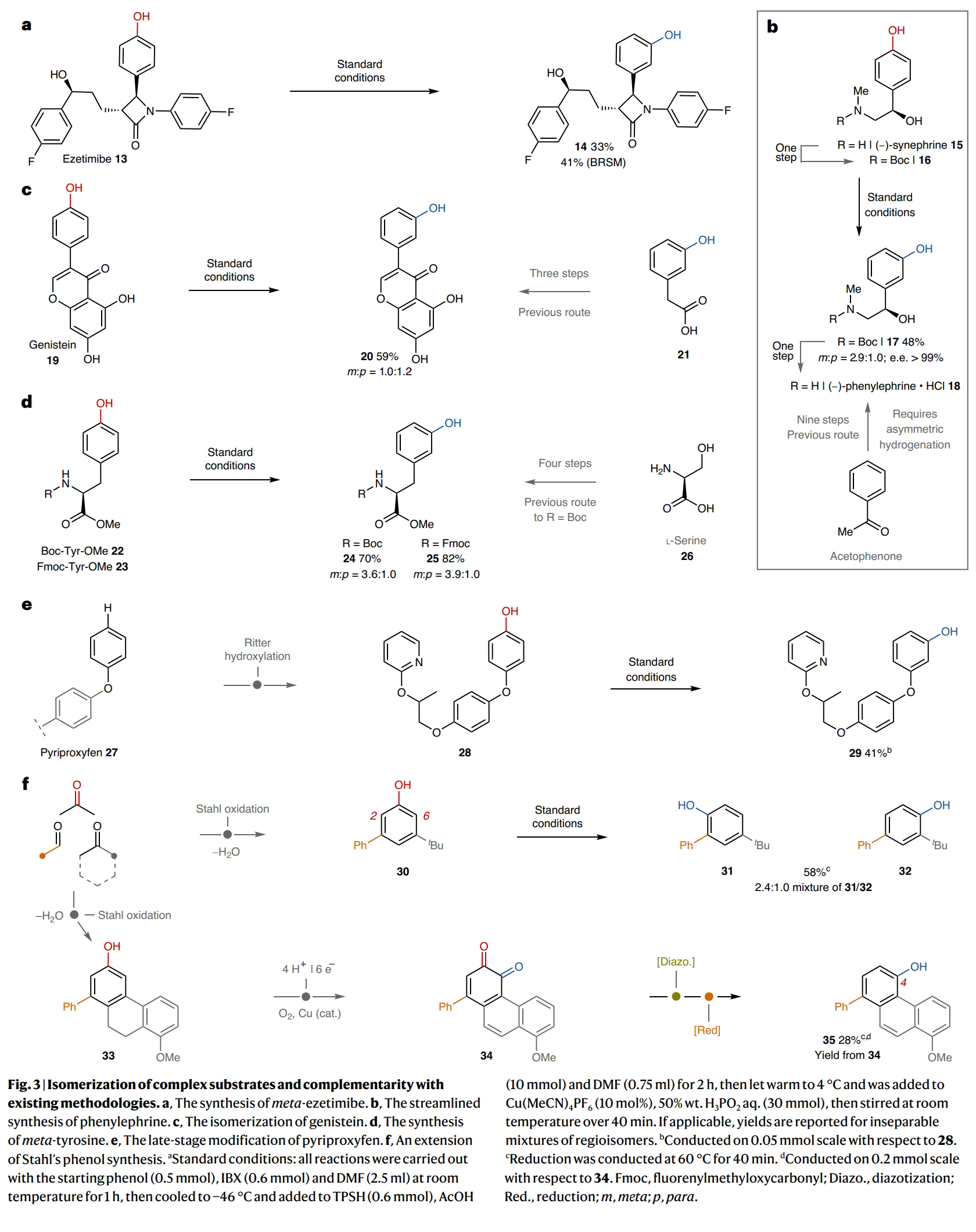
接下来,作者探索了此策略在分子后期异构化的应用(Fig. 3)。例如,依泽替米贝(ezetimibe)(13)是一种常用的降胆固醇药物。尽管间位-依泽替米贝(14)与13具有许多相似的结构特征,但其合成目前尚未有报道。14的制备需要从头合成,其合成路线长度可能与从对羟基苯甲醛制备13所需的8步相当,因此在药物开发过程中可能会被忽视或不优先考虑作为候选药物。而利用此异构化方法可以直接使用13为起始原料,以41%的产率得到相应的间位异构体产物14。由此证明在β-内酰胺和氧化敏感的二级苄醇存在下异构化过程的化学选择性,这为探索常用药物的对位到间位异构化体的生物学效应创造了机会(Fig. 3a)。此外,在某些反应情况下,仅能得到苯酚的对位异构体,而要得到间位异构体则需要重新合成。例如,(R)-phenylephrine (18)是一种α1-肾上腺素受体激动剂,其可以由苯乙酮开始通过不少于9步合成出来,其中包括不对称氢化来构建二级苄醇。由于其对位异构体(R)- synnephrine (15)可以从柑橘中提取,因此通过此方法,可以有效缩短18的合成路线(Fig. 3b)。Genistein (19)是黄酮类天然产物家族的代表成员,其具有一系列生物活性。而利用21通过三步才可以实现其间位异构体20的合成。而利用此方法可以以19为起始原料,一步实现20的合成(59%)(Fig. 3c)。L-酪氨酸及其衍生物很容易从自然资源中获得,但得到自然丰度相对较低的间位酪氨酸则需要从L-丝氨酸(26)开始通过四步实现。而利用此方法可以利用商业可得的Boc-(22)或Fmoc-(23)保护的L-酪氨酸甲酯为起始原料,分别以70%和82%的产率得到间位产物24和25(Fig. 3d)。
由于许多后期官能团化反应可以通过EArS(亲电芳香取代)反应以邻位/对选择性引入苯酚,因此此异构化策略可以将这些方法扩展,为得到互补的间位异构体提供机会。例如,Ritter课题组所报道的对农药pyriproxyfen (27)进行对位选择性羟基化反应,可以专一的得到对位异构体28。利用此策略以28为起始原料,可以41%的产率得到相应的间位异构体29(Fig. 3e)。Stahl课题组通过简单羰基化合物的缩合和有氧氧化,可以实现苯酚的间位取代模式。作者利用Stahl课题组的方法制备出了3-苯基-5-叔丁基苯酚30,并在标准条件下发生异构化,可以以58%的产率得到31和32(2.4:1.0)的混合异构体(Fig. 3f)。最后,作者同样利用Stahl课题组的方法制备出了33,并通过铜催化的有氧氧化和脱氢(34)以及重氮化和还原以28%的产率得到了具有较大立体位阻的4-菲酚产物35。
(图片来源:Nat. Chem.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn