

四取代烯烃的催化不对称硼氢化面临诸多挑战。首先,四取代烯烃的位阻极大,很难与催化剂结合,导致反应活性非常低;其次,由于具有更多的取代基,烯烃的侧链对反应路径的影响更复杂,烯烃区域异构、E/Z异构及其他位点反应等竞争过程更有可能发生;此外,四取代烯烃转化中同时控制区域选择性和对映选择性极为困难。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
近日,清华大学李必杰团队联合浙江大学洪鑫团队,使用配位辅助策略(Acc. Chem. Res. 2023, 56, 308),发展了高效的催化体系,通过调控配体结构抑制副反应路径,实现了铑催化的四取代烯烃的高区域及对映选择性硼氢化反应,构建具有连续的三级-四级手性中心的有机硼酸酯。文章发表在JACS(10.1021/jacs.4c04108)上,并被选为Editors' Choice。
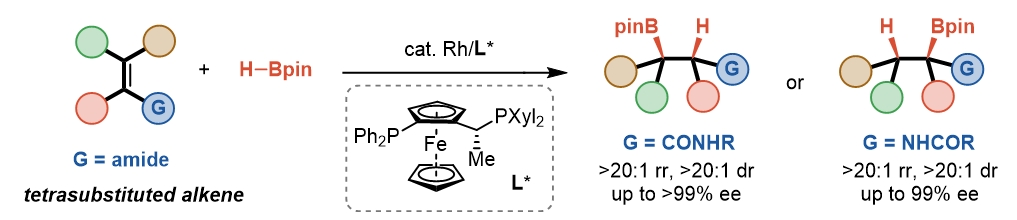
图1. 四取代烯烃的不对称硼氢化
在条件优化中,作者发现配体的作用极为关键。以Rh(NBD)2OTf为催化剂,使用大多数配体时,仅得到烯烃还原产物。在Josiphos配体L*的存在下,选择性发生逆转。在0 °C下能以93%的产率,单一的区域选择性和>99% ee获得目标产物。
底物范围探索中,作者发现酰胺氮上的取代基对反应结果几乎没有影响,一系列带有不同结构的胺片段的底物都能在该体系下顺利发生硼氢化反应。带有卤素、杂环、醚、酚、磺酸酯、碳碳双键等官能团的四取代烯烃均能成功实现硼氢化反应,并保持高的区域选择性和立体选择性。该反应对烯烃的位阻较为敏感,除了羰基α-乙基取代底物之外,其他位置的更大位阻取代底物都难以发生反应(图2)。
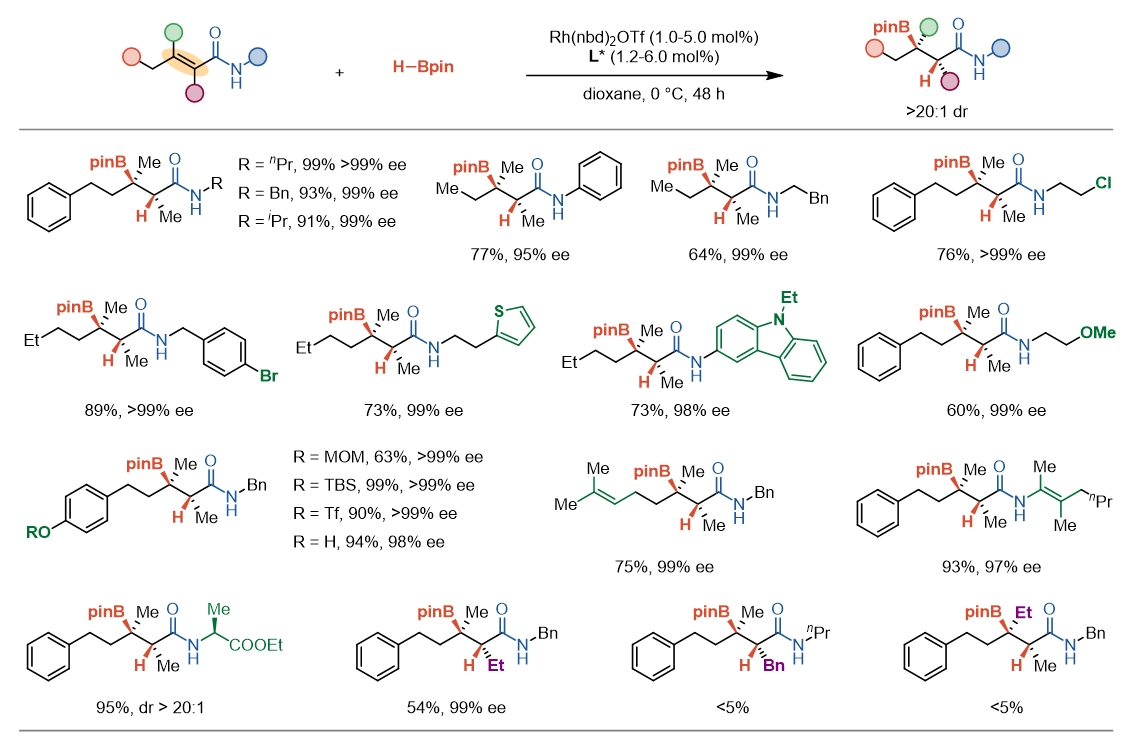
图2. 四取代α,β-不饱和酰胺不对称硼氢化(部分底物)
利用同样的配位辅助模式,在相同的反应体系下,作者还实现了结构及电性截然不同的四取代烯基酰胺的不对称硼氢化反应。该反应同样具有极高的立体选择性,能够在高产率和广泛的底物兼容性下,实现具有不同酰基、不同官能团的四取代烯酰胺的不对称硼氢化,获得手性α-氨基硼酸酯(图3)。
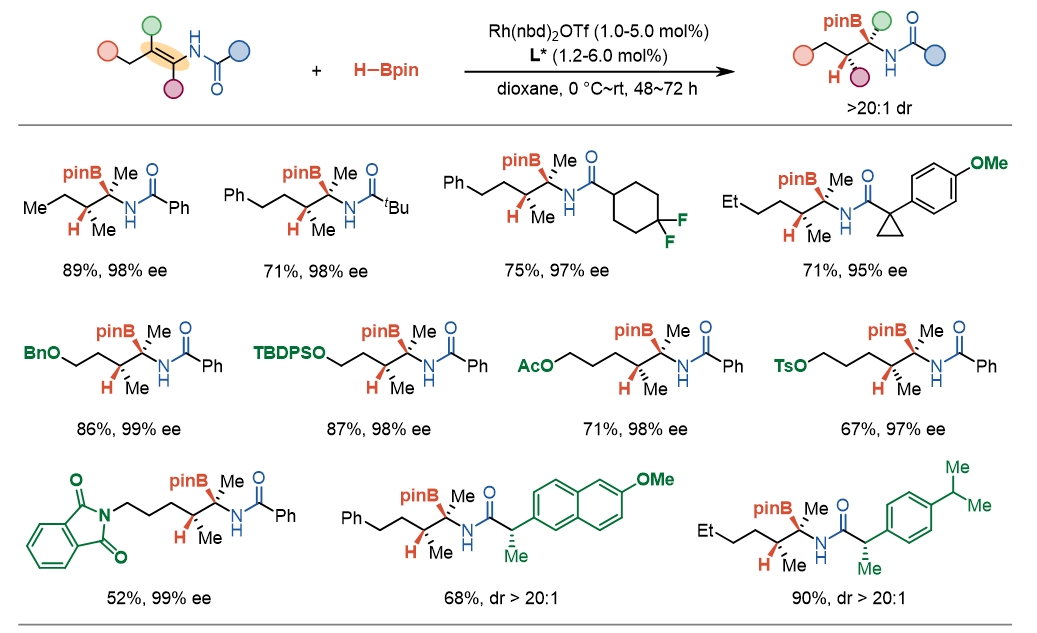
图3. 四取代烯基酰胺不对称硼氢化(部分底物)
DFT计算研究表明,还原消除是反应的决速步。在优势路径中,配体Xyl苯环上的H原子与Bpin中的O原子之间存在较强的C–H···O相互作用,从而有效地降低了该过渡态的能量;而在不利路径中,尽管也具有类似作用,但原子之间距离更远、作用强度更弱,并且配体与底物间较强的位阻排斥使得这一路径的过渡态能量更高(图4)。

图4. DFT计算和过渡态结构分析
小结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn