


正文
近年来,NHC有机催化的自由基反应已经成为发现具有挑战性和创新性反应的重要平台,为有机催化的自由基合成开辟了一条全新途径。成都大学李俊龙教授团队一直致力于有机催化新反应的研究,近年来利用NHC有机小分子催化的自由基反应,实现了烯烃的氟烷基酰基化反应(Angew. Chem. Int. Ed. 2020, 59, 1863-1870);利用其发展的氧化NHC自由基催化体系,完成了烯烃的双羰基化和烷基酰化反应(Angew. Chem. Int. Ed. 2022, 61, e202207824);结合1,5-HAT策略,完成了酰胺远端C-H键的直接酰化反应(Angew. Chem. Int. Ed. 2022, 61, e202116629);除了对sp3碳氢键的活化外,该团队近期还巧妙应用氮自由基作为定位基,实现了超远端sp2碳氢键的官能团化(Nat. Catal. 2024, doi: 10.1038/s41929-024-01194-5. 成都大学李俊龙课题组Nature Catalysis: NHC催化的超远端芳基CH位点选择性酰化反应);通过NHC/PC双催化体系,实现了硼酸盐与酰基氟化物的偶联反应(Chem. Sci. 2022, 13, 2584-2590),烷基硼酸与酰基咪唑间的交叉偶联(ACS Catal. 2024, 14, 3181–3190),以及结合1,2-硼迁移,合成一系列β-酰基硼化合物(Sci. Adv. 2024, doi: 10.1126/sciadv.adn8401,Science Advances:光加速的NHC催化1, 2-硼迁移酰化反应)等。此外,该团队还利用氮杂环卡宾的双电子途径,实现了非活化卤代烷烃的直接酰化反应(Angew. Chem. Int. Ed. 2023, 62, e202309572,成都大学李俊龙课题组Angew:氮杂环卡宾(NHC)催化非活化烷基卤化物与醛的直接酰化反应)。
最近,该团队在NHC催化的自由基反应研究中取得了新进展:以酮为起始原料,经过预活化,将该中间体置于NHC/光双催化体系中,以促进C-C键的裂解和随后的再酰化过程,得到多种酮类产物。该体系可以实现“酮到酮”的催化转化,进而实现了一种形式的“酮的分子编辑”。该策略能够对酮类化合物进行任意修饰,克服了传统方法对底物的高度依赖、修饰位点局限以及制备步骤复杂等缺点。本工作完成了一系列常规方法难以实现的酮类化合物的多样性修饰,丰富了NHC自由基催化的反应类型,为具有复杂架构的酮类化合物的制备提供了一个绿色、简洁、通用的方法。成都大学特聘研究员李青竹博士和2022级硕士研究生何美浩同学为本论文的共同第一作者,李俊龙教授为该论文的通讯作者。
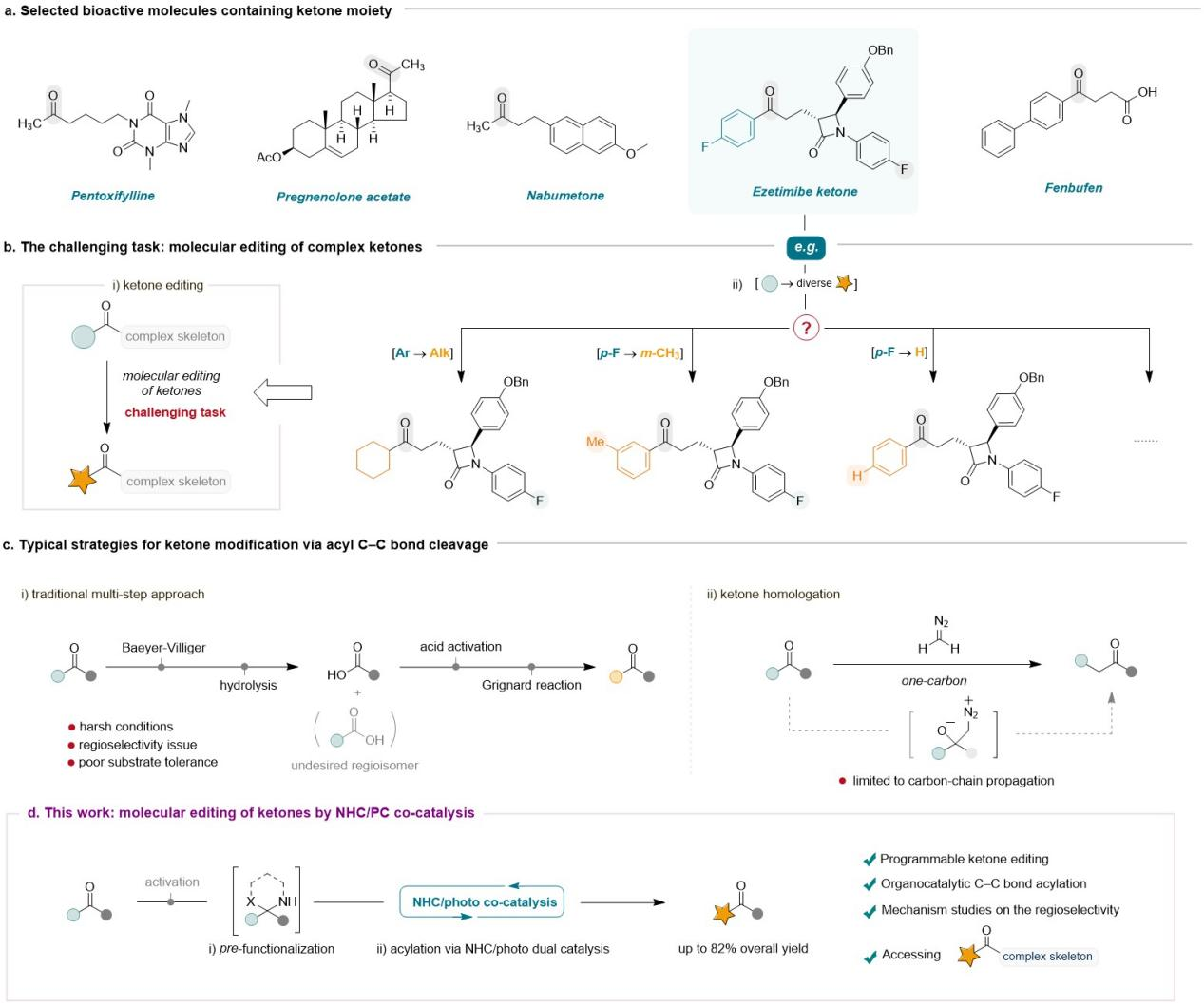
Figure 1. Background and research motivation for molecular editing of ketones.
该团队首先以简单甲基酮1a为起始底物,与邻氨基苯甲酰胺快速缩合完成预活化,得到中间体2a;随后,将该中间体2a与底物3a作为模板底物,通过大量的条件筛选发现:在蓝色LED灯照射下,采用氮杂环卡宾N1为有机催化剂,4CzIPN(PC1)作为光催化剂,K2CO3作碱,琥珀酰亚胺作为离去基团,MeCN作为溶剂时反应效果最佳,能以83%的产率得到苯基酮4。
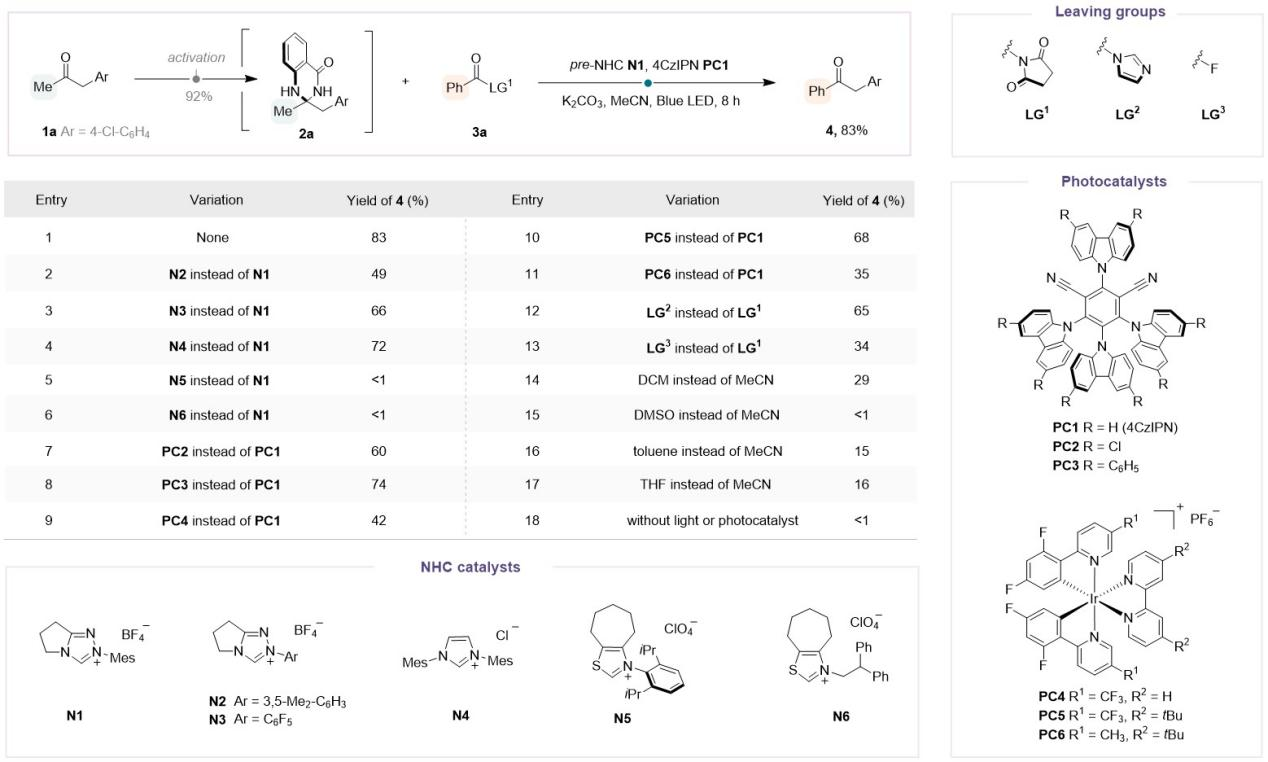
Figure 2. Reaction development.
令人欣慰的是,该反应策略具有广泛的底物普适性。就琥珀酰亚胺类底物而言,在其对位、间位或邻位上具有吸电子或给电子取代基、稠环或杂环类的底物3都能顺利进行反应;直链烷基、环烷基以及具有药物骨架取代的底物3也都能与该催化体系兼容。随后,该团队测试了甲基酮上的不同烷基侧链,发现苄基、直链、含有α-杂原子的烷基都能顺利参与反应;此外(杂)环烷基、非环状仲烷基以及叔丁基也可以顺利进行反应。
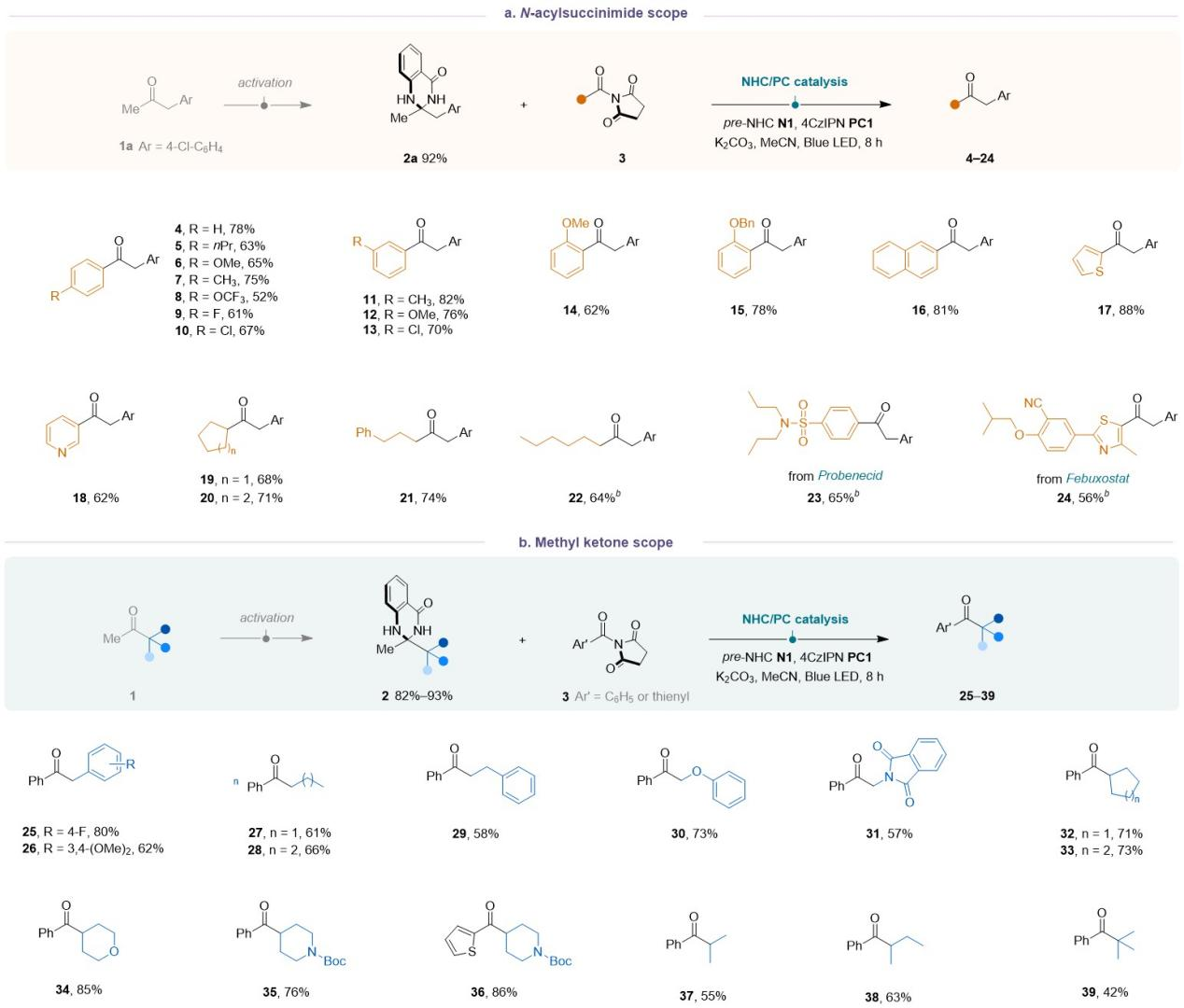
Table 1. Substrate scope of N-acylsuccinimide and methyl ketone substrates.
该团队进一步展示了此策略的合成有用性。实验结果表明烷基酮不仅可以转化为芳基酮,也可以延长其烷基链,从而实现酮的同系化反应;大量的芳基酮很容易转化为相应的烷基酮;更有趣的是,这种方法允许在酮上进行芳基部分的“微雕”。例如,不同的取代基可以精确地“安装”在苯环的任何位置,从而形式上实现惰性芳基C-H键的选择性功能化;使用该策略也可以“删除”位于对位、间位或邻位上的各种芳基取代基,芳基取代基也可以在苯环上“易位”;这种策略还能促进杂芳烃转化为烷基或芳基,并能够从杂芳烃中“删除”取代基。此外,该方法可以很容易地实现杂芳烃的骨架编辑,如可以实现呋喃和噻吩之间的快速转化。
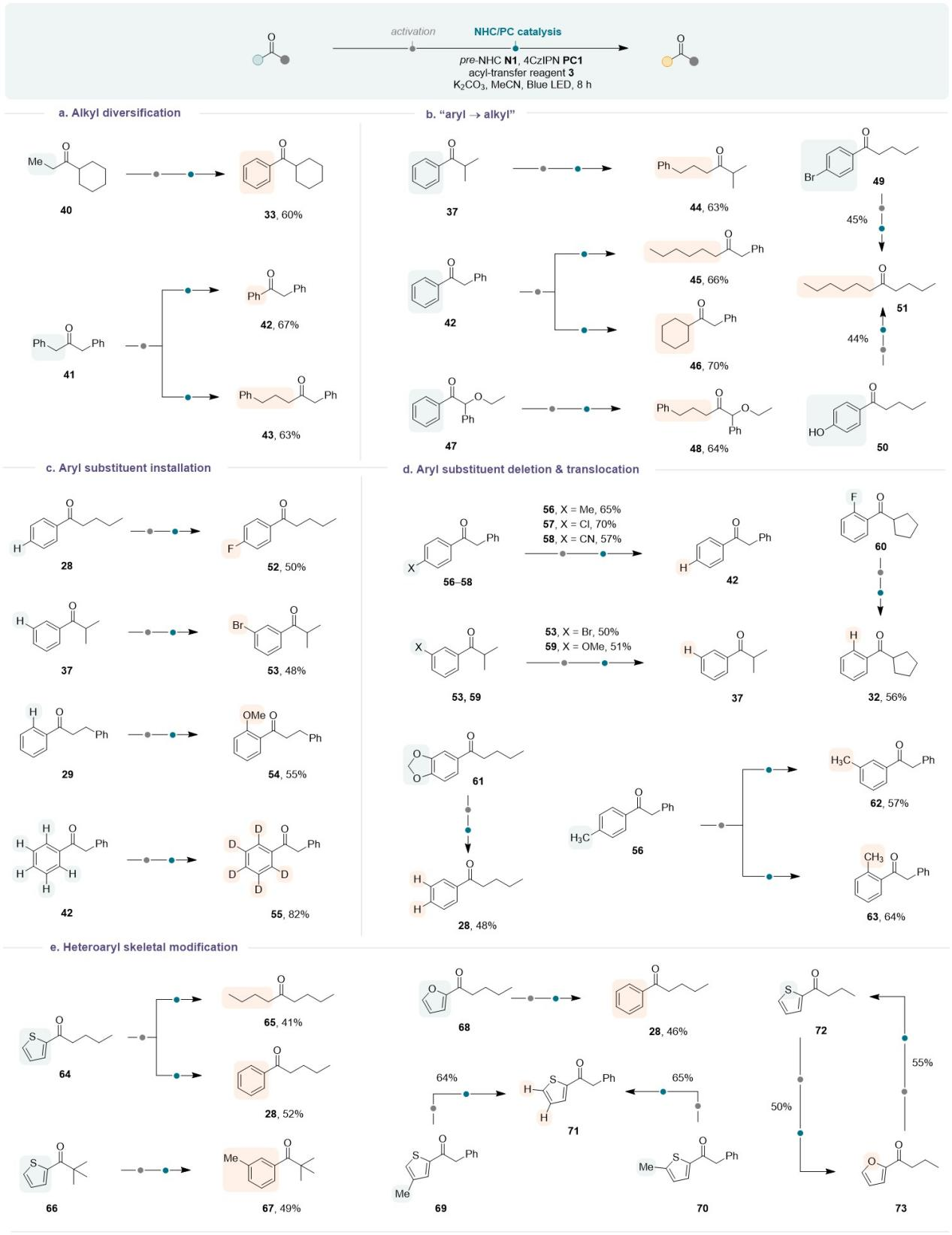
Table 2. Further demonstration of the synthetic significance of this method
该催化体系反应条件温和,不仅具有广泛的底物普适性,还具有重要的药学研究价值。可直接用于多种酮类药物和生物活性分子的官能团后修饰,如非甾体抗炎药物萘丁美酮(Nabumetone)、芬布芬衍生物(Fenbufen derivative)、食品添加剂β-二氢紫罗兰酮(Dihydro-β-lonone)、血管扩张药物己酮可可碱(Pentoxifylline)、甾体类活性化合物孕烯醇酮醋酸酯(Pregnenolone acetate)、胆固醇吸收抑制剂依折麦布酮(Ezetimibe Ketone)等。
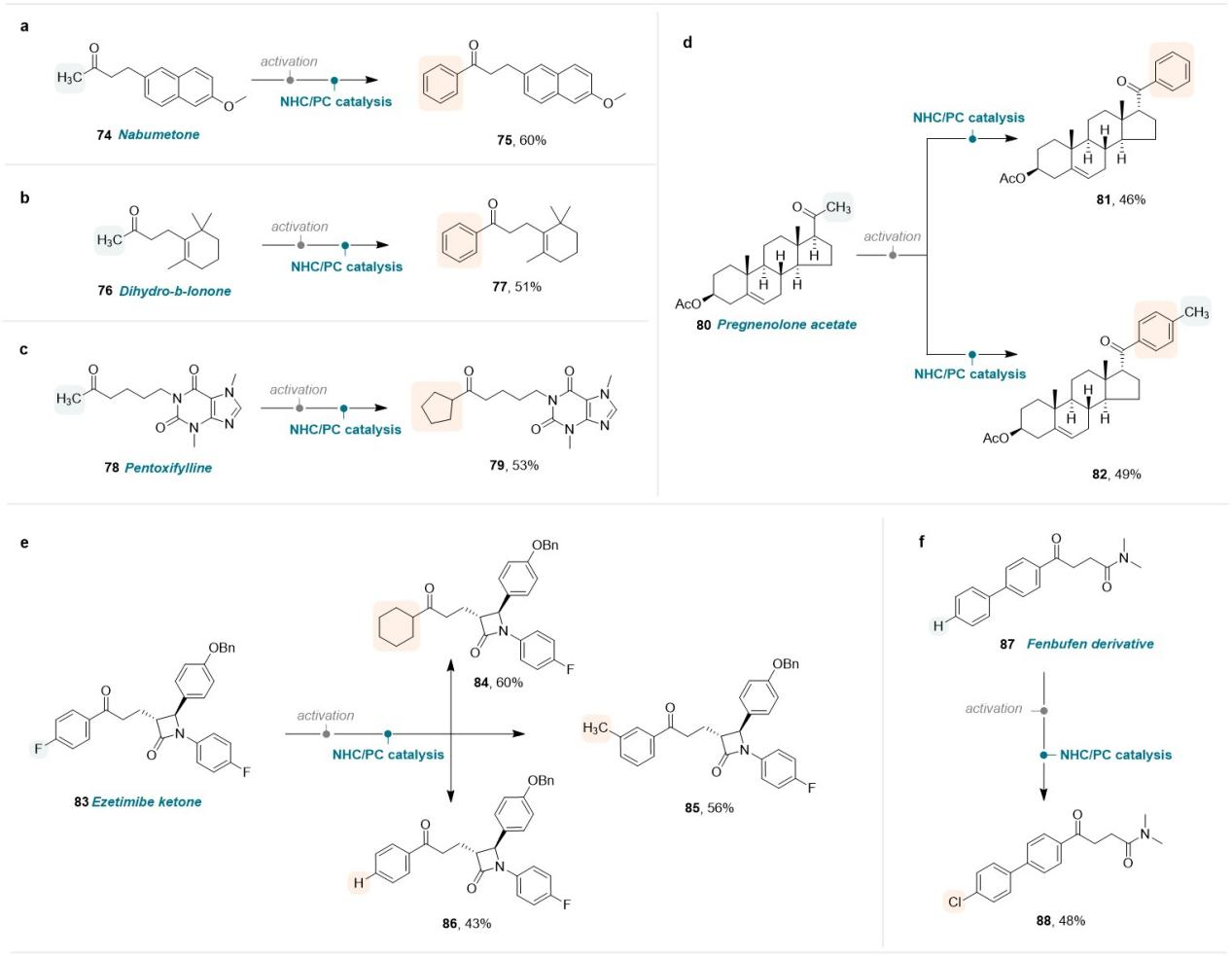
Figure 3. Late-stage modification of drugs and bioactive molecules.
上述“酮的分子编辑”策略能够进行放大反应,使用“一锅法”也能很顺利的进行反应。利用不同异丙基酮底物(89、53和1b)的混合物,可以同样使用“一锅”法进行汇聚式反应,能得到相同的酮产物37。该反应体系能够允许酮两侧的侧链都进行交换,产生一个结构完全不同的酮。上述实验都进一步彰显了本方法的合成实用性。
为了研究这种催化转化的反应机理,作者进行了详细的机理研究。首先,自由基抑制实验和自由基钟实验表明:该催化反应可能涉及苄基自由基和与NHC结合的酮基自由基。使用预先合成的酰基唑95也可以获得目标产物4,表明NHC有机催化体系原位生成的酰基唑鎓应该是NHC/PC催化反应的关键中间体。开关灯实验和量子产率的测定表明该反应经历了光催化自由基过程,而非链式反应过程。
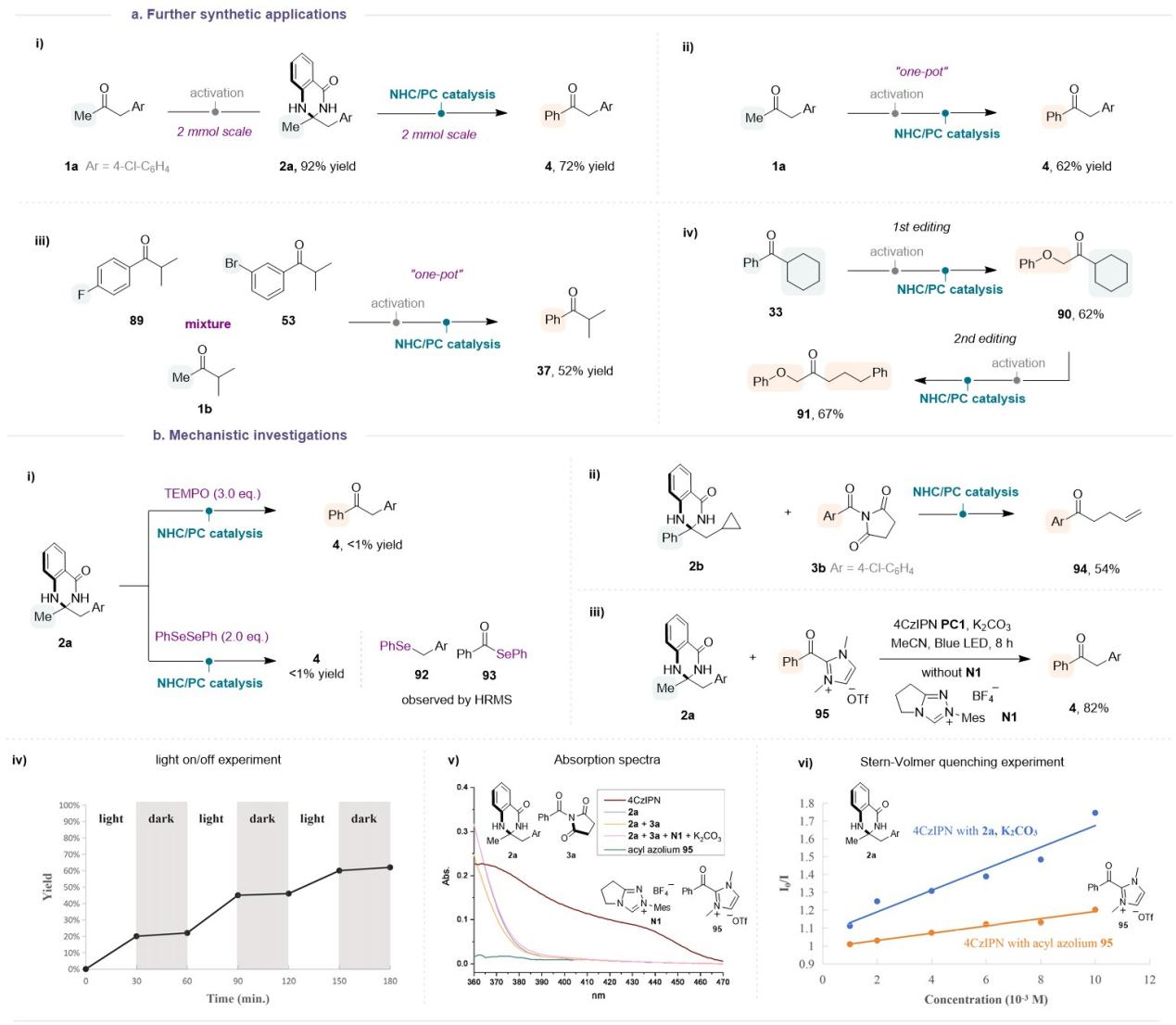
Figure 4. Further synthetic applications and mechanistic investigations.
基于以上研究,作者提出了该催化反应可能的机理。首先,4CzIPN光催化剂在蓝色LED灯照射下被激发,并与来自酮底物的中间体2进行SET过程,产生自由基物种4CzIPN·-和自由基阳离子I,I的脱质子化导致N自由基物种II的形成,随后形成喹唑啉酮副产物和以C为中心的自由基III。同时,酰基唑鎓IV由NHC和3a原位产生,其可以从4CzIPN·-接受电子,产生持久性自由基V。然后自由基III和自由基V之间发生交叉偶联,释放出酮产物。
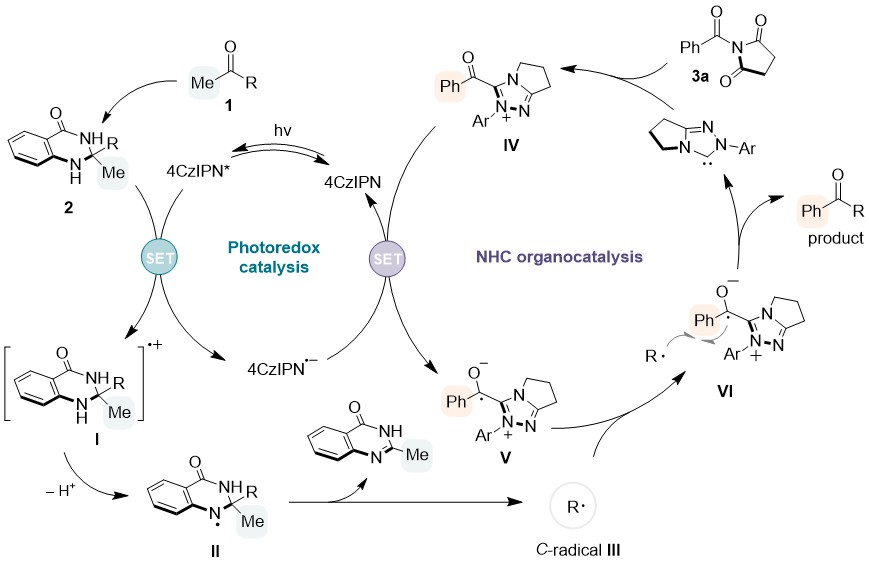
Figure 5. Proposed mechanism for the NHC/PC dual catalytic reaction.
更为重要的是,该团队进一步通过控制实验和密度泛函理论计算,揭示了区域选择性的规律,并凝练出反应中自由基产生的优先顺序为:苄基>O-稳定自由基>仲碳自由基>伯碳自由基>甲基/苯基自由基,为未来发展可编程的合成方法提供了理论参考。
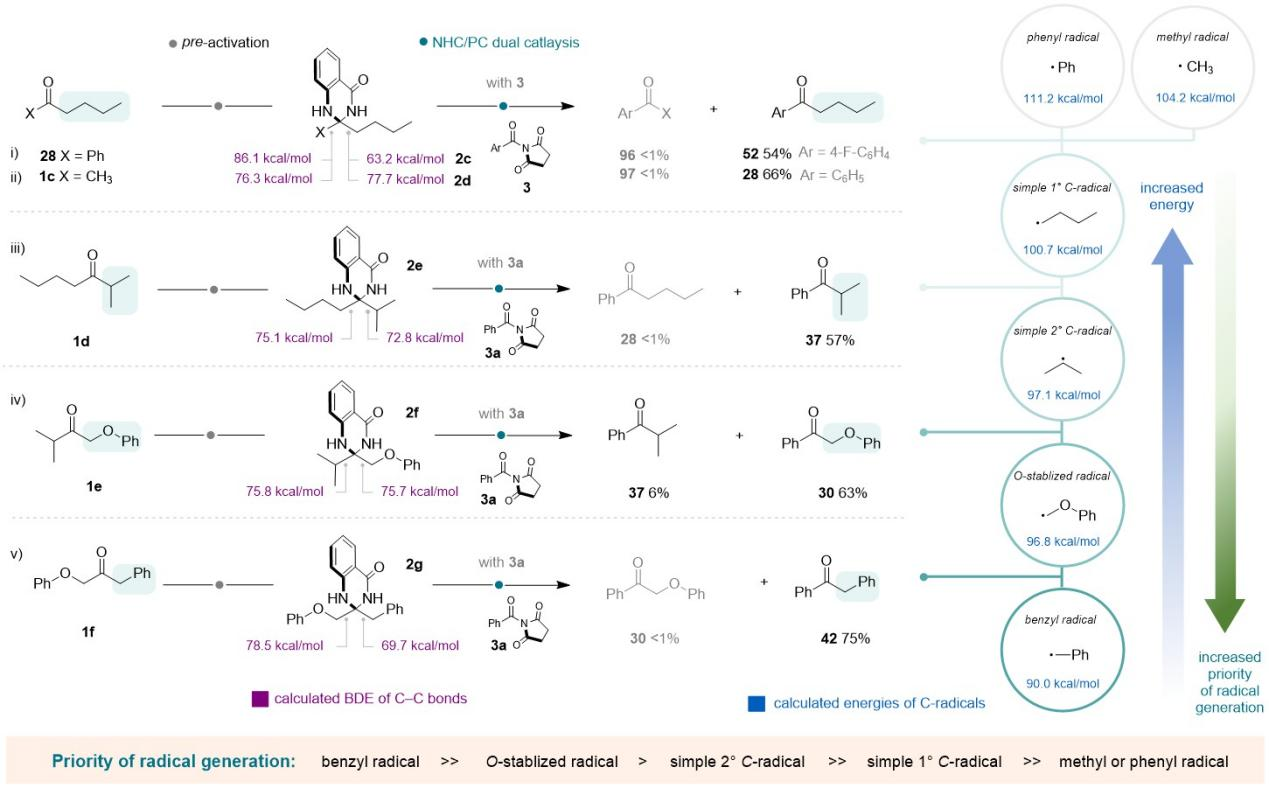
Figure 6. Studies on the regioselectivity to understand the rule of C-C bond cleavage.
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn