

四氢-b-咔啉 (Tetrahydro-b-carboline, THbC) 是一类重要的含氮化合物,广泛存在于天然产物和活性分子中。该类结构具有显著的生理活性,其中一些化合物被作为药物使用,如利血平 (Reserpine)、育亨宾 (Yohimbine)和他达拉非(Tadalafil)等 (图1)。THβC独特的结构和显著的活性已经吸引了众多研究者的目光,特别是在不对称催化合成领域。目前在不对称催化合成THbC衍生物方面存在一些挑战,首先是如何构建具有连续手性中心的THbC衍生物,特别是与C1直接相连的手性中心,目前主要通过分步反应合成,存在非对映选择性差的问题。其次是如何合成含有C1季碳手性中心的1,1-二取代的THbC衍生物。含有C1季碳手性中心的1,1-二取代THbC衍生物的不对称合成主要依赖于Pictet-Spengler反应,但目前发展的Pictet-Spengler反应局限于从醛出发构建C1位非季碳手性中心THβC骨架,或者具有活化羰基的酮参与反应,导致THbC骨架C1位取代基必须连有羰基,限制了产物的进一步合成转化。如何高立体选择性地实现C1季碳THbC结构的构筑具有很大挑战。最后是如何将发展的方法学应用到THbC类天然产物的集群式合成中。该类天然产物数量众多,如果能够发展多样性导向的合成方法并且实现该类天然产物的集群式合成,那将为其活性研究奠定坚实基础。为了解决上述挑战,发展新的合成子和新的不对称催化反应合成THbC骨架是很有必要的。
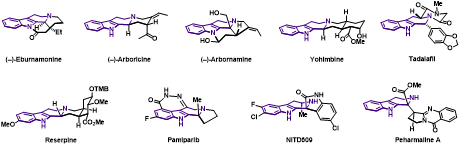
图1. 含四氢-β-咔啉结构的天然产物和药物分子
中国海洋大学王杨副教授团队致力于含氮杂环的新型不对称催化合成方法研究及其导向的药物化学和天然产物合成。近日,该团队在Nature Communications(Nat. Commun. 2024, 15, 6429)发表论文,以3,4-二氢-β-咔啉氧化物作为原料,发展了在手性磷酸催化下与烯醚的不对称1,3-偶极环加成反应,以优异的产率和立体选择性得到了三类THβC并异噁唑衍生物(含有两个手性中心、含有连续三个手性中心和含有季碳手性中心)。产物中N−O键便于进行衍生化,作者发展了两种N−O键切断方法,包括卤代烷/DABCO条件切断N−O键合成β-氨基酯和SmI2/MeOH条件切断N−O键得到β-氨基醇。以两种N−O键切断方法作为关键反应,完成了40个THβC吲哚生物碱的集群式不对称合成(图2. b)。该研究成果近期发表在Nature Communications上,本文的第一完成单位是中国海洋大学医药学院。王杨副教授为通讯作者。文章的共同第一作者是中国海洋大学博士研究生田晓晨、宣腾飞及浙江工业大学高井昆。浙江工业大学杨云芳教授作为共同通讯作者进行了DFT计算的研究。
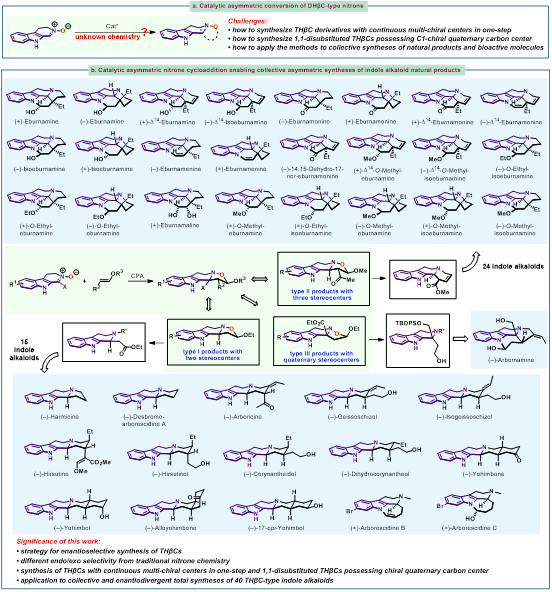
图2. 3,4-二氢-β-咔啉氧化物参与的不对称催化反应
在确定最佳反应条件后,作者对于3,4-二氢-β-咔啉氧化物与烯醚环化反应的底物范围进行了考察 (图3)。结果显示,当底物1与乙烯基乙醚2a反应时,在底物吲哚的4位、5位、6位、7位引入不同电子效应的取代基,均能以中等至优异的产率和对映选择性得到目标产物,同时产物的Dr值大于19>1。当使用二取代的烯醚2b参与反应,相应的目标产物含有连续三个手性中心,并具有优异的产率和立体选择性。使用酯基取代的底物6作为底物,得到的产物具有季碳手性中心。重新优化了反应条件,能够以中等至优异的产率和对映选择性得到相应的目标产物7。
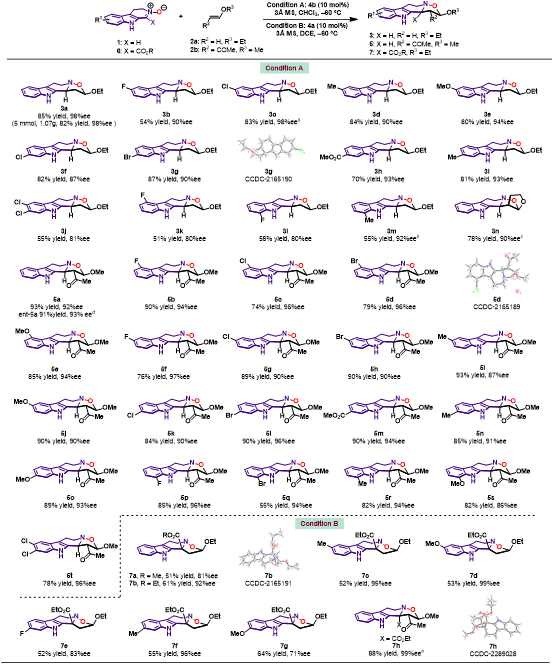
图3. 底物范围
为了深入了解反应机理,作者与杨云芳教授团队合作进行了密度泛函理论(DFT)计算 (图4)。对于产物3a、7b和7h的形成,DFT计算揭示了手性磷酸与硝酮的氧原子具有氢键相互作用,底物以协同的方式加成得到目标产物。而1a和2b的加成反应,手性磷酸则作为双功能催化剂同时活化两个底物,并且通过分步路径进行。在反应过程中,首先形成C−O键,随后形成C−C键,C−C的形成是决速步。根据前线分子轨道(FMO)分析,主要的FMO相互作用发生在2a的HOMO和1a的LUMO之间。因此,手性磷酸与偶极子1a相互作用以降低其LUMO轨道能量。6b与2a和2b的反应中,也观察到了该相互作用。然而,对于1a和2b的加成反应,主要的FMO相互作用发生在1a的HOMO轨道和2b的LUMO轨道之间,与前述情况不同。在该反应中,手性磷酸倾向于通过与2b的乙酰基形成氢键相互作用来活化2b。
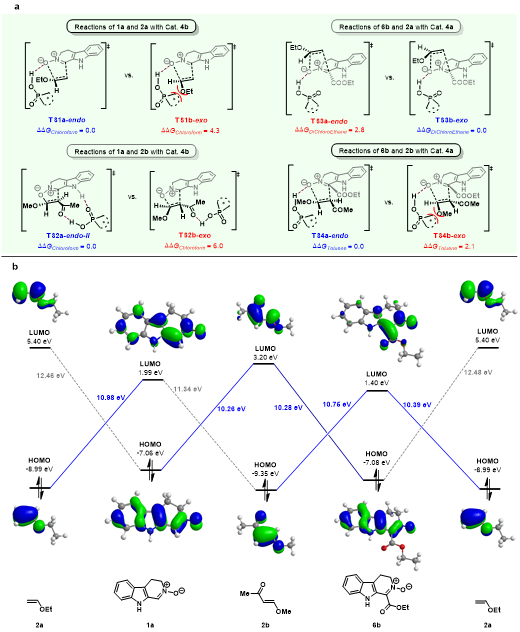
图4. DFT计算
为了进一步得到多样性和多官能团化的THbC衍生物,作者对N−O键的切断进行了研究 (图5)。产物中的异噁唑结构与卤代烷反应能够形成季铵盐,随后在DABCO作用下开环,得到不同N-烷基取代的b-氨基酯。在SmI2/MeOH条件下,N−O键可以被还原,将氨基用Boc基团保护,得到b-氨基醇。
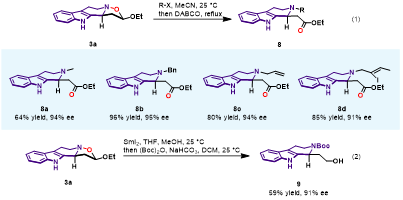
图5. N−O键切断
在建立了3,4-二氢-β-咔啉氧化物与烯醚的环化反应方法学以及N−O切断方法以后,作者对于方法学产物在天然产物合成中的应用进行了探索。合成思路是用不同的卤代烷参与N−O切断反应,得到N-烷基-b-氨基酯,通过官能团转化和结构修饰,实现了Arborescidine家族、Harmicine、Corynanthe家族、Yohimbine家族等15个天然产物的全合成 (图6)。
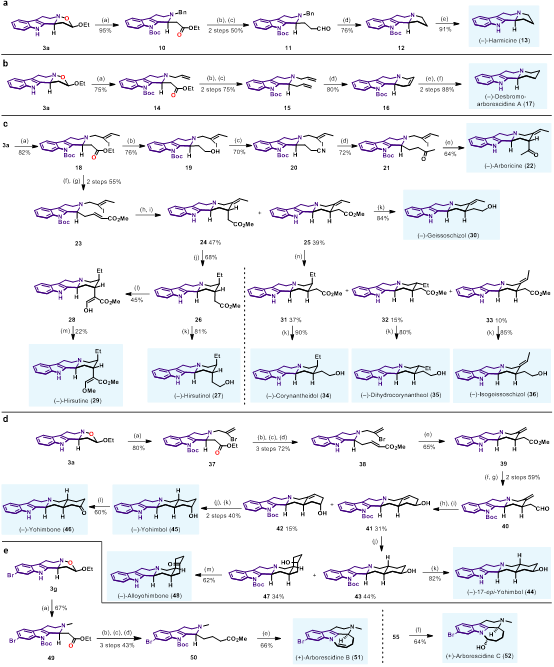
图6. Type I型产物在全合成中的应用
从夹竹桃科植物中分离得到的Eburnane家族生物碱具有多种生物活性,对于该类天然产物的全合成研究吸引了很多关注。目前,在Eburnane家族生物碱的全合成研究中,C20、C21位的立体化学控制一直是合成的难点。目前常用的方法是通过C20位的手性中心来诱导C21位手性中心的形成,如底物控制的Pictet-Spengler反应、Bischler-Napieralski反应与亚胺还原的串联反应,但是反应的非对映选择性通常较差,仅有个别底物能实现优异的立体选择性控制。在该工作中,作者以具有连续三个手性中心的Type II型产物5a作为原料,利用其产物结构中连续的手性中心,实现了24个Eburnane家族生物碱的全合成,通过双负离子中间体的排斥作用,实现了C20、C21位手性中心的立体选择性控制(图7)。另外,作者以具有季碳手性中心的Type III型产物7b作为原料,实现了1,1-二取代THβC天然产物Arbornamine的全合成(图7. c)。
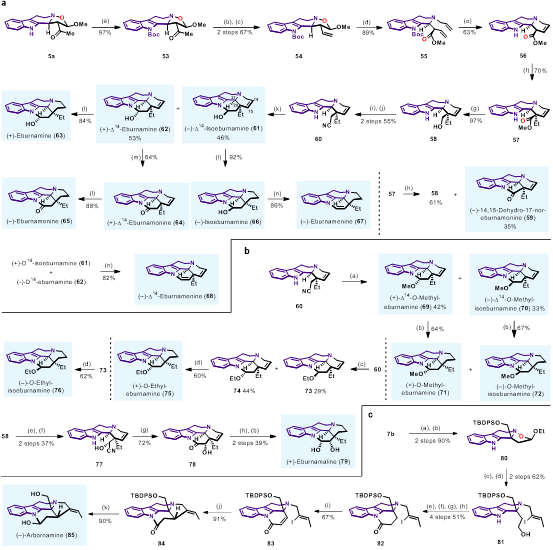
图7. Type II型产物和Type III型产物在全合成中的应用
Eburnane家族生物碱广泛分布于夹竹桃科的植物体内,在分离过程中经常发现该家族天然产物具有生源合成的对映发散性,即两种对映异构体均存在于植物体中。作者以ent-5a为起始原料,完成了该家族生物碱的对映发散性合成 (图8)。
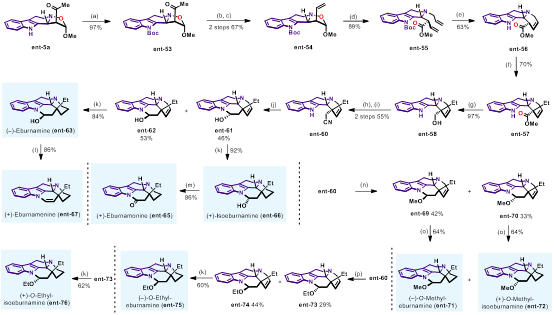
图8. Eburnane家族生物碱的对映发散性合成
小结
王杨课题组发展了首例3,4-二氢-β-咔啉氧化物参与的不对称催化反应。在手性磷酸催化下,该底物与烯醚的发生环加成反应,构建了一系列高选择性的THβC衍生物,具有优异的产率和立体选择性,并且完成了40个THβC吲哚生物碱的集群式不对称合成。该研究展示了3,4-二氢-β-咔啉氧化物在合成手性THβC骨架方面的巨大潜力。
通讯作者简介

王杨 副教授
王杨,中国海洋大学副教授,博士生导师。2019年加入中国海洋大学医药学院独立开展研究工作,入选中国海洋大学“青年英才”工程第二层次。2020年入选山东省泰山学者青年专家。近年来在Science, Chem. Soc. Rev., Nat. Commun., J. Am. Chem. Soc., Angew. Chem. Int. Ed., ACS Catal., Chem. Sci., Green Chem., Green Synth. Catal., Org. Lett., J. Org. Chem., Chem. Eur. J., Asian J. Org. Chem., Synthesis等期刊发表SCI收录论文三十余篇,获得授权专利4项。主要研究领域为含氮杂环的新型不对称催化合成方法研究及其导向的药物化学和天然产物合成。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn