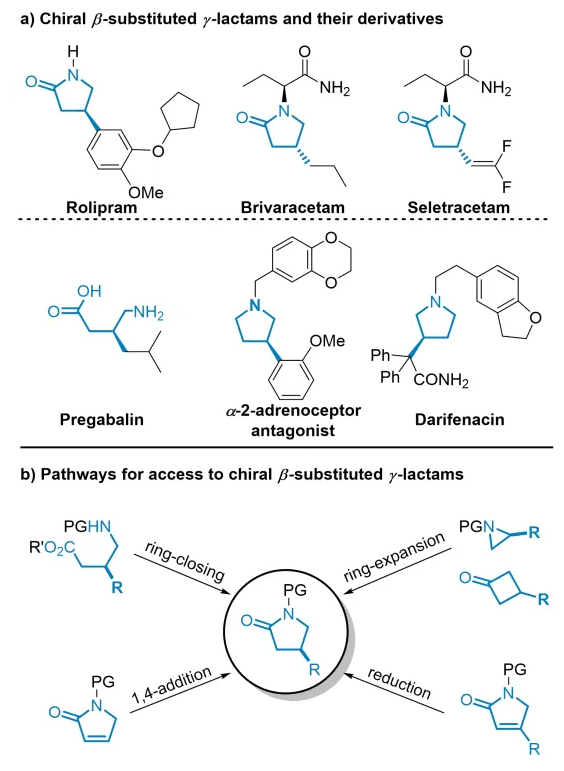
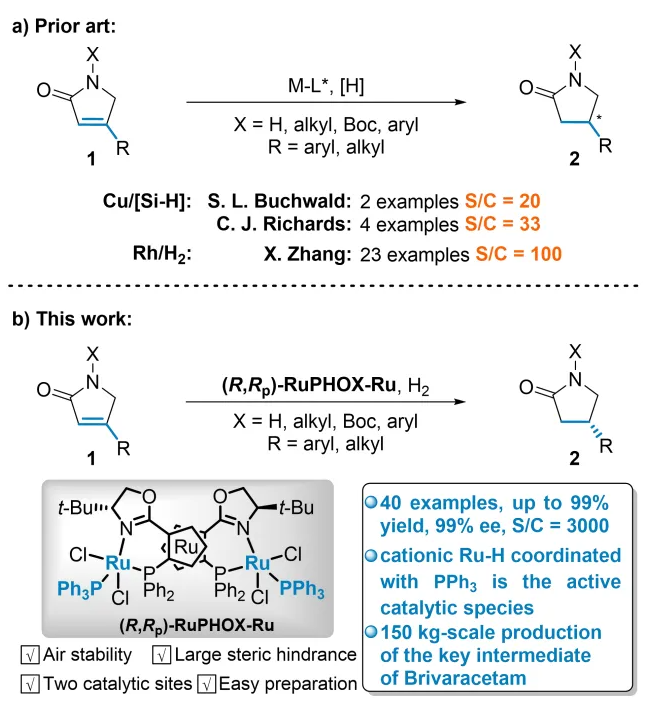
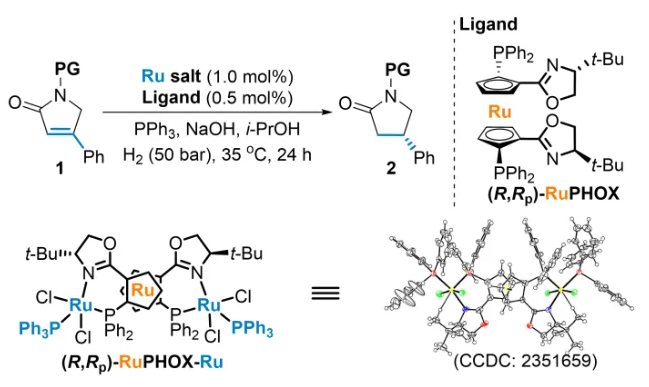
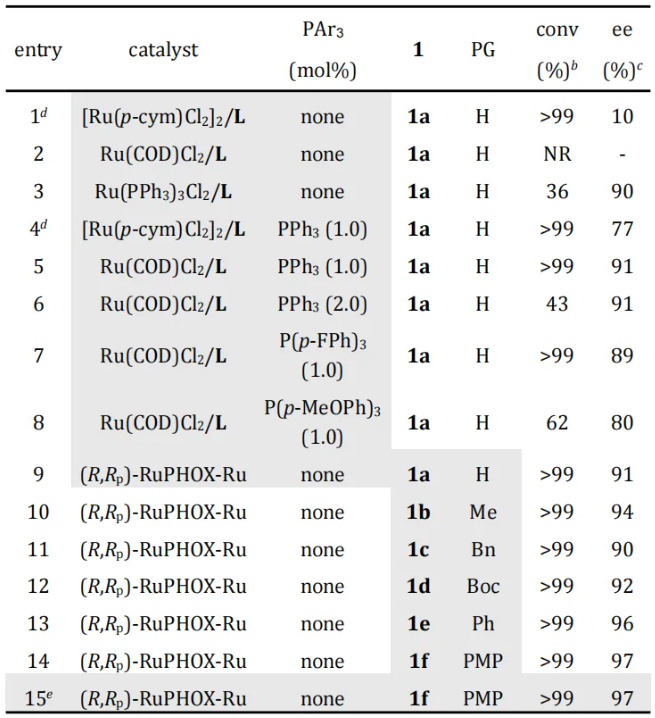
手性β-取代γ-内酰胺是广泛存在于天然产物和手性药物中的骨架,例如抗炎药咯利普兰,抗癫痫药布瓦西坦和Seletracetam等(图1a,上)。它们还易于转化为其他手性药物或生物活性手性分子,例如普瑞巴林,α-2-肾上腺素受体拮抗剂和达菲那新等(图1a,下)。因此,科学家们已经开发了多种不对称构建这类手性骨架的途径(图1b)。虽然这些策略实现了手性β-取代γ-内酰胺的实验室规模高效合成,但开发这类手性骨架(例如布瓦西坦)的高效不对称催化工业化制备方法仍然是非常有挑战性的课题。 上海交通大学张万斌教授课题组长期致力于不对称催化氢化反应的研究,发展了一系列手性Ru、Rh、Ni和Co等金属催化的高效不对称氢化反应(近三年代表性成果有:Angew. Chem. Int. Ed.2021, 60, 23602; Angew. Chem. Int. Ed.2021, 60, 16989; Nat. Chem. 2022, 14, 920; J. Am. Chem. Soc. 2022, 144, 20078; J. Am. Chem. Soc. 2023, 145, 21176; Angew. Chem. Int. Ed. 2023, 62, e202306380; Angew. Chem. Int. Ed. 2023, 62, e202303488; Angew. Chem. Int. Ed. 2023, 62, e202217871; Angew. Chem. Int. Ed. 2023, 62, e202214990; Adv. Sci. 2024, 2400621;Nat. Commun. 2024, 15, 5482等)。近日,他们利用自主知识产权的RuPHOX-Ru催化剂,实现了α,β-不饱和γ-内酰胺的高效不对称氢化,特别是实现了布瓦西坦的150公斤级不对称催化工业化生产(图2b),对反应机理进行详细研究表明了连有PPh3的阳离子型Ru-H配合物是真正的活性催化物种。相关成果发表在J. Am. Chem. Soc. 期刊上(2024, 146, DOI: 10.1021/jacs.4c09794)。 首先,作者以无保护基的4-苯基-1,5-二氢-2H-吡咯-2-酮(1a)作为模板底物,对氢化反应的催化体系着重进行了考察,结果表明催化体系中PPh3的量对反应活性及立体选择性有很大的影响。作者还发现带有不同N-保护基的底物均提供了良好的结果。其中p-甲氧基苯基N-保护基(PMP)提供了最佳结果,以>99%的转化率和97%的ee获得氢化产物(表1)。
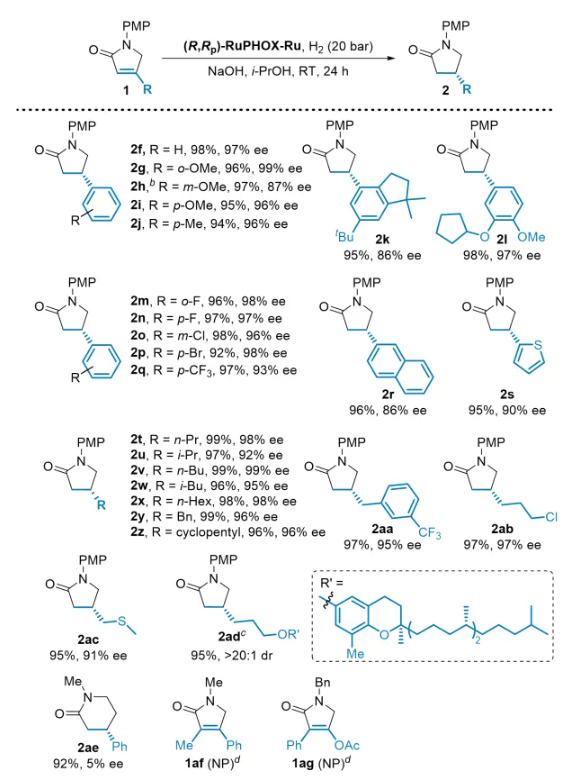
在获得最佳反应条件后,作者对α,β-不饱和γ-内酰胺1的底物适用性进行了考察(图3)。研究发现,该反应具有很好的底物适用性,不管是芳香族底物还是脂肪族底物,均以最高达99%的收率及>99%的对映选择性获得目标产物。遗憾的是,该体系并不能很好的适用于α,β-不饱和δ-内酰胺和α,β-不饱和四取代γ-内酰胺。
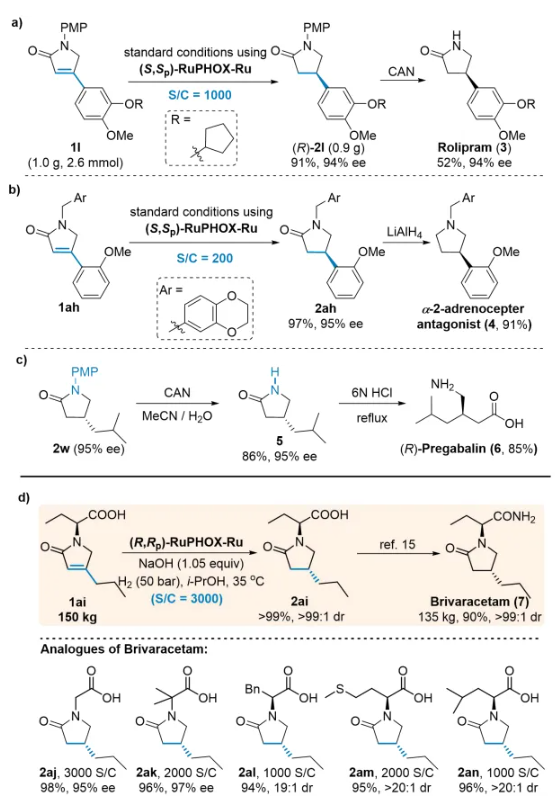
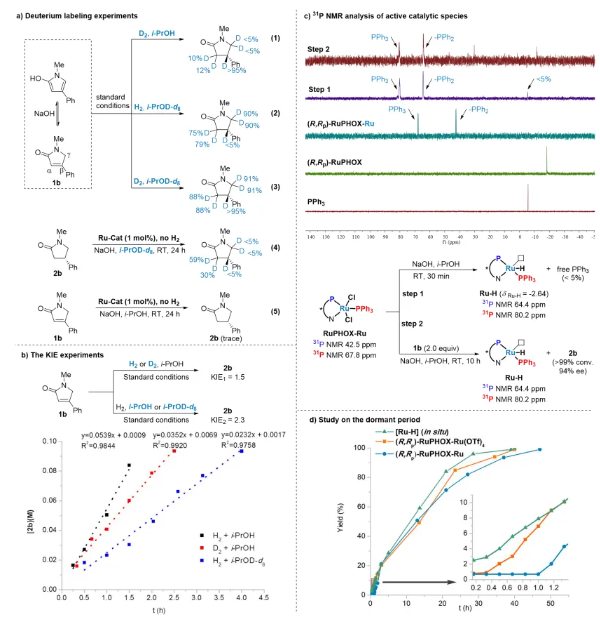
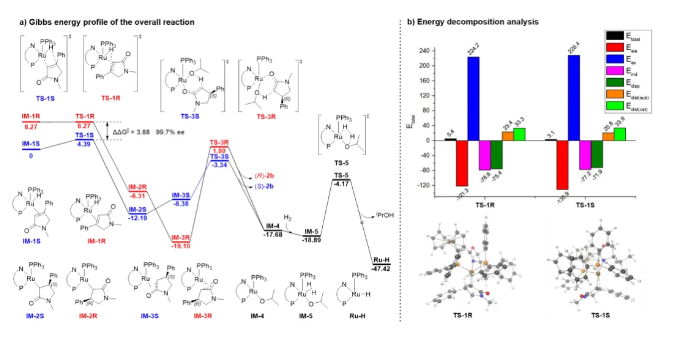
进一步地,他们发现该方法可以用于几类药物如咯利普兰,α-2-肾上腺素受体拮抗剂和普瑞巴林的合成中(图4)。特别需要指出的是,在较低催化剂用量(3000 S/C)下以>99%的收率和>99:1的非对映选择性成功实现了150公斤级布瓦西坦关键中间体的不对称催化合成。 为了深入理解反应历程,作者进行了详细的控制实验(图5)。氘代实验表明产物β位上H原子的氢源是H2,且在氢化反应中存在非常缓慢的转移氢化过程。在对上述氘代实验的反应速率也进行了测定后,作者发现催化循环中的决速步不在涉及H2的过程,而是在溶剂参与的质子化步骤。为了探索PPh3在反应中的作用,作者在不同反应阶段进行了31P NMR分析,结果表明,配有PPh3的Ru-H物种可能是反应中的活性催化物种。在对不同催化体系的休眠期研究中,作者发现RuPHOX-Ru催化反应的初始休眠期是由于RuPHOX-Ru催化剂在氢化开始之前转化为活性阳离子Ru-H物种的过程。 为了阐明反应的发生过程,他们借助了DFT计算(图6a),结果表明活性阳离子Ru-H物种的迁移插入应该是立体控制步骤,氧杂-π-烯丙基-Ru络合物的质子化步骤是速率决定步骤,这也与KIE实验的结果一致。他们还使用EDA(能量分解分析)来分析立体控制步骤中TS-1R和TS-1S的次级相互作用(图6b),结果表明PPh3和RuPHOX的叔丁基与底物的色散力具有一定稳定过渡态的作用,从而有效地提高了反应活性。 张万斌教授课题组开发了一种高效的RuPHOX-Ru催化的α,β-不饱和γ-内酰胺的不对称氢化反应,以优秀的收率和对映选择性(高达99%产率和99% ee)得到相应的手性β-取代γ-内酰胺。基于详细的控制实验和计算研究,揭示了连有PPh3的阳离子Ru络合物是活性催化物种,PPh3对高效催化行为至关重要。该方法为合成几种手性药物和生物活性分子的关键中间体提供了一条简单实用的途径,特别是和奥锐特药业合作实现了150公斤级的不对称催化工业化生产布瓦西坦。
Ru-Catalyzed Asymmetric Hydrogenation ofα,β-Unsaturated γ-LactamsZhengdong Ding, Yicong Luo, Qianjia Yuan, Guangjie Wang, Zhenpeng Yu, Min Zhao, Delong Liu, and Wanbin Zhang*