

近日,上海交通大学张万斌教授团队在丰产金属铜催化不对称氢化领域取得新进展:基于催化剂与底物之间的多重色散相互作用 (Multiple attractive dispersion interactions, MADI)的协同促进策略,成功实现了丰产金属铜催化不对称氢化非对称邻溴取代二芳基酮的反应研究。这是丰产金属铜首次实现对于反应活性低、对映选择性控制难的二芳基酮底物的不对称氢化研究。相关成果发表在 Angew. Chem. Int. Ed. 上。
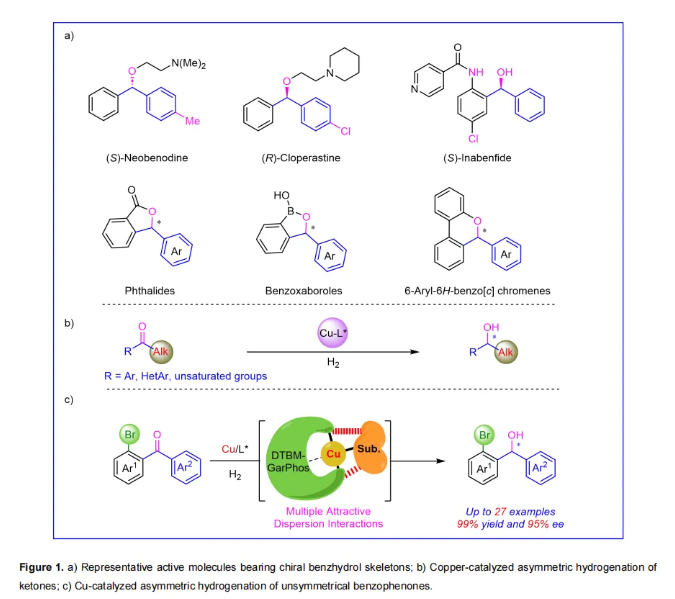
手性二芳基醇骨架是许多药物和天然活性化合物合成中的重要结构单元(图1a)。例如,抗组胺药(S)-新苯海拉明、中枢镇咳药物(R)-氯哌斯汀、农药(S)-抗倒胺、酸碱指示剂苯酞类化合物(Phthalides)、广谱抑制剂苯并硼唑类化合物(Benzoxaboroles)以及受体拮抗剂6-芳基-6H-苯并[c]色烯(6-Aryl-6H-benzo[c] chromenes)。因此,开发高效简洁的不对称合成手性二芳基醇的方法引起了化学研究者的极大兴趣。目前,已经开发了几种不对称合成手性二芳基醇的策略,大致分为三种方法:1) 酶催化的二芳基酮不对称还原;2) 亲核试剂对芳香醛的亲核加成;3) 过渡金属催化剂对二芳基酮的不对称还原。在这些方法中,过渡金属催化不对称氢化方法因其效率高和工业化应用前景广阔,从而展现出巨大的吸引力。
过渡金属催化的不对称氢化已经发展了50多年。近年来,人们越来越关注更易获得且环保的丰产金属催化剂,例如,在各种不饱和底物的氢化中取得快速发展的镍、钴和锰催化剂。然而,铜催化的不对称氢化反应研究相对滞后,这可能是因为与其它3d金属相比,Cu(I)-H被认为是一个软亲核试剂,导致其催化活性较低。到目前为止,只有少数底物在铜催化的不对称氢化中被报道,如芳基-烷基酮、芳基-烯基酮和烷基-烯基酮(图1b)。由于区分结构相似的两个芳香基团具有难度,因此铜催化的二芳基酮不对称氢化仍然是一个挑战性工作(图1c)。
通常,策略性地在二芳基酮的一个芳香环的邻位引入取代基可以作为对映导向官能团,增强手性催化剂的识别能力。此外,考虑到取代基能容易脱除和更方便和更广泛地衍生,因此卤素基团成为一个有前景的候选取代基。最近,作者发现了CH···HC多重吸引色散相互作用(MADI)的协同催化效应,可以显著地提高不对称氢化的反应性和立体选择性。基于这一策略,作者已经开发出几种活性较低的丰产金属(镍、钴和铜)催化的高效不对称氢化体系。因此作者设想这一策略也可以应用于铜催化具有挑战性的非对称二芳基酮不对称氢化反应(图1c)。
上海交通大学化学化工学院张万斌教授团队长期致力于过渡金属催化的不对称氢化研究,并发现了催化剂与底物之间 CH···HC 弱吸引相互作用的协同催化效应,该作用也被称为多重色散相互作用(MADI)。利用该策略他们成功开发出系列不对称氢化反应 (稀有金属:Pd: Angew. Chem. Int. Ed. 2013, 52, 11632; Angew. Chem. Int. Ed. 2016, 55, 8444; Nature Commun.2018, 9, 5000; iScience2020, 23, 100960; Rh: Angew. Chem. Int. Ed. 2019, 58, 11505; Ru: J. Am. Chem. Soc. 2024, 146, doi/10.1021/jacs.4c09794; 丰产金属:Ni: Angew. Chem. Int. Ed. 2019, 58, 7329; Angew. Chem. Int. Ed.2020, 59, 5371; Nat. Commun.2020, 11, 5935; Nat. Chem. 2022, 14, 920; Angew. Chem. Int. Ed. 2023, 62, e202214990;Co: Angew. Chem. Int. Ed. 2019, 58, 15767; Angew. Chem. Int. Ed. 2021, 59, 16989; Cu: Angew. Chem. Int. Ed. 2023, 62, e202306380)。近日,利用该策略,他们又成功开发了一例基于MADI效应的铜催化不对称氢化非对称邻溴取代二芳基酮反应,得到了一系列易于衍生的手性二芳基醇产物,并取得了优异的反应结果。
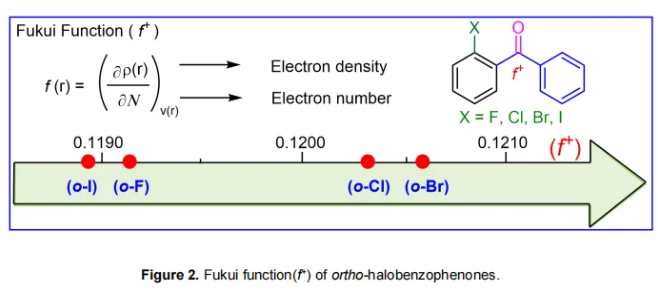
最初为了确定一个合适的邻位取代卤素基团,作者计算了Fukui函数(f+)作为评估各种邻位取代二芳基酮(o-F、Cl、Br和I,见Figure 2)中羰基碳原子亲电性的指标。结果显示,与其它三种底物(o-I为0.1189;o-F为0.1192;o-Cl为0.1203)相比,邻位溴(o-Br)取代的二芳基酮具有最高的Fukui函数值(0.1206),表明邻位溴取代的二芳基酮可能具有最高的反应性。在芳香卤代物的硝化反应中也观察到了类似的反应性顺序。因此,邻位溴(o-Br)取代基被选作二芳基酮底物中的对映导向官能团。
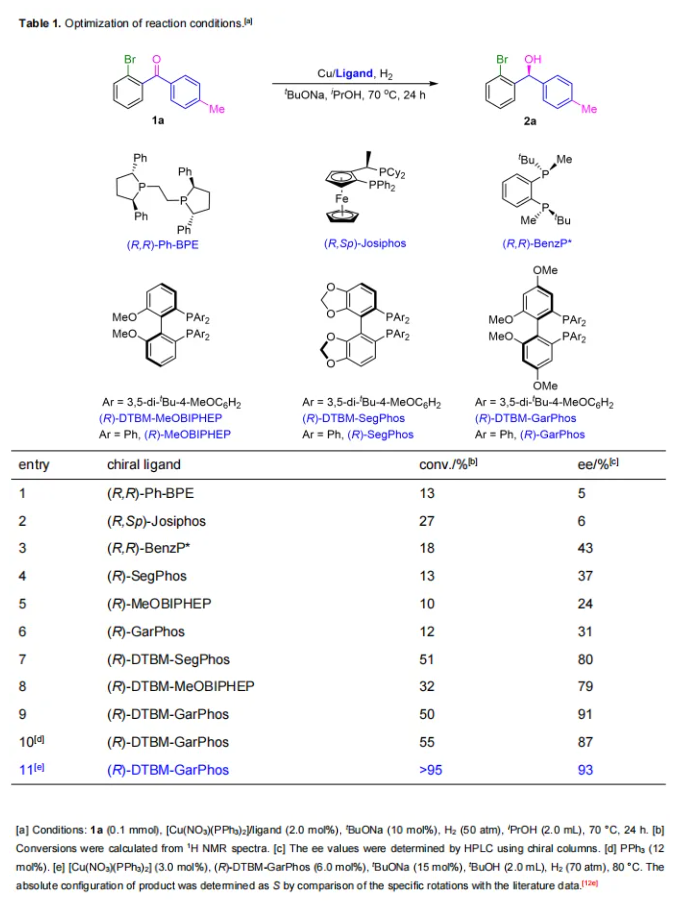
接下来,考虑到利用1H NMR检测反应转化率的便利性,作者选择了含有甲基的(2-溴苯基)对甲基苯甲酮(1a)作为模板底物(Table 1)。首先,筛选了几种不同类型的手性双膦配体,如(R,R)-Ph-BPE、(R,Sp)-JosiPhos、(R,R)-BenzP*和(R)-SegPhos,并且使用[Cu(NO3)(PPh3)2]作为铜源。反应仅提供了低的催化活性和对映选择性(13-27% conv.,5-43% ee,entry1-4)。当测试了另外两种轴手性配体,(R)-MeOBIPHEP和(R)-GarPhos时,也得到了类似的较差结果(10, 12% conv.,24, 31% ees,entry 5, 6)。随后,选择了三种带有3,5-二叔丁基-4-甲氧基苯基(DTBM)基团的轴手性配体((R)-DTBM-SegPhos、(R)-DTBM-MeOBIPHEP 和(R)-DTBM-GarPhos)进行反应,结果显示出明显更高的转化率和对映选择性(32-51% conv.,79-91% ee,entry 7-9)。反应效果的提升可能是由于带有DTBM基团的配体与底物产生了更强的MADI效应。考察了(R,R)-QuinoxP*和几种JosiPhos型配体,但结果不尽人意。在筛选的配体中,(R)-DTBM-GarPhos是最合适的,提供了最佳的催化结果(50% conv.,91% ee,entry 9)。接下来,测试了一些其它常用的铜盐,反应效果没有提升。此外,加入添加剂PPh3略微增加了转化率,但降低了对映选择性(55 vs 50% conv.,87 vs 91% ee,entry 10 vs 9)。当仅使用PPh3为配体进行氢化反应时,获得了5%的外消旋产物,表明在反应中存在背景反应。进一步的条件优化包括碱、溶剂、反应温度、H2压力、催化剂负载量和金属与配体的比例。值得注意的是,过量配体(1/2, 1/3 M/L)显著提高了转化率,最佳M/L比例为1/2。而加入过量的铜盐(2/1, 3/1 M/L)效果变化不明显。最终,确定了最佳反应条件为在70 atm H2,80 °C的条件下,使用3.0 mol% 铜催化剂(1/2 M/L),实现了大于95%的转化率和93%的对映选择性(entry 11)。
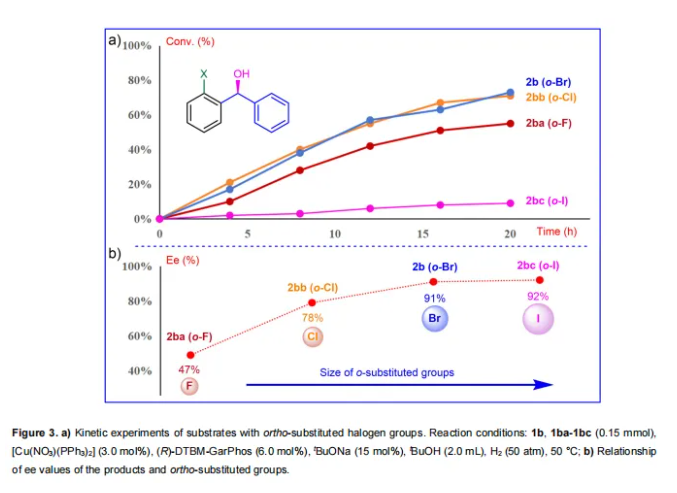
为了进一步验证氢化反应与邻位取代基团之间的关系,作者使用底物1b、1ba-1bc(Figure 3)进行了动力学实验。从Figure 3a上可以观察到,尽管邻位Cl和Br取代的底物在转化率上表现出差异相对较小,以及轻微的波动,但是它们的转化总体趋势与Fukui函数预测的值比较吻合(Scheme 2)。此外,通常其它因素(如空间位阻)也显著影响氢化转化率。一般来说,底物反应位点(C=O)附近的空间位阻越大,转化越不利。因此,正如预测的那样,具有最低Fukui函数值和最高空间位阻的邻位I取代底物1bc,几乎没有转化。相比之下,含有最高Fukui函数和相对较大空间位阻的邻位Br基团的底物1b,在该反应中实现了高的转化。这表明底物中羰基碳的亲电性在提高反应性方面起着重要作用。此外,还确定了相应产物的对映选择性(Scheme 3b,邻位F、Cl、Br和I取代的产物:分别为47%、78%、91%和92% ee)。显然,产物的对映选择性与邻位取代基团的大小呈正相关。这主要是因为苯环上较大的邻位取代基增加了L-CuH物种区分二芳基酮的Si和Re平面的能力,从而提高了产物的对映选择性。
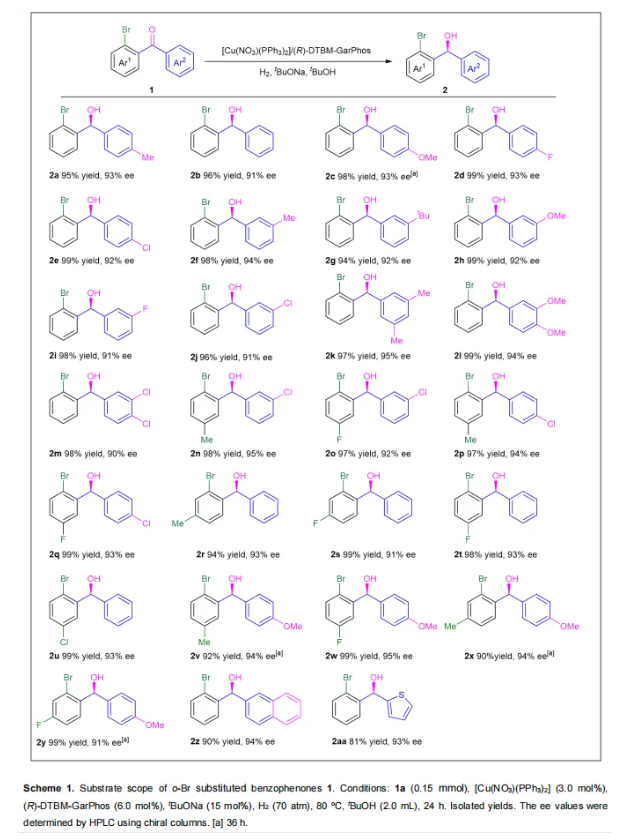
为了验证底物的适用性,对一系列非对称邻位溴取代的二芳基酮进行了相应的催化氢化反应。所有产物均以优异的对映选择性(91-95% ee)和高达99%的产率获得(Scheme 1)。首先,无论Ar2上是单个还是双取代基,无论是给电子还是吸电子基团,都获得了良好的产率(2a, 2c-2m, 95-99%),只有底物1c需要更长的反应时间(36 h)。没有取代基的底物1b也获得了优异的产率(2b, 96%)。值得注意的是,含有较大体积的间位叔丁基取代基底物1g,实现了高产率(2g, 94%)。相比之下,含有较大体积的3,5-tBu或4-tBu的底物,产率较低(<5%)或得到中等反应结果(38% 产率,75% ee)。这种差异可能因为底物1g的间位叔丁基芳香环在与铜催化剂配位时能够旋转,从而获得更有利的过渡态。然而,其它两个底物无法达到有利的构象。此外,将(R)-DTBM-GarPhos替换为(R)-GarPhos对这些含有叔丁基取代基的底物进行氢化,催化结果较差。其次,也考察了Ar1上的取代基的影响(1n-1y),当Ar2具有间位或对位氯取代基或无取代基时,不同Ar1的底物1n-1u(5-Me, 5-F, 4-Me, 4-F, 5-Cl)均可以顺利进行反应(2n-2u, 94-99% yield)。当Ar2是给电子基团(p-OMe, 1v-1y)时,底物1w(5-F)在标准条件下可以完全转化(2w, 99% yield),而底物1v, 1x, 和1y(5-Me, 4-Me, 4-F)需要额外时间以提高产率(2v, 2x, 2y, 90-99%)。此外,萘环(1z)和杂环(1aa)底物也可以获得良好的产率(2z, 90%;2aa, 81%)。
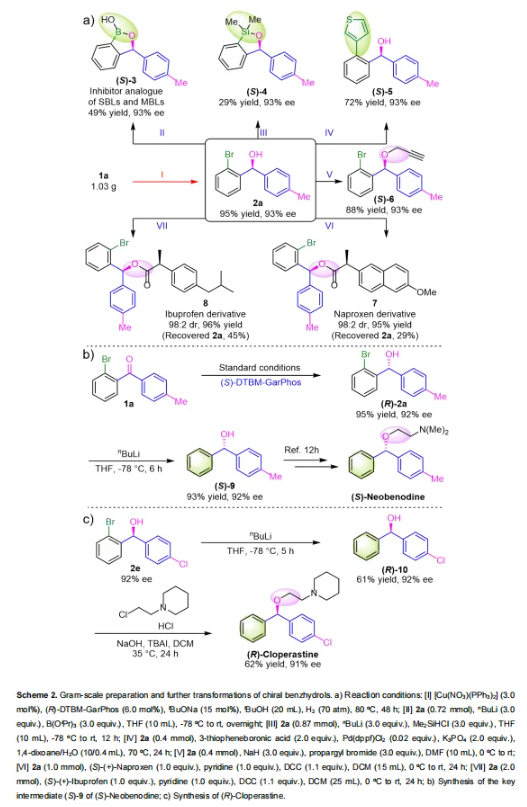
为了进一步检验铜催化体系的实用性,首先对1a进行了克级规模的反应(Scheme 2a),产率高达95%且对映选择性优异(93% ee)。其次,可以从产物2a衍生出一系列含有杂原子(B和Si)的手性化合物。例如,利用手性产物2a进行硼化反应,以中等产率和优异的对映选择性(49% yield,93% ee)制备了苯并硼唑类化合物(S)-3,这是一种丝氨酸-β-内酰胺酶和金属-β-内酰胺酶(SBLs和MBLs)广谱抑制剂的类似物;利用(Me)2SiHCl作为硅源与2a反应可以制备含有硅原子的杂环化合物(S)-4 (产率为29%,对映选择性为93%)。此外,在合成(S)-3和(S)-4的过程中也获得了相同的脱溴副产物(产率分别为42%和47%;ee均为92%),副产物可以作为组胺H1/H2受体拮抗剂的中间体。具有噻吩结构的手性化合物(S)-5可以通过Pd催化的Suzuki−Miyaura偶联反应合成,产率为72%,ee为93%。通过亲核取代反应可以以88%产率和93%对映选择性转化为炔烃(S)-6,炔烃(S)-6可以进一步与肟或叠氮化物反应,通过点击化学合成异噁唑。此外,手性产物2a与(S)-萘普生或(S)-布洛芬方便地合成它们的二芳基酯衍生物(7和8;产率分别为95%和96%;非对映异构体比为98:2)。最后,使用配体(S)-DTBM-GarPhos在标准条件下合成了手性化合物(R)-2a,产率为95%,对映选择性为92%。(R)-2a通过脱溴反应,以93%的产率和92%的ee获得了(S)-9 (Sheme 2b),(S)-9可以合成强效抗组胺药(S)-Neobenodine。同样,通过利用手性产物2e作为起始原料,通过脱溴和亲核取代反应合成了镇咳药(R)-Cloperastine(ee为91%)。
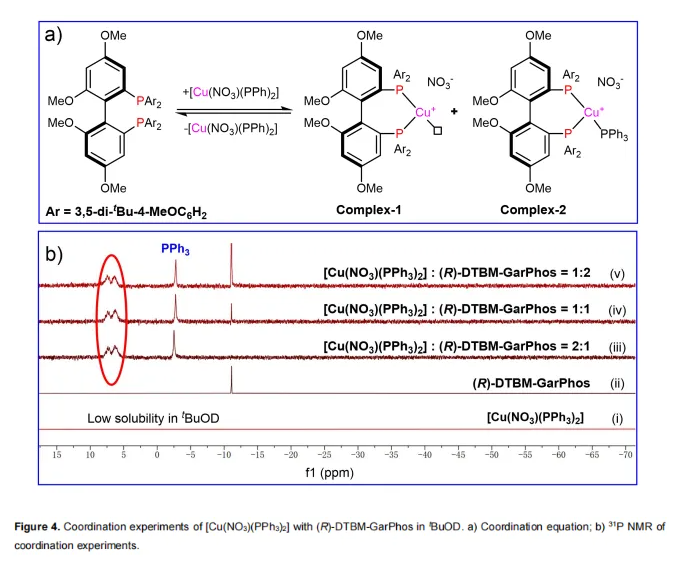
为了探索氢化反应的机理,作者使用1a作为底物,在D2和tBuOD条件下分别进行了氘标记实验。结果表明,手性碳上的氢原子来源于H2。随后,通过31P NMR研究了[Cu(NO3)(PPh3)2]与(R)-DTBM-GarPhos在不同比例下的配位实验(图4a, b)。由于[Cu(NO3)(PPh3)2]在高粘度的tBuOD溶剂中溶解度低,在31P NMR谱图中未观察到其信号(图4i)。在2/1、1/1和1/2 M/L的比例下观察到相同的新信号峰(图4ii-v)。配位体系(M/L = 2/1、1/1和1/2)的HRMS分析显示,可能只存在Complex-1和Complex-2络合物。然后,进行了非线性效应实验,并观察到完全的线性结果。这些实验结果清楚地表明,活性催化剂物种是一个金属/配体为1:1的配位络合物。
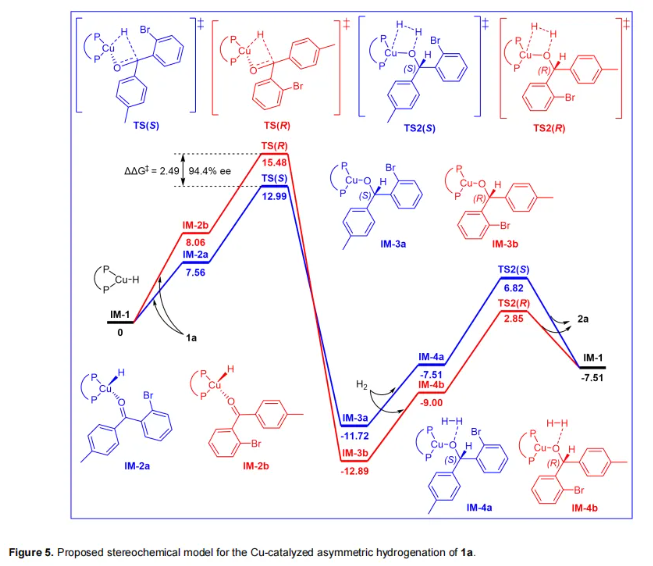
接下来,为了进一步探究反应中立体选择性的起源机制,进行了密度泛函理论(DFT)计算(Figure-5)。Cu(I)-H物种IM-1首先与底物1a配位,形成两个中间体IM-2a和IM-2b,其能量分别为7.56和8.06 kcal/mol。这种吸热的配位能量可以归因于配体空间位阻较大。然后,Cu(I)-H发生迁移插入到羰基中,通过过渡态TS(S)(12.99 kcal/mol)和TS(R)(15.48 kcal/mol),分别生成中间体IM-3a和IM-3b。这一步是立体化学的决定步骤。ΔΔG‡(2.49 kcal/mol)对应于有利的S构型,理论ee为94%,与实验数据(93% ee,Table 1,entry 11)相匹配。接下来,一分子H2进入体系,形成IM-4a和IM-4b。最后,在通过TS2(S)和TS2(R)异裂H2后,生成产物2a,并伴随着Cu-H物种的释放。
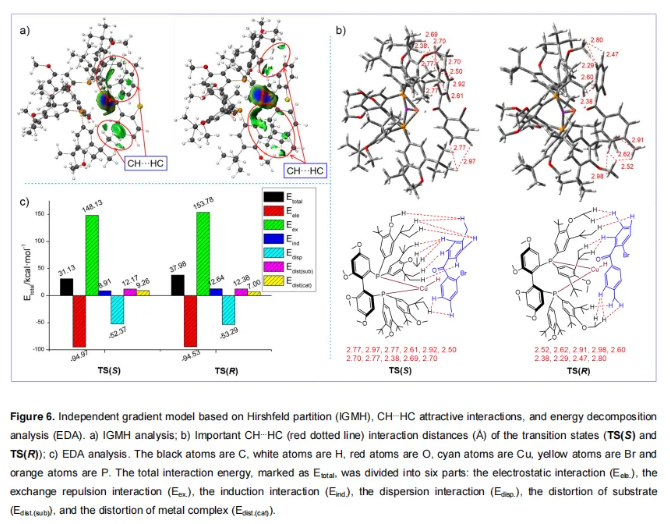
作者利用IGMH对TS(R)和TS(S)中底物与Cu-H催化剂之间的弱相互作用进行了可视化分析,其等值面的取值为0.05。如图6a所示,在TS(S)和TS(R)中存在许多相互作用,特别是CH···HC相互作用(图6b)。利用EDA定量分析了TS(R)和TS(S)中底物与Cu-H催化剂之间的弱相互作用和变形能,首先,此过渡态中TS(S)和TS(R)的总结合能(Etotal)均为正,这与DFT计算一致,即IM-2的能量高于IM-1。这表明由于空间位阻,体积较大的(R)-DTBM-GarPhos配体在一定程度上抑制了Cu-H催化剂与底物的结合。然而,配体的叔丁基基团也通过与底物的CH···HC吸引色散相互作用稳定了过渡态(在TS(S)和TS(R)中分别为-52.37和-53.29 kcal/mol)。此外,ΔEdisp仅为0.92 kcal/mol,表明色散相互作用对立体选择性影响较小。如图6c所示,Eind和Eex(ΔEind = 3.73 kcal/mol,ΔEex = 5.65 kcal/mol)主导了TS(S)和TS(R)之间的能量差异,表明空间位阻和诱导相互作用对对映选择性贡献最大。在所有能量共同作用下导致TS(S)的Etotal低于TS(R),与实验结果相匹配。
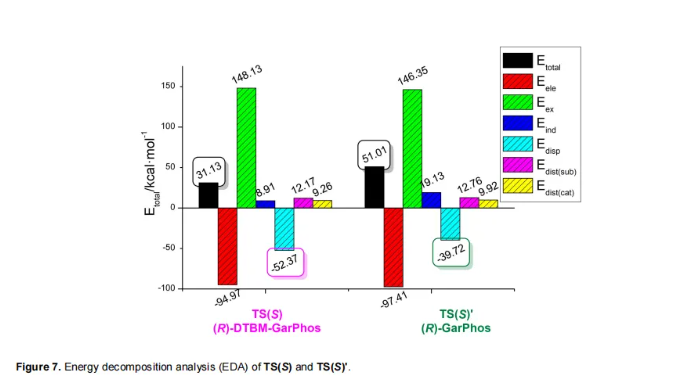
此外,作者还使用(R)-GarPhos为配体进行了相应TS(S)'计算。如Figure 7所示,TS(S)的总能量显著低于TS(S)'(31.13 vs 51.01 kcal/mol),并且TS(S)中的色散相互作用明显强于TS(S)'(-52.37 vs -39.72 kcal/mol)。这些计算结果与实验结果一致(Table 1,entry 6和9),其中(R)-GarPhos的产率为12%,而(R)-DTBM-GarPhos实现为50%的产率。
总结
文献详情:

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn