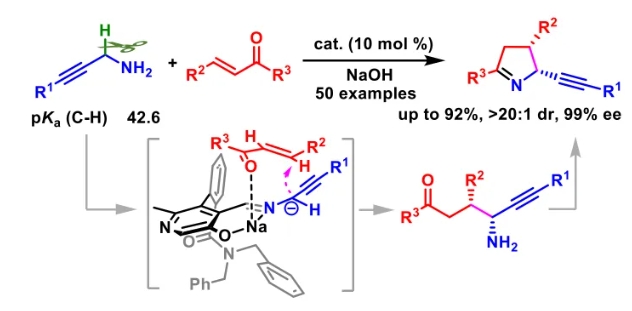
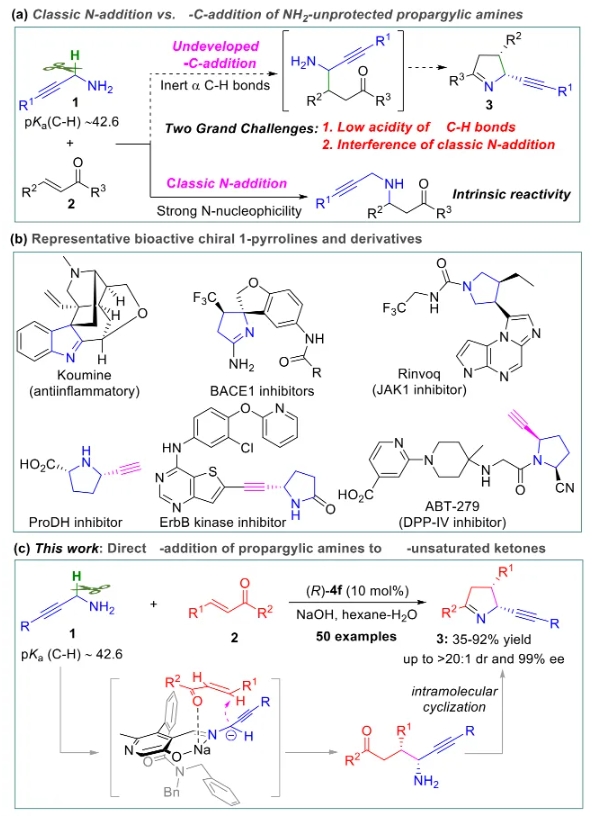
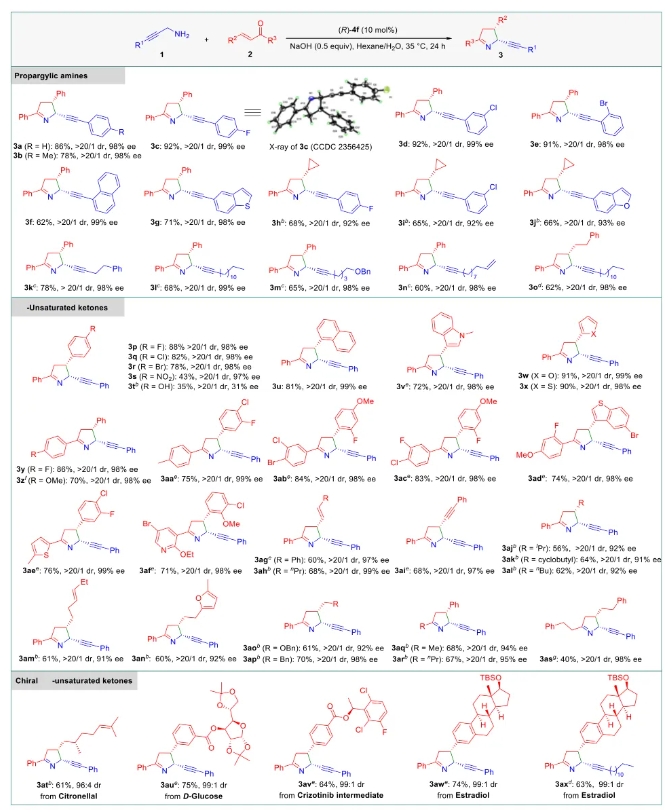
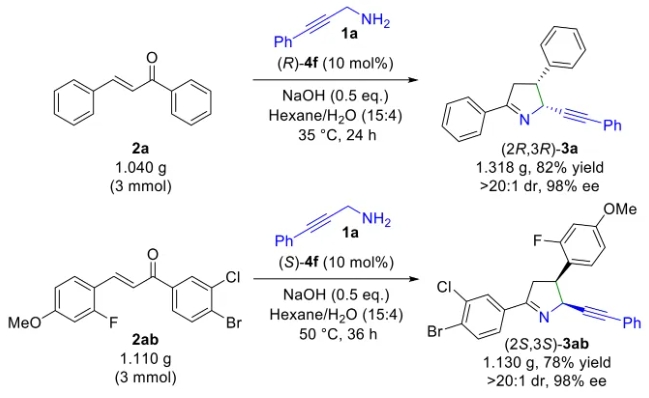
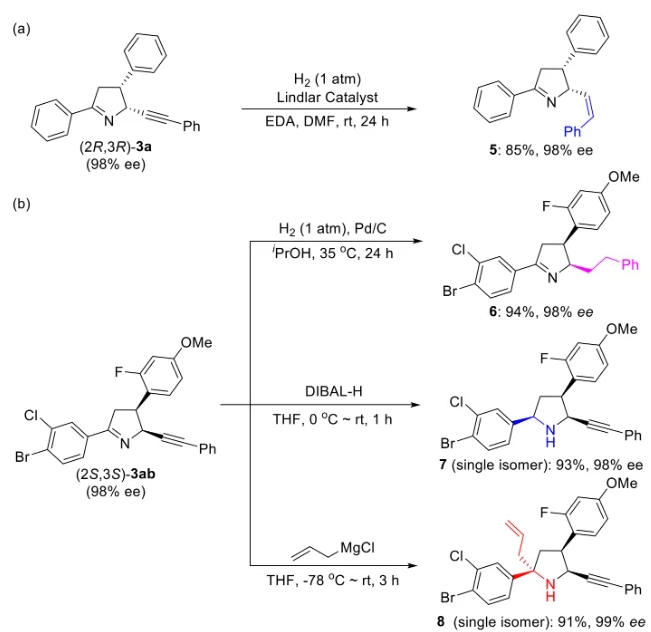
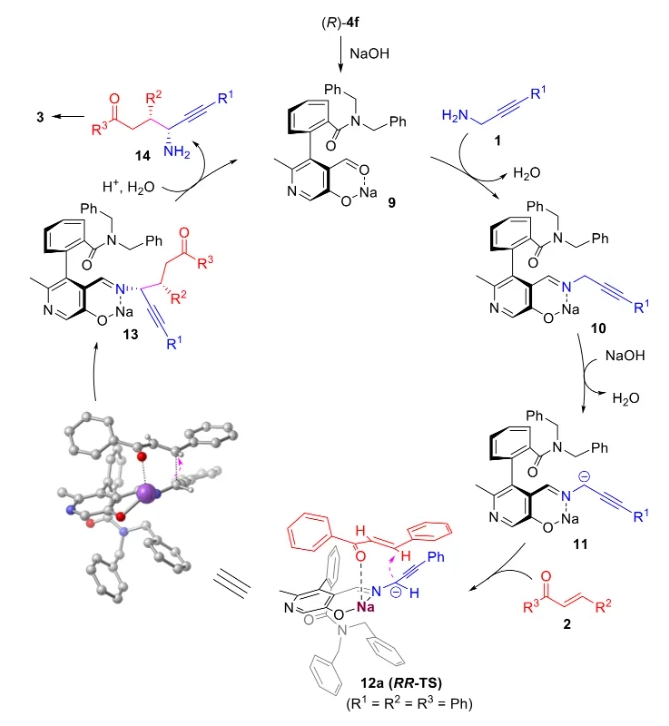
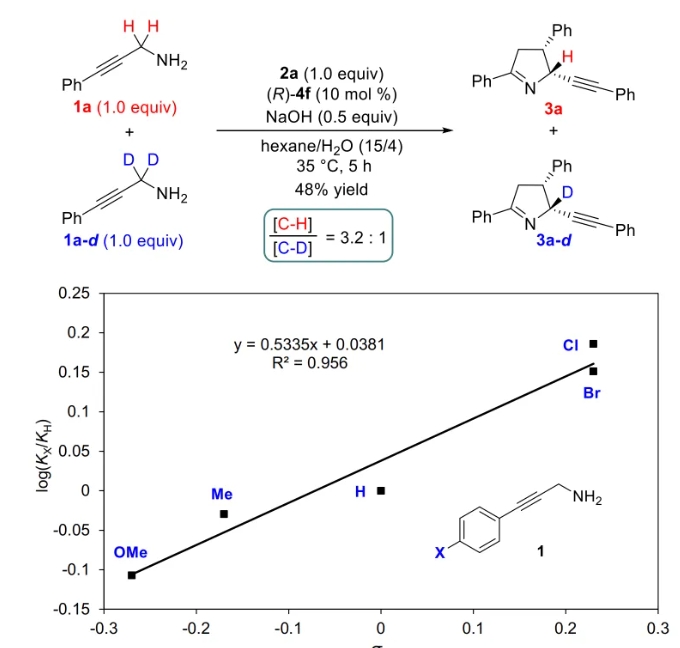
文献详情:
Direct Enantioselective α-C–H Conjugate Addition of Propargylamines to α,β-Unsaturated Ketones via Carbonyl Catalysis
Ruixin Zhang†, Jiwei Xu†, Siqi Liu, Shibo Si, Jiayao Chen, Lingxiao Wang, Wen-Wen Chen*, Baoguo Zhao*
J. Am. Chem. Soc. 2024,
https://doi.org/10.1021/jacs.4c09840