

正文
手性三级醇广泛存在于药物及天然产物中,也是合成化学和药物化学中的重要骨架,因此该类化合物的合成吸引了化学家的广泛关注。有机金属试剂对酮的不对称亲核加成被认为是构建手性三级醇最直接有效的方法之一。传统的有机金属试剂,如有机锌、有机镁和有机铝试剂等,存在对空气和水分敏感、官能团耐受性差等缺点。有机硼化合物因其廉价易得、结构稳定和官能团耐受性广被认为是理想的亲核试剂。目前报道的有机硼化合物和酮的反应历程可以归纳为以下两种路径:1)有机硼化合物和过渡金属通过转金属化生成含碳金属键的活性物种,随后该物种对酮进行加成得到目标产物,但该反应通常需要贵金属催化或底物为活化酮类化合物;2)零价镍和酮发生氧化环化,随后和有机硼化合物发生转金属化和还原消除得到目标产物,该类型反应需要使用空气敏感的零价镍。鉴于手性三级醇的重要性,亟需开发一种通用且简单高效的合成方法来实现手性三级醇的制备。
上海交通大学张万斌教授课题组长期致力于过渡金属催化有机硼化合物参与的加成反应研究,并实现了过渡金属催化有机硼化合物对多种具有挑战性不饱和化合物的加成反应(例如:CCS Chem., 2019, 1, 623-631; Nat. Commun., 2018, 9, 2258; Chem. Commun., 2017, 53, 609-612; Org. Lett., 2016, 18, 288-291; Org. Lett., 2015, 17, 2250-2253; Angew. Chem. Int. Ed., 2013, 52, 7540-7544)。基于手性三级醇的重要性和课题组的研究兴趣,作者希望发展一种高效的方法来实现有机硼化合物对酮的不对称加成以构建手性三级醇。
Petasis反应中有机硼化合物可以通过形成硼盐络合物的形式将取代基迁移至亚胺阳离子进而生成官能团化的胺类化合物。该反应存在原料易得,操作方便和反应条件温和等优点,但反应仅局限于对亚胺的加成。受Petasis反应的启发并了解到过渡金属可以和烯烃配位,从而促进硼盐络合物上取代基对C=C键发生迁移,作者设想过渡金属可以与手性配体配位形成手性催化剂,该催化剂可以作为Lewis酸与芳基酮配位以活化羰基并提供手性环境,并且可以作为桥连接芳基酮和有机硼酸衍生物以促进1,5-迁移,进而实现对酮的不对称加成反应。
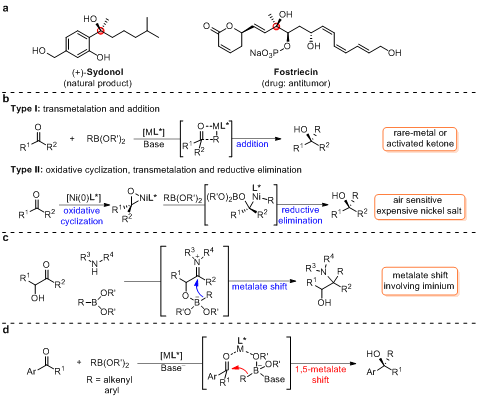
图1:含手性三级醇结构的药物和天然产物,过渡金属催化有机硼对酮的加成反应,Petasis反应和课题设计
在确定了反应的最优条件后,作者以苯乙烯基硼酸为亲核试剂对芳基酮底物的普适性进行了考察,当芳基酮芳环上连有给电子取代基或吸电子取代基时(3a–3r),反应均可顺利进行,并给出优秀的反应结果(71%–99% yield,81%–99% ee);对于杂芳基甲基酮(3s–3u),特别是更具挑战性的吡啶甲基酮(3v, 3w)和喹啉甲基酮(3x, 3y),以及其它的芳基烷基酮(3z–3ae),均以中等到优秀的结果得到相应的手性三级烯丙醇(53%–91% yield, 76%–97% ee)。并且该方法还适用于芳基酮的不对称芳基化,并以优异的结果制备了一系列手性二芳基醇化合物(5a–6e, 69–98% yield, 80%–97% ee)。

图2:底物的普适性考察
鉴于该反应良好的底物适用性,作者尝试将该反应应用于药物或天然产物的后期修饰中(图3a)。一系列含有芳基烷基酮结构的药物或天然产物,如萨利麝香,氮哌酮,盐酸达克罗宁,依巴斯汀,氟哌啶醇均可以优异的收率和对映选择性给出相应的烯基化产物(7a–7f, 70–83% yield, 89–94% ee)。最后,为了进一步验证所开发方法的实用性,作者将所开发方法应用于天然产物和药物的合成中,极大的缩短了相关天然产物和药物的合成路线(图3c)。
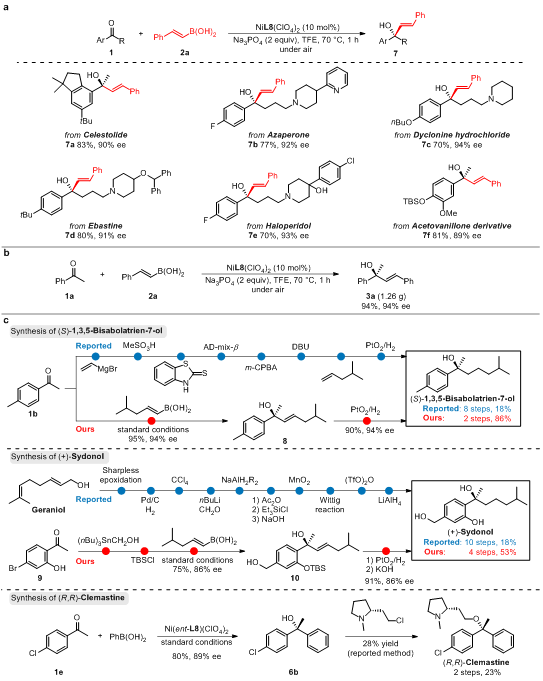
图3:药物的后期修饰及应用
为了验证反应机理,作者设计了一系列控制实验。首先,为了探究该反应是否通过有机硼化合物与镍盐发生转金属形成含C-Ni键的络合物,进而对酮加成生成目标产物(图1b, Type I),作者以苯乙烯基溴(11)代替苯乙烯基硼酸为底物,在Ni(COD)2催化下原位生成苯乙烯基镍物种,并和苯乙酮反应(图4a)。结果表明没有加成产物的生成,只有苯乙烯基和溶剂三氟乙醇偶联的副产物12,该副产物的生成说明在反应过程中生成了苯乙烯基镍物种,但是该物种不能和酮进行加成反应。随后作者制备了芳基镍物种14,并在卤素攫取剂的存在下和苯乙酮反应(图4b),仍未得到目标产物。以上结果表明在该反应中没有生成烯基镍或芳基镍物种,排除了Type I所示的反应历程。随后作者验证了所开发的催化体系是否经历Ni(0)催化的历程(图1b, Type II)。当使用Ni(COD)2替代Ni(II)在标准条件下进行反应(图4c),获得了与Ni(II)催化相似的反应结果(86%, 94% ee vs 92%, 94% ee),接下来作者将Ni(0)催化体系中的溶剂由三氟乙醇换为环己烷(图4d,上),然而并没有观察到目标产物的生成。另外,在已报道Ni(0)催化有机硼化合物和酮反应的条件下,仅改变配体为L8,也没有目标产物的生成。为了进一步排除反应经历Ni(0)催化的历程,作者以对碘苯乙酮(1g)为底物,分别在Ni(0)和Ni(II)催化的条件下对反应进行考察(图4e)。在Ni(0)催化的反应条件下,除了生成目标产物3g,还观察到了芳基碘与Ni(0)氧化加成生成芳基镍后质子化的副产物3a,以及芳基镍和溶剂三氟乙醇偶联的副产物15,这两种副产物的生成表明芳基碘和Ni(0)可以发生氧化加成生成芳基镍物种,然而在Ni(II)催化的反应条件下,并没有观察到副产物3a和15。这些结果表明在作者所开发的反应体系中不涉及零价镍活性物种,而Ni(0)可以催化该反应可能是因为Ni(0)与溶剂三氟乙醇发生氧化加成生成了镍(II),反应仍通过Ni(II)催化的历程完成。最后,在反应体系中加入自由基捕获剂TEMPO(图4f),反应基本不受影响,表明该反应不涉及自由基中间体。基于以上控制实验结果,作者提出该反应可能经过六元环过渡态(图4g)。

图4:控制实验
为了进一步验证开发的反应是否经历所设想的路径,作者进行了DFT计算。计算结果支持作者设想的镍催化有机硼对芳基酮的1,5-迁移历程,并且当配体亚甲基上的取代基由苄基替换为2-萘基和2-蒽基时,反应过渡态的活化能均有所降低(图5a),该计算结果与实验结果相符。为了解释配体亚甲基上的取代基为2-蒽基时反应的收率和对映选择性最优,作者进行了IGMH分析。结果表明在该过渡态中存在C-H‧‧‧π,O-H‧‧‧π和F‧‧‧π相互作用,这些相互作用降低了反应活化能从而促进反应快速进行。为了解释镍可以作为Lewis酸催化该反应而其它Lewis酸如Cu(II),Co(II),Zn(II)和Fe(III)不能催化该反应,作者以Zn(II)为例进行了DFT计算。与BOX配体配位后镍的空间构型为平面四边形,该空间构型有利于Ni(II)与底物配位形成六元环过渡态,从而促进迁移过程的进行。但是Zn(II)的空间构型为四面体,配体和底物的空间位阻迫使Zn的空间结构扭曲成平面四边形,如TS-Zn(图5d),这些扭曲致使该六元环过渡态不稳定,进而导致Zn(II)不能催化该反应。
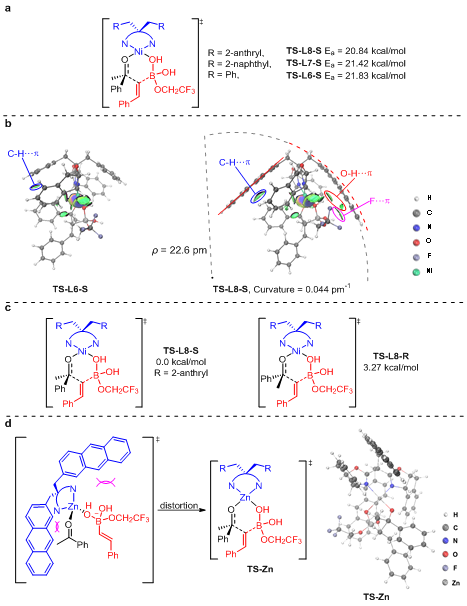
图5:DFT计算
总结
第一作者:魏海鹏
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn