


背景介绍
氘在过去二十年中成为了药物化学研究的主角。近年来,随着氘代药物的兴起,人们对其在减少潜在毒性、提高代谢稳定性和改善药代动力学特性方面的作用产生了极大兴趣。目前,药物通常通过细胞色素P450(CYP450)酶介导的氧化代谢,药物代谢位点上的C-H键被更稳定的C-D键替代,特别是在α-位置与杂原子相邻时,C-D键作为生物等效物具有增强药物药代动力学特性的潜力。这些研究促成了首例氘代药物——氘代丁苯那嗪(deutetrabenazine)的成功研发。近年来,基于氘标记策略,已开发出几种新型氘标记药物,如氘克拉维替尼(deucravacitinib)、氘那非替尼(donafenib)、VV116和氘鲁索替尼(deuruxolitinib),这些药物在各种医学应用中展现了广泛前景。此外,氘标记在其他科学应用中也表现出极大的潜力,如代谢物研究、核磁共振(NMR)光谱学内部标准物质的使用,以及在合成有机化学中作为探针揭示反应机制等。因此,探索氘代分子的化学空间,为多学科领域内功能分子的创新与发现提供了有前景的路径(见图1a)
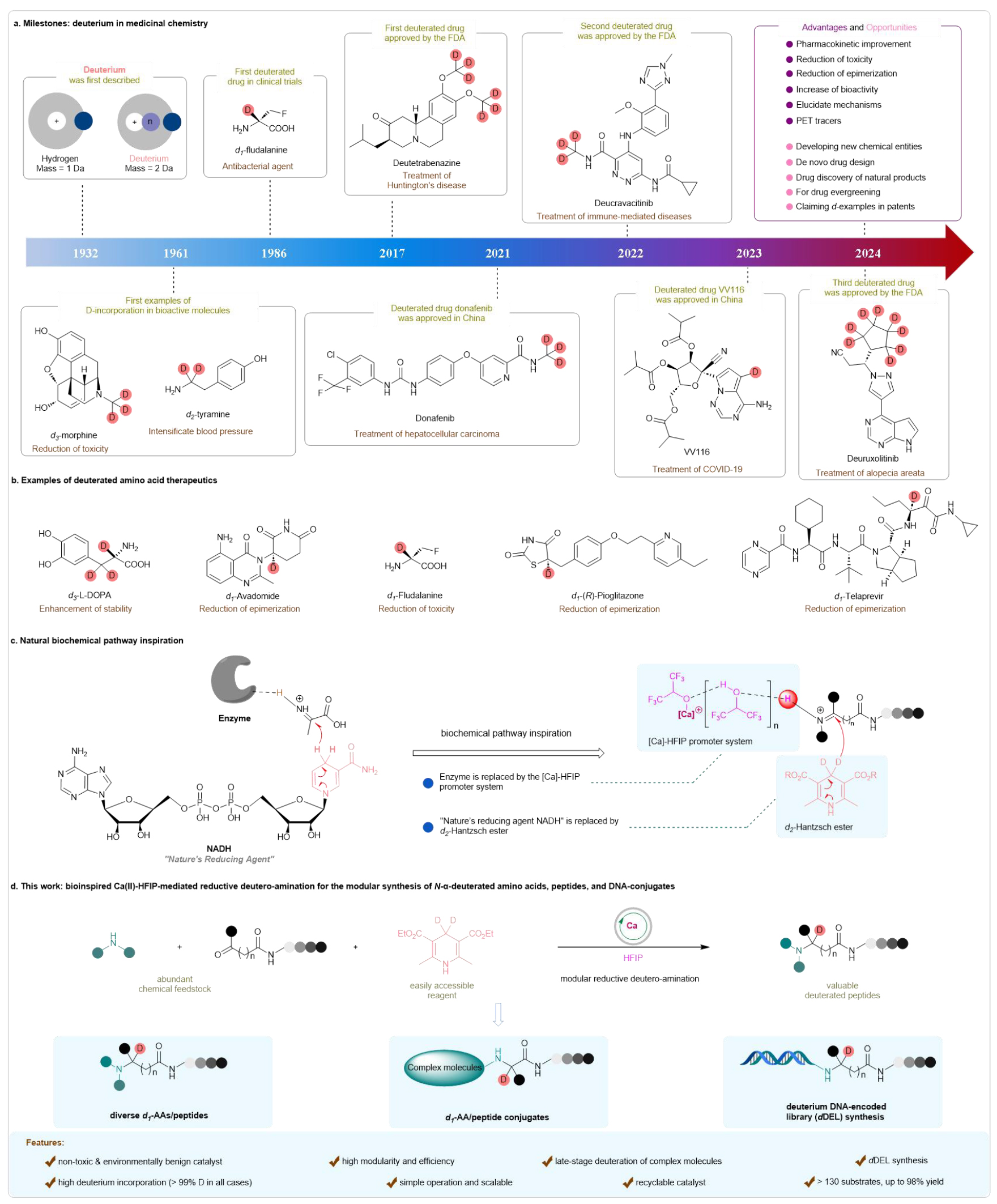
图1. 研究背景及意义(来源:Nat. Commun)
氨基酸是生命的基本单元,广泛存在于小分子药物、肽类的治疗药物中。氘代氨基酸及其衍生物在阐明生物合成途径、酶机制、肽/蛋白质结构、改善吸收分布代谢排泄(ADME)特性以及增强药效方面显示出广泛的应用。此外,氘代的氨基酸药物候选分子,尤其是在α-位置相对于氮的氘化,已被广泛研究(见图1b)。但是,现有的合成方法通常存在一些局限性,包括需要预先合成的复杂底物、苛刻的反应条件、使用贵金属和/或毒性催化剂,以及氘代率低等。这些不足以满足市场对高同位素纯度(理想情况下超过98%)氘标记活性药物成分(API)的需求。此外,多个氘原子的引入可能会导致化合物的物理性质(如溶解度和亲脂性)发生意想不到的变化,进而可能影响血浆蛋白结合(如d₉-咖啡因),以及吸收程度和/或速率的差异,同时也会增加整体成本。因此,在氘代氨基酸药物发现领域,特别是在氘标记α-位置相对于杂原子的位点选择性引入,保持最小氘原子数并达到较高的氘代率,对于提高药代动力学特性至关重要。然而,这仍然是一个无法逾越的挑战。受到生物还原胺化概念的启发,该研究开发了一种仿生Ca(II)-HFIP催化的还原氘代胺化策略,以高产率和在α-位点选择性构建了一系列氘代氨基酸,肽(见图1c)。本研究的亮点如下:(1)在方法学方面,开发了仿生Ca(II)-HFIP介导的模块化且高效的还原氘胺化策略,结合了三种易得的原料——氨基、酮酸酯和d₂-HE,可以在温和反应条件(室温)下进行一锅法合成N-α-氘代氨基酸;(2)在适用范围方面,多种氨基酸、肽、药物分子及其各种取代衍生物均具有良好的兼容性;(3)在催化剂回收方面,该催化剂具有较高的水溶性,便于回收;(4)在应用方面,该方法能够应用于On-DNA合成实现DNA编码的氘代多肽库的构建(见图1d)。
图文解析
该团队首先反应条件进行了优化,确定了最佳的反应条件:以5 mol%的Ca(NTf2)2作为催化剂,d2-HE1(1.5 eq)作为氘源,HFIP作为溶剂,在室温下反应12小时(图2)。值得注意的是,添加HFIP作为混合溶剂可显著提高钙催化的反应活性。研究团队进一步探索了该体系的底物兼容性(图3)。甲基、异丙基和叔丁基等基团得到了良好的耐受,并在优异的产率下提供了目标氘标记氨基酸(2-4)。卤素取代的苯胺类化合物也与体系兼容,能够提供相应的产物(5-8),产率为78%到98%,为进一步通过金属催化交叉偶联反应进行衍生化提供了机会。此外,该反应还适用于一系列电子结构各异的底物。给电子基团表现良好,能够得到目标产物9和10。吸电子基团,如-CO2Me、-SF5、-OCF3、-CONH2、-CONHMe、-CONMe2、-CN、-NO2等取代的苯胺,都可以作为可行底物,获得相应产物(11-18)。值得注意的是,在苯胺上引入可还原的官能团(如氰基、硝基、酰胺或酯基)时,反应表现出较高的化学选择性。氘代氨基酸16的结构通过X射线晶体学进一步得到确认。苯环上取代基的位置对反应结果没有显著影响(见产物19和20)。此外,酮酸类化合物作为多功能底物,也能高效地产生相应的化合物(21-24),这些化合物在C端具有自由的羧基。进一步研究表明,二取代和三取代的苯胺也可以作为适宜的底物,顺利生成相应的产物(25-29)。该策略不仅限于苯胺,2-萘胺也可以作为底物参与反应,得到相应的产物(30和31)。硫、氧和氮杂环化合物在此转化过程中均能保持完整(32-34)。并且,初级烷基胺在反应条件下也能得到良好耐受,并能以优异的产率得到目标产物(35、36)。令人欣慰的是,发现二级芳基胺与开发的钙(II)催化体系具有良好的兼容性。对称(37-41)和不对称的二芳基胺(42-45)、芳基-烷基胺(46、47)以及环状胺(48-50)均能很好地耐受,得到了相应的d1-甘氨酸。重要的是,该策略能兼容二级烷基胺,产率良好(51、52)。该团队进一步考察酮酸酯或酮酸,以合成多种天然/非天然的氘标记氨基酸衍生物。使用甲基丙酮酸作为原料,与不同的胺反应,顺利得到了多种氘标记的丙氨酸衍生物(d1-Ala)(53-64)。多种烷基取代的酮酸酯/酸适用于氘代天然氨基酸衍生物的合成。如d1-苯丙氨酸(65)、d1-缬氨酸(66)、d1-酪氨酸(67)、d1-色氨酸(68)等。非天然氨基酸因能够设计具有增强稳定性和功能性的蛋白质,在药物发现中引起了广泛关注。研究发现,乙基取代的酮酸酯、环状酮酸酯以及较长碳链的酮酸酯可以作为可行的底物,成功合成了相应的氘标记非天然氨基酸衍生物(d1-UAAs 69-73),产率为74%到89%。
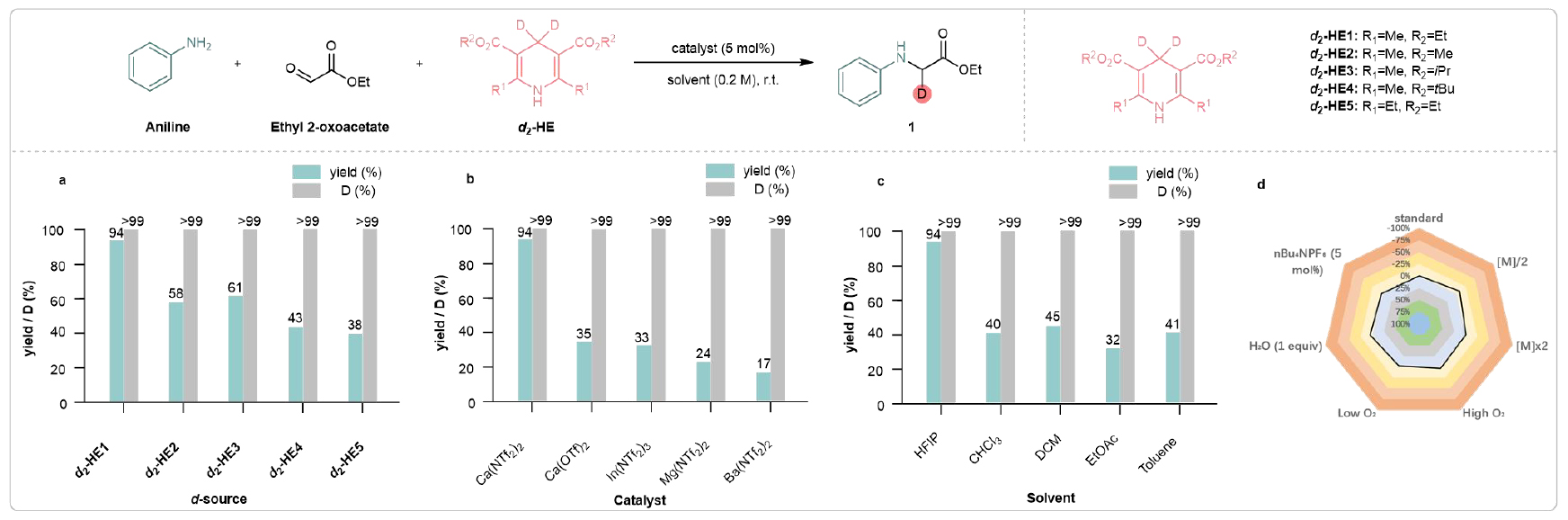
图2. 条件优化(来源:Nat. Commun)
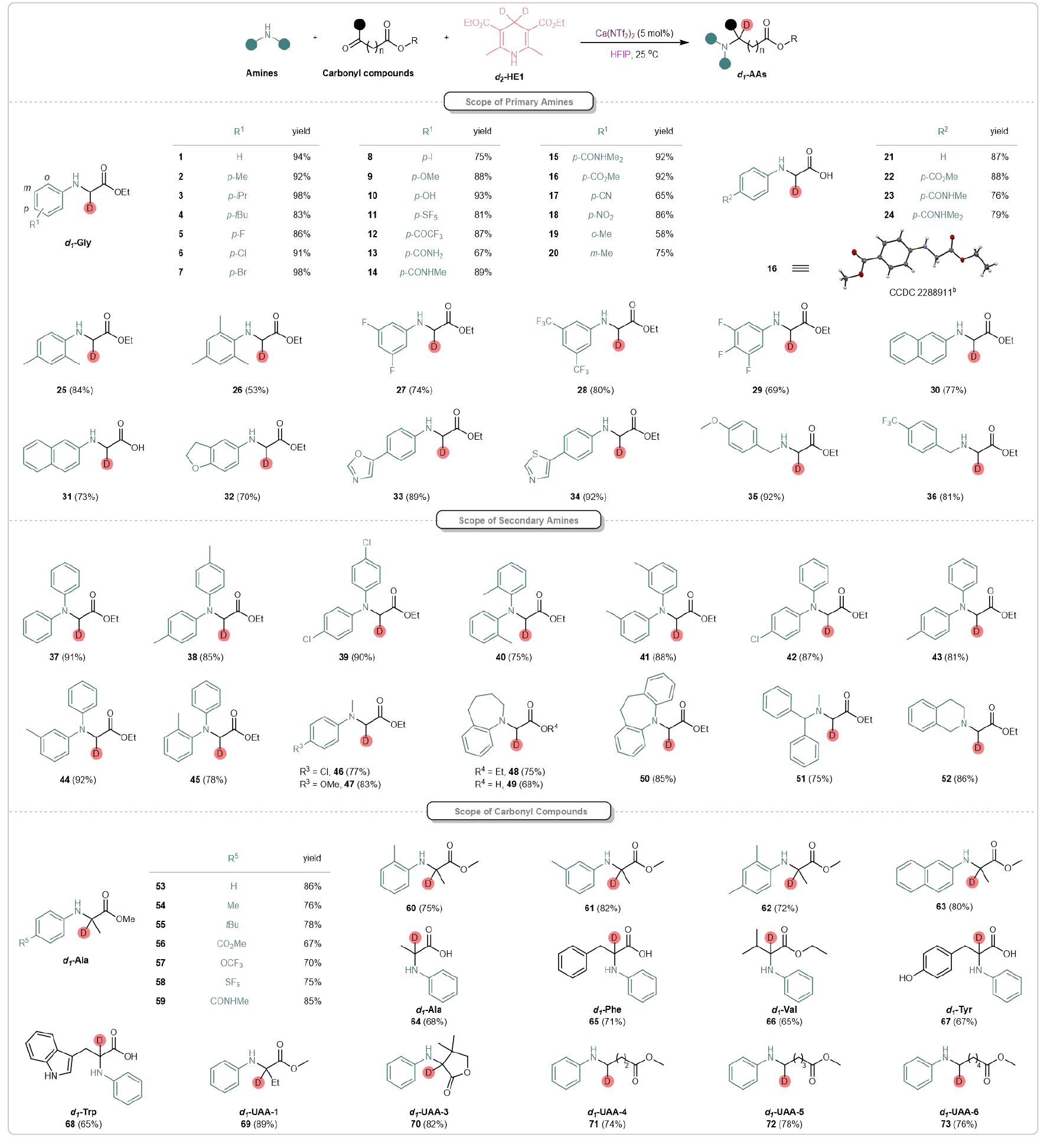
图3. 氘代氨基酸及其衍生物的合成(来源:Nat. Commun)
该方法也适用于氘代多肽的合成(图4)。首先,该研究团队成功合成了一系列氘代的二肽衍生物(d1-Gly-Phe)(74-84)。83的结构通过X射线晶体学得到了确认。并且,该策略能够完美保持原有骨架的手性。不同种类的氘代的二肽85-92成功合成,包含了如丙氨酸、异亮氨酸、酪氨酸、缬氨酸、苯丙氨酸和色氨酸等具有非极性侧链的氨基酸,具有极性侧链的丝氨酸,及具有碱性侧链的赖氨酸等。该团队进一步探讨了增加链长对氘代肽类合成的影响,含有丙氨酸、苯丙氨酸、脯氨酸、甘氨酸和亮氨酸的氘标记三肽(95-98)可以在高产率下合成。并且,氨基酸如丝氨酸、酪氨酸、谷氨酸、脯氨酸、蛋氨酸和赖氨酸的亲核残基能够与靶向共价抑制剂(TCIs)中存在的迈克尔受体型电亲性靶点形成共价键,因此,这一合成潜力对于靶向共价药物的发现具有重要价值。
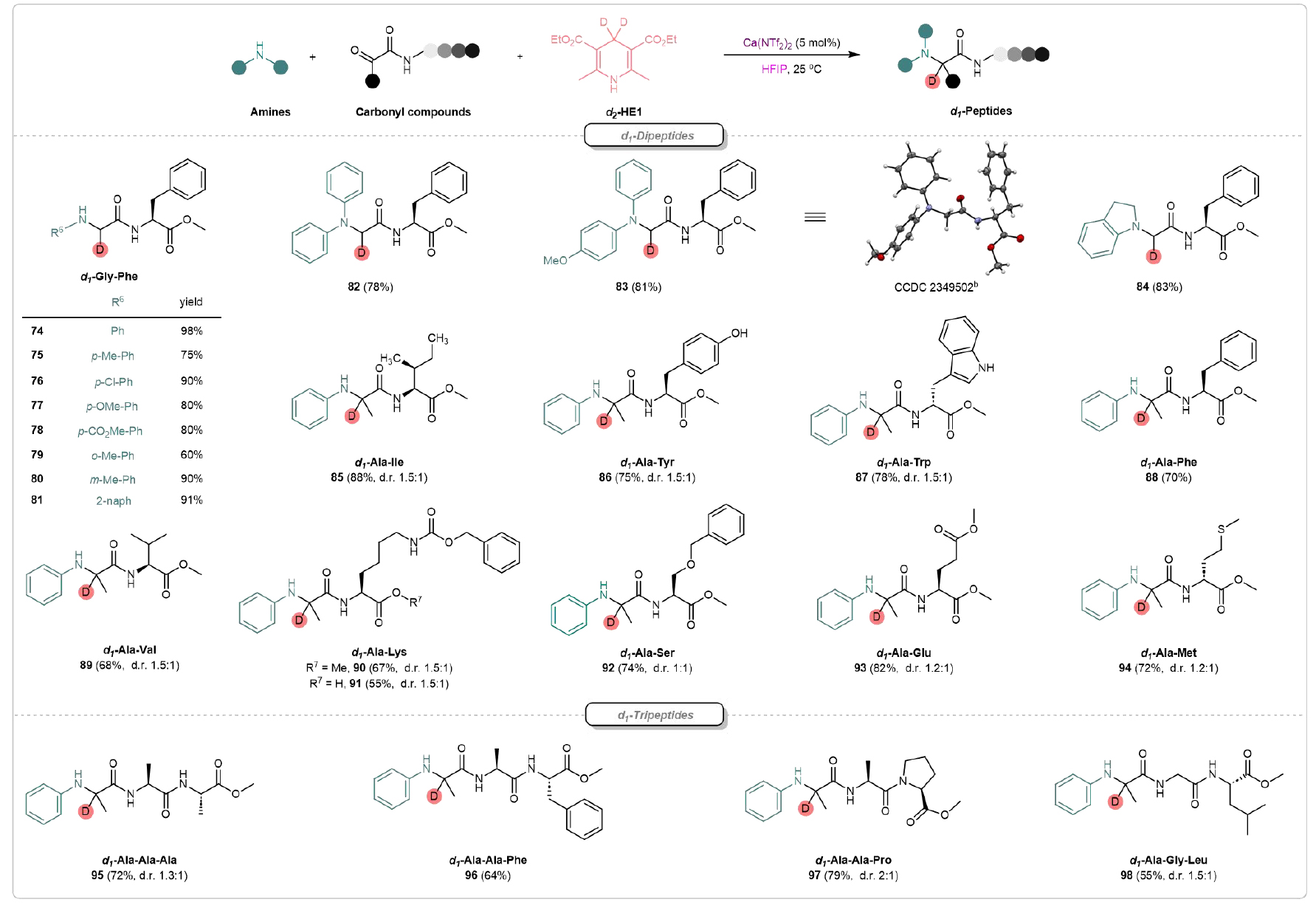
图4. 氘代多肽的合成(来源:Nat. Commun)
复杂分子的后期功能化具有巨大的潜力,可以快速构建一系列新的药物骨架。氨氯地平(Amlodipine)是一种钙通道阻滞剂,广泛用于临床治疗高血压和冠状动脉疾病。该团队以其为底物,成功合成了相应的d1-氨氯地平-甘氨酸结合物(d1-Amlodipine-Gly)99(图5)。随后,底物普适性研究发现,磺胺甲噁唑(100)、苯佐卡因(101)、奥司他韦(102)、达普酮(103)、克唑替尼(104)、吲哚美辛(105)、氟比洛芬(106)、门布酮(107)、苯溴酸(108)、伊索替尼(109)、布洛芬(110)、吉非贝齐(111)、非布司他(112)等药物分子都能兼容,得到相应的氘代氨基酸-药物结合物。此外,天然产物如单甲基琥珀酸(113)、月桂酸(114)和吡啶丁酸(115)也能在该反应条件下顺利反应,得到相应的产物,并具有良好的产率。
进一步研究发现,二肽与药物骨架的连接反应也能高效进行,成功得到产物d1-Menbutone-Gly-Phe(116)和d1-Menbutone-Ala-Val(117)。值得注意的是,这些结果验证了酰胺、卤素、磺酰基、酯、酮以及杂环等官能团在该反应体系下都能保持稳定,未受到影响。毫无疑问,Ca(II)-HFIP介导的复杂分子后期修饰提供了一种高效且富有吸引力的策略,用于新化学实体的合成和潜在的药物发现研究。
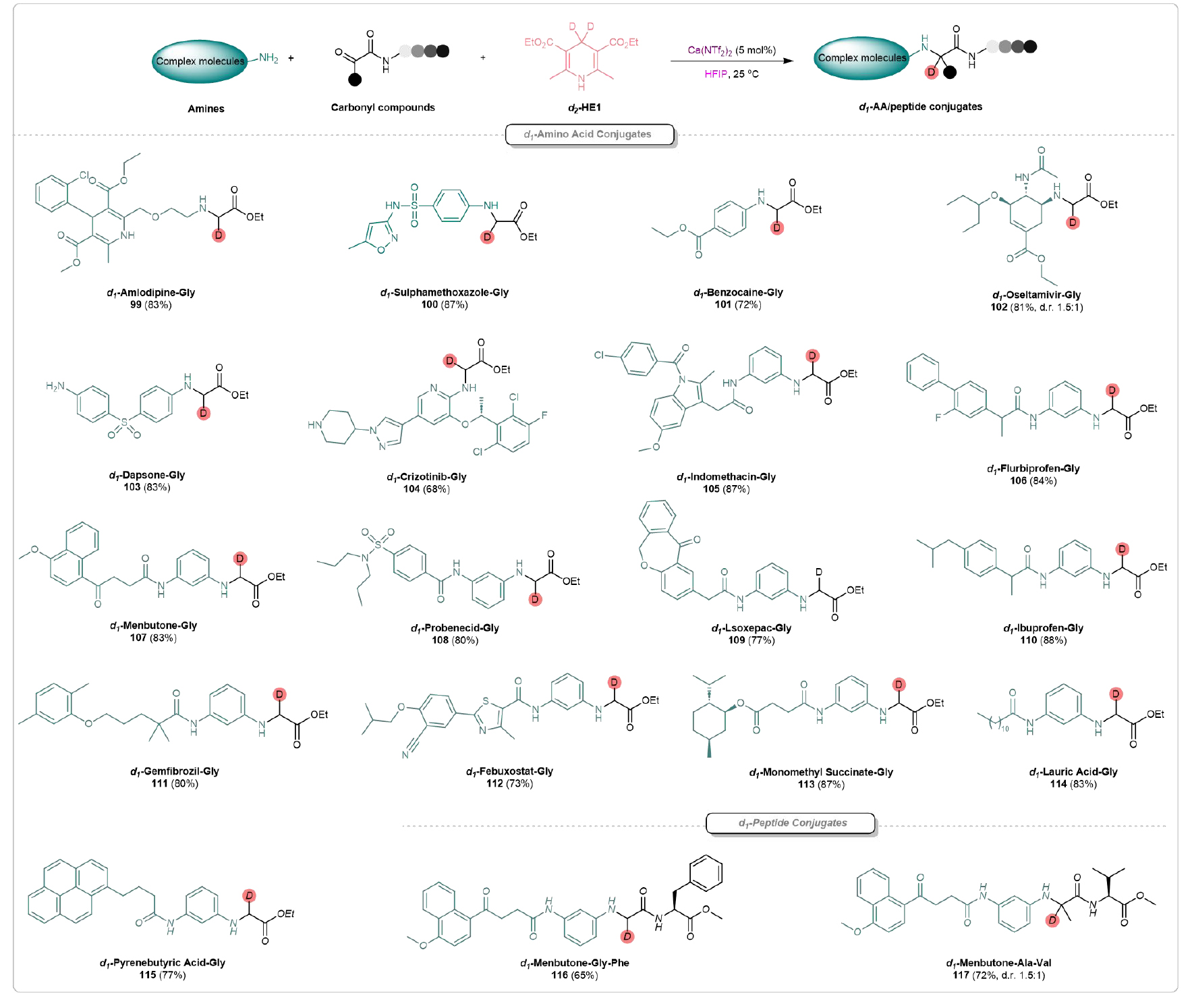
图5. 复杂分子后期修饰(来源:Nat. Commun)
为了进一步研究氘标记引入化学实体是否能提高代谢稳定性,该团队初步进行了人体微粒体代谢实验,以评估代谢稳定性,选取68作为模型抗氧化化合物。在180分钟的微粒体孵育后,残留的68的量高于68-H。通过计算,68的半衰期也较68-H有所延长(68-H, t1/2 = 4.46 h;68, t1/2 = 5.91 h),这表明氘标记在氨基酸α位的引入明显提高了代谢耐受性(见图6a)。这些结果进一步证明了当前方法在促进氘标记氨基酸/肽类的位点选择性合成方面的显著价值。该方法的实用性通过成功的克级合成氘标记氨基酸1和d1-氨基酸结合物102(分别以90%和76%的产率)得到了进一步证明(见图6b)。并且催化剂能够回收利用(见图6c)。
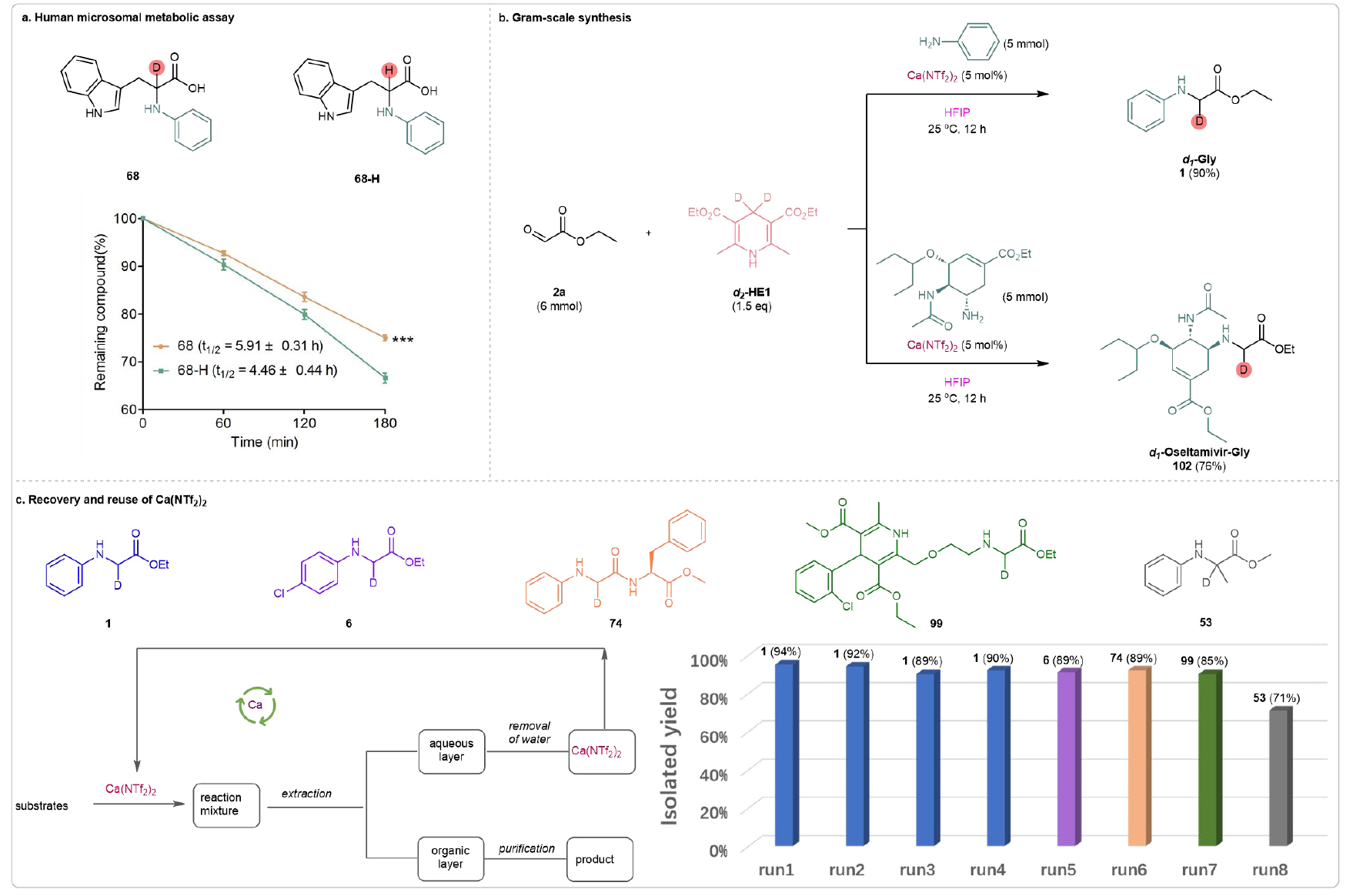
图6. 代谢稳定性实验及合成应用(来源:Nat. Commun)
为了更好地理解反应机理,该团队进行了一系列对照实验(见图7a)。当加入自由基捕捉剂TEMPO时,反应依然顺利进行,且产率未发生下降。AIBN是常用的自由基引发剂,但在标准条件下,使用AIBN并未提高反应产率。根据这些实验,排除了自由基机制的可能性。随后进行的氘代实验表明,当使用d1-HE1或d2-HFIP时,未观察到氘的引入,这表明产物中的氘来自于Hantzsch酯的4-D。因此,推测氘转移反应可能遵循一种协同机制,类似于相关的氢转移还原过程。在Hantzsch酯H-和D-Hantzsch酯的竞争反应中,观察到了动力学同位素效应(kH/kD=4.8),这清楚地表明C-H键的断裂是决速步。
基于以上结果,提出了一个可能的反应路径,涉及Ca(II)-HFIP介导的还原氘代氨化的协同机制(见图7b)。前的工作中,发现[Ca(NTf2)(HFIP)2]+,其中两个HFIP分子与钙离子配位,是最活跃的簇。对于具有O和N原子作为锚点的底物,通过Ca–O配位键和一个HFIP配体的N–H氢键形成螯合。第二个HFIP配体通过F–Ca和O–H键稳定该复合物。在当前情况下,这种配合物会生成物种A。随后,d2-HE1对亚胺进行氘化,生成目标产物。最后,通过C的质子转移再生催化剂,同时释放D(通过NMR分析确认)作为副产物。为了验证这一假设,我们首先进行了酸度研究,采用Child方法。将HFIP(2 eq)与Ca(NTf2)2结合,导致Hβ在7.26 ppm处出现最大化学位移变化(见图7c)。这些结果验证了Ca(II)-HFIP介导系统增强酸性的假设。同时,该团队借助DFT理论计算,使用M06-2X/6-31+G(d,p)(SMD)计算了甲基(E)-2-(苯基亚胺)乙酸酯、1,4-二氢-2,6-二甲基-3,5-吡啶二甲酸二甲酯和上述复合物[Ca(NTf2)(HFIP)2]+(见图7d)。如上所述的亚胺乙酸酯的激活确实使得Hantzsch酯的氢化物和HFIP的质子能够同时转移,并且自由能为16.7 kcal/mol,这一步骤的反应释放了17.2 kcal/mol的能量。
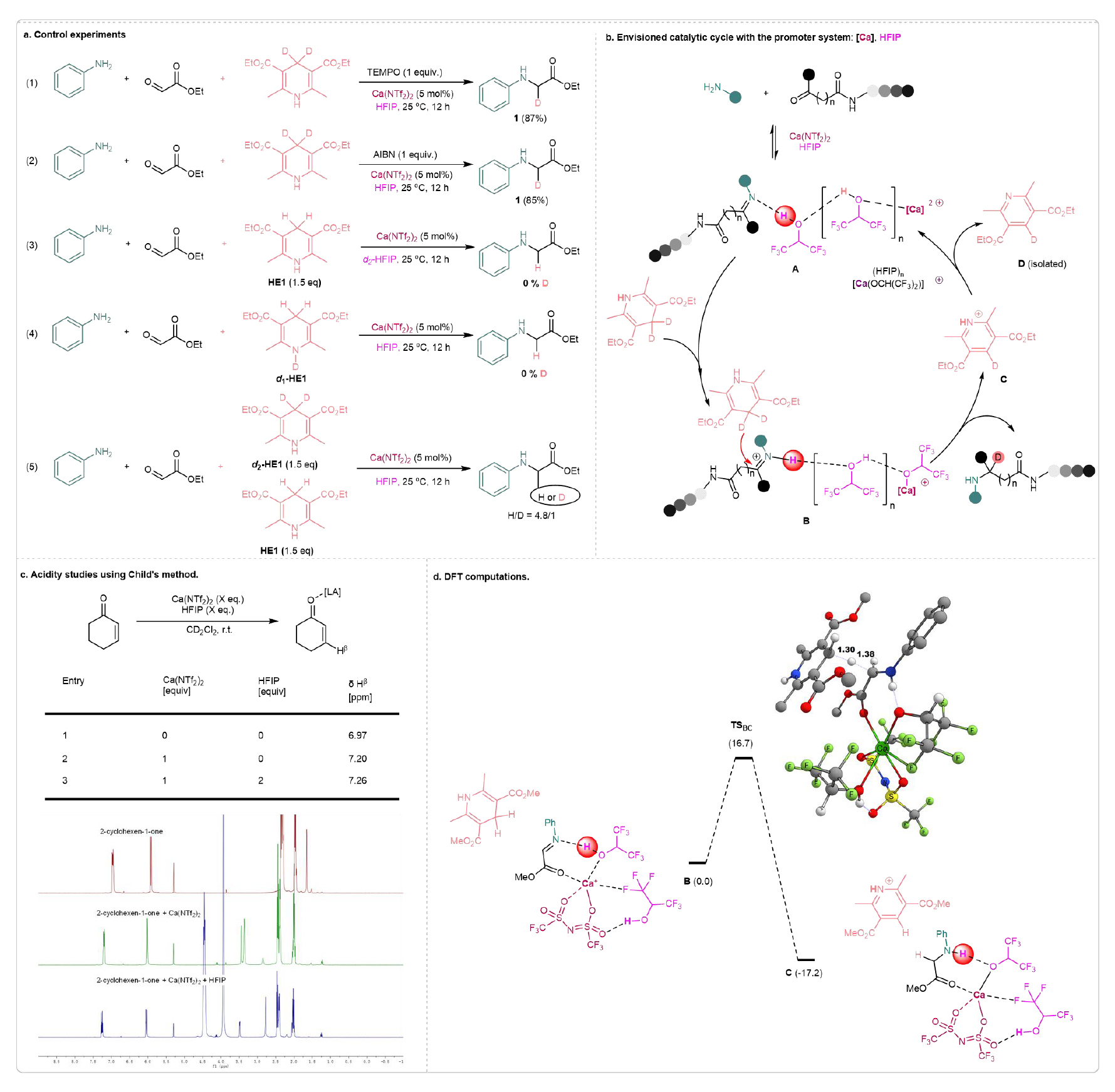
图7. 机理研究(来源:Nat. Commun)
1992年,Lerner和Brenner提出了DNA编码库(DEL)技术,这是一项将化学与生物学无缝结合的革命性技术,在药物发现领域具有重要意义。DEL通常通过多轮酶促DNA条形码和DNA兼容化学反应构建。因此,推动DNA兼容反应的进展是DEL研究领域中的关键挑战之一,极具挑战。该团队成功将开发的策略应用于DNA兼容的还原氘代胺化反应。通过合理设计,该团队成功合成了多种DNA连接的d1-氨基酸/肽。正如图8a所示,DNA连接的胺HP-1与不同的羰基化合物反应,成功生成了目标DNA-d1-AA连接物(118)、DNA-d1-UAA连接物(119-121)和DNA-d1-肽连接物(122)。值得一提的是,氨基苯环上取代基的位置对反应结果没有显著影响,尤其是meta取代的胺具有良好的兼容性,能够生成所需的DNA连接物123-127,转化率为44-95%。为了进一步探讨该DNA上还原氘化胺化反应的普适性,我们合成了长链DNA连接的胺HP-2和HP-3,结果证明这些胺在与多种羰基化合物反应时,能够得到所需的DNA连接的d1-AA/UAA/肽,转化率为中等至良好(128-137)。
如前所述,Ca(II)-HFIP介导的DNA上还原氘代胺化能够构建所需的DNA连接的d1-氨基酸,且具有附加的锚定–羧基。这一特性将促进它们在多样性导向合成中的应用。为了全面评估该方法在化学分岐合成中的潜在应用,该团队在DEL中调查了DNA-d1-复杂分子连接物的DNA上合成潜力。如图8b所示,Ca(II)-HFIP介导的DNA连接胺(HP-1)与羰基底物的还原氘化胺化反应顺利进行,得到DNA连接的d1-氨基酸(118),该产物在进一步与各种胺通过经典的酰胺化反应后,成功得到所需的DNA连接的d1-复杂分子(138和139),产率达到合成上有用的水平。这些结果证明了所开发策略的兼容性,并突出了其在DEL构建中的巨大潜力。
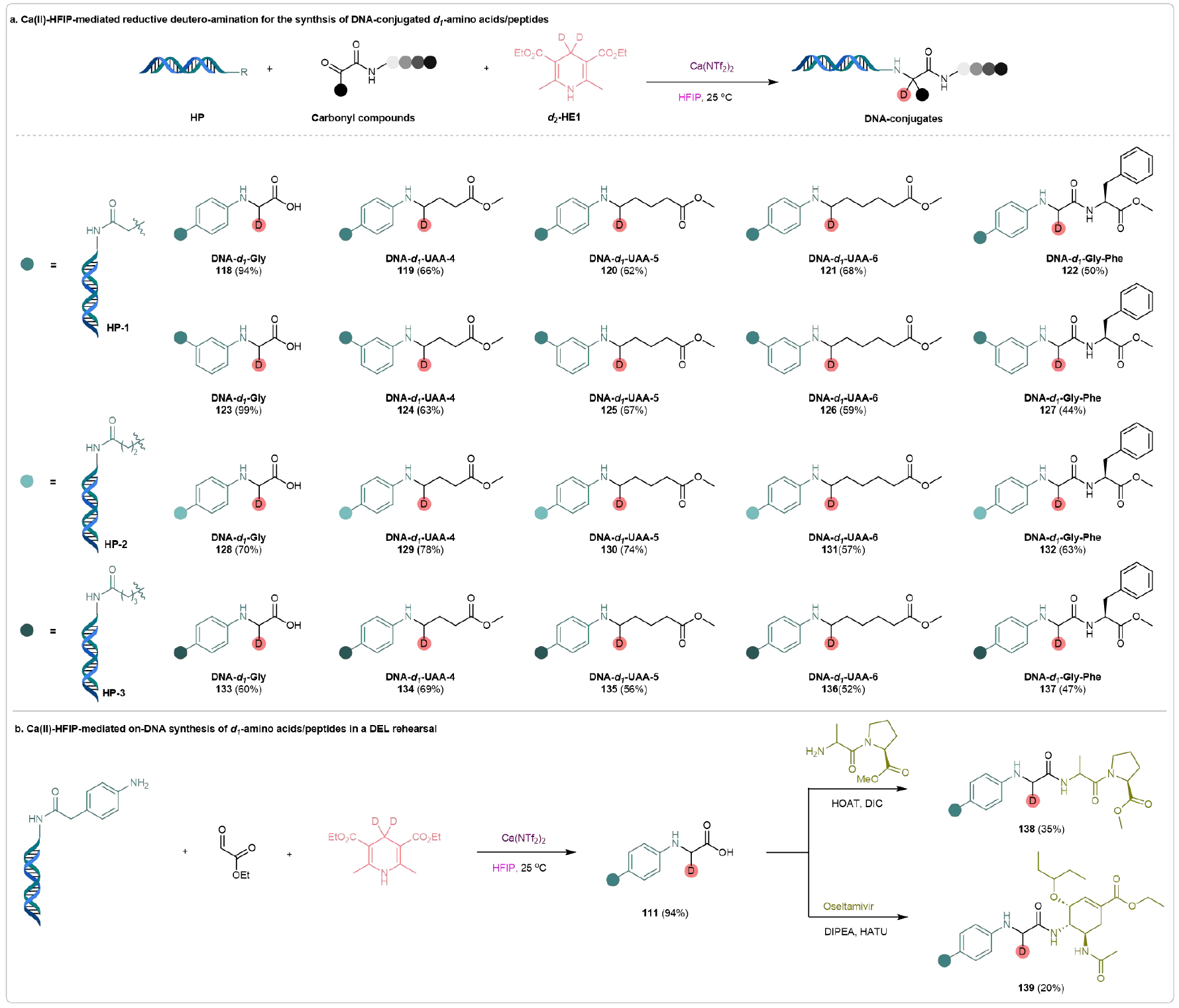
图8. DNA偶联d1-氨基酸/肽的合成及其多样化转化(来源:Nat. Commun)
总结
该团队报道了一种通过仿生还原氘代胺化反应,直接合成氘代氨基酸/肽的方法。该方法利用地球丰度且环保的钙基催化剂,在HFIP中以仿生d2-Hantzsch酯作为氘源,成功地实现了简单酮酯与胺类的氘化反应。该策略具有温和的反应条件、高产率、良好的底物适应性、优异的氘代水平以及α-位置至N-杂原子的位点选择性氘化特点。催化剂的高水溶性使得其能够被轻松回收,支持多次循环使用,充分体现了该协议的高效性和可持续性。通过其在克级合成和药物分子及天然产物的后期氘化中的应用,已证明了该方法的实用性和稳健性。此外,所开发的氘标记策略在提高代谢稳定性方面也展现了其功能性。最后,钙催化剂已成功应用于DNA编码库合成,实现了DNA标记的氘代氨基酸/肽/药物的合成,这一进展展示了在合成氘代DNA编码库(dDEL)方面的巨大潜力,有望高效探索超大规模的氘代化学空间。
王胜东,教授、广东省“珠江人才计划”青年拔尖人才。2018年获得雷恩第一大学博士学位;随后于巴黎萨克雷大学从事博士后研究;2021年以南山学者特聘教授加入广州医科大学药学院。研究兴趣为绿色药物合成策略的设计与开发、廉价金属催化的有机方法学研究;以第一/通讯作者在Angew. Chem. Int. Ed.、Nat. Commun.、ACS Catal.、ChemSusChem、Org. Lett.等著名期刊上发表论文二十余篇。
易伟,呼吸疾病国家重点实验室教授、广州医科大学药学院副院长(分管科研);博士生导师、南山学者杰出人才、广东省杰青、广州市岭南英杰;中科院青年创新促进会会员、中国药学会会员、中国药理学会会员、中国化学会会员。主要从事以结构为基础、功能为导向的创新药物设计与发现。迄今在Nature、Cell Res.、Chem、Angew. Chem. Int. Ed.、Adv. Sci.、ACS Catal.、Chem. Sci.、PNAS、APSB等国际著名期刊上已发表研究论文100余篇,总他引率4000余次,h指数大于40。申请国内外发明专利10余项(包括美国专利一项、PCT五项),其中部分已成功转让,总金额近800万美元。
许红涛,上海科技大学免疫化学研究所副研究员。研究工作聚焦于药物化学生物学领域的基础和应用研究,在DNA编码化合物库(DEL)的构建与筛选,生物大分子的选择性修饰和工程化免疫细胞等方面积累了丰富的研究经验。迄今在Angew. Chem. Int. Ed.、Nat. Commun.、Chem、Adv. Sci.、ACS Catal.、APSB等国际著名期刊上已发表研究论文100余篇。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn