


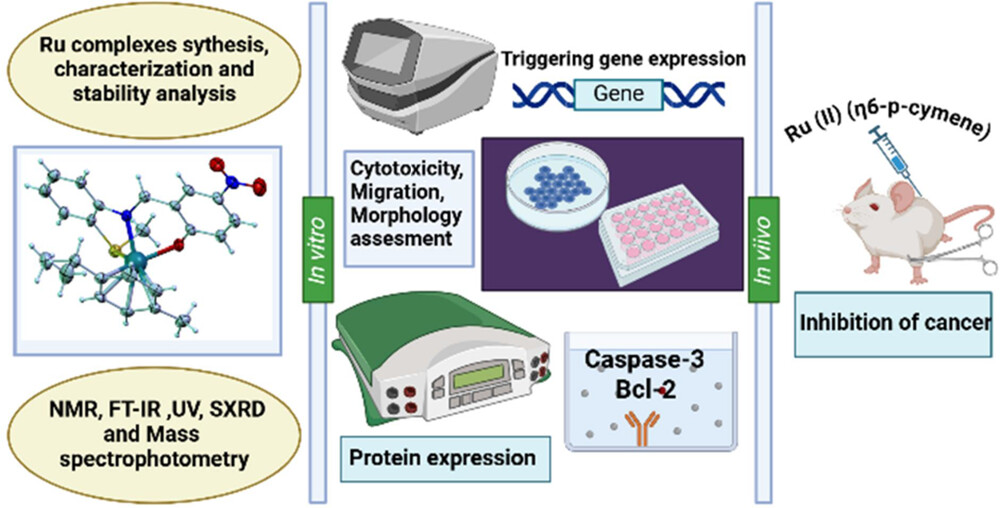
正文
在本研究中,作者利用三齿ONS-供体配体合成了12种单官能团Ru(II)配合物,[(Ru(L)(p-cymene)]+-Cl- (C1-C12)。纯化后,高产率高纯度获得复合物C1–C12。
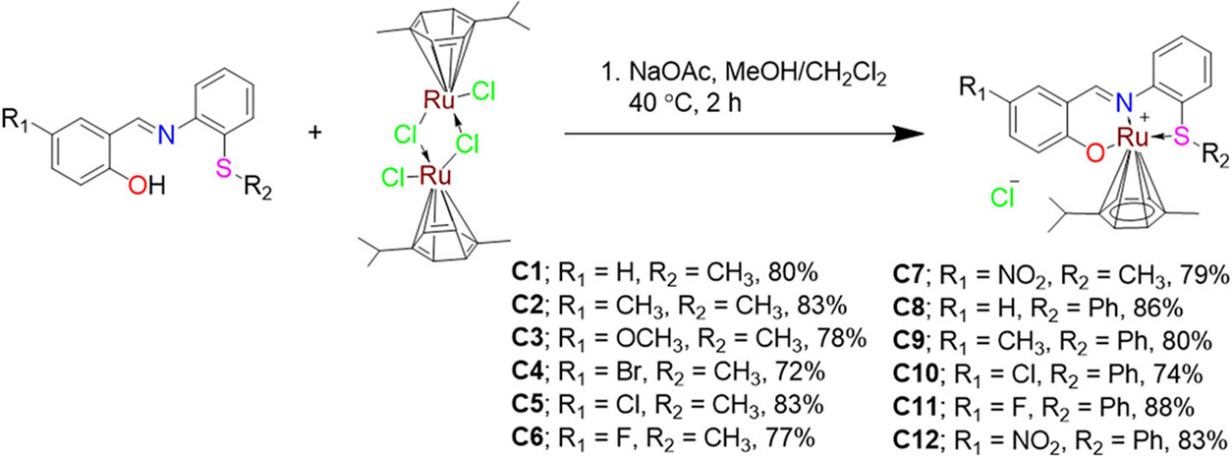
方案1 Ru(II)配合物(C1-C12)的合成方案
通过1H NMR 揭示了各种质子化学位移,用13C NMR波谱、HR-ESI MS分析、FT-IR光谱等不同的分析方法表征配合物, 1H NMR详细检查了它们在液态中的稳定性,表明这些复合物在水中或含有一部分甲醇的水中高度稳定。紫外可见光谱图显示,每种复合物的吸收带没有明显变化,表明这些复合物在PBS溶液中高度稳定。
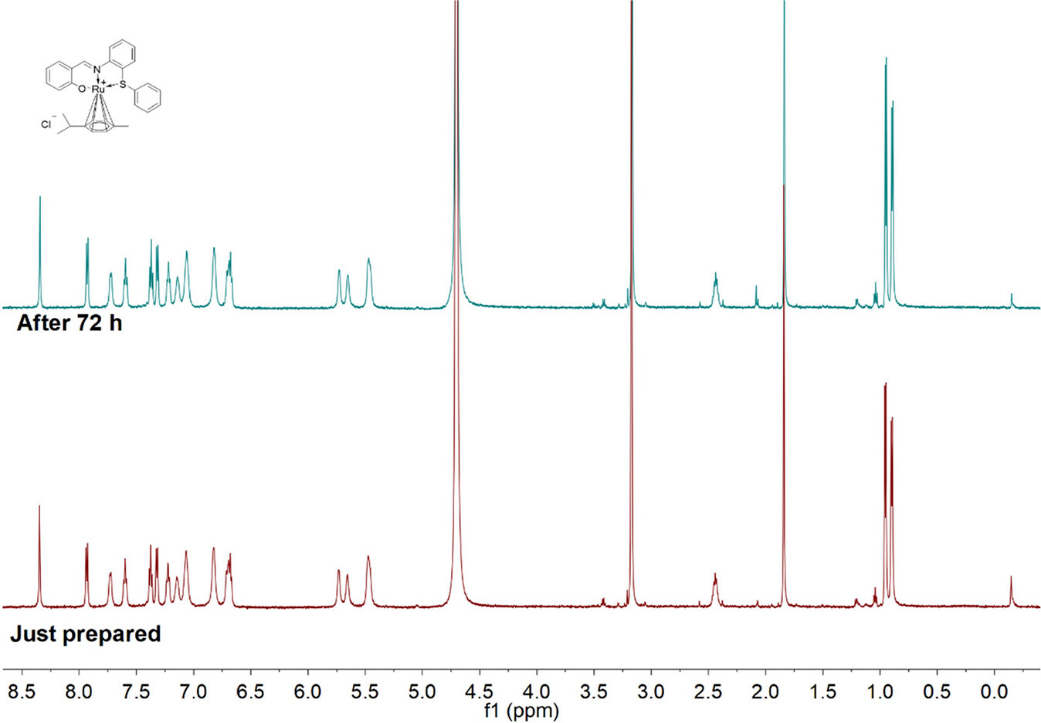
图3 1H NM谱分析C8的稳定性
CCK-8结果表明复合物C8和C11在所有测试癌细胞系中表现出更高的抑制细胞生长能力。复合物C2、C8和C11表现出强大的抗癌活性,突出了它们在癌症治疗中的潜在疗效。
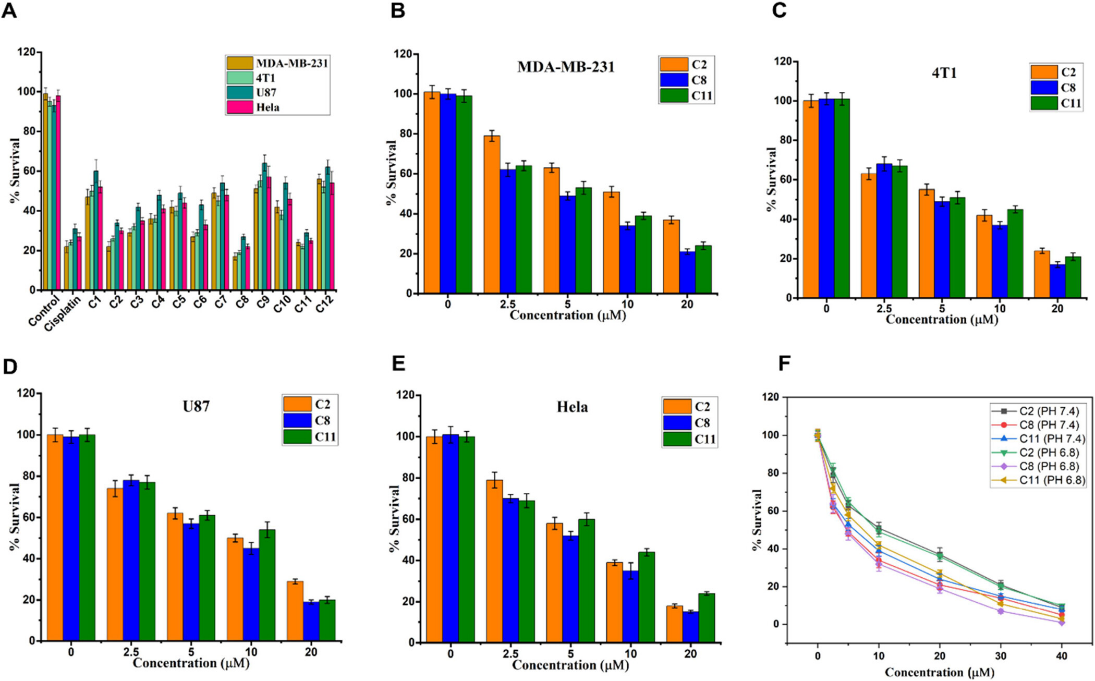
图4 C1-C12抑制MDA-MB-231、4T1、U87MG和HeLa癌细胞的增殖
死活染色实验结果发现C2、C8和C11干预后死亡细胞数量显着增加。C8表现出最多红色,表明细胞死亡诱导明显。突出了C2、C8和C11作为对抗癌症进展的有效药物的潜力。
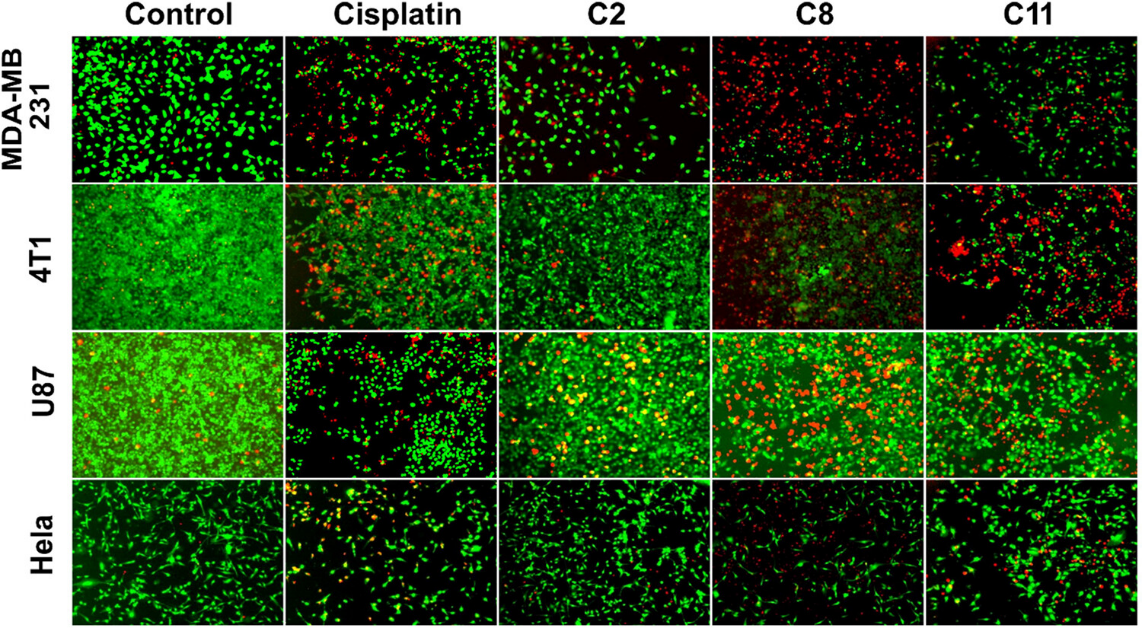
图5 MDA-MB-231、4T1、U87MG 和 HeLa 癌细胞在C2、C8、C11和对照组处理并用钙黄绿素-AM/PI 染色后的代表性共聚焦图像
伤口愈合实验评估C2、C8、C11、顺铂在MDA-MB-231、4T1、U87MG和HeLa细胞中的迁移能力,结果发现用C2、C8、C11处理的癌细胞迁移显著减少。C8显示出对迁移的强烈抑制。强调了这些金属络合物减弱癌细胞迁移的强大能力,突出了它们作为靶向癌症转移的有前途的治疗剂的潜力。
共聚焦显微镜显示MDA-MB-231细胞用C8处理后显示出从红色到绿色荧光的显著转变,表明线粒体膜电位丢失,C8可能通过线粒体损伤介导细胞凋亡。克隆形成实验表明C8有效抑制了MDA-MB-231、4T1和U87MG的克隆形成生长。
RT-PCR实验评估了MDA-MB-231细胞中响应caspase-3和Bcl-2激活而上调和下调的基因表达水平。观察到MDA-MB-231细胞中MMP-2、CXCR4、CD44、 BCL-2、BCL-XL、MCL-1、BAX、BAK和BIM等基因表达发生显著变化。表明C8不仅抑制转移潜力,还促进三阴性乳腺癌细胞(MDA-MB-231)的凋亡,增强治疗效果。
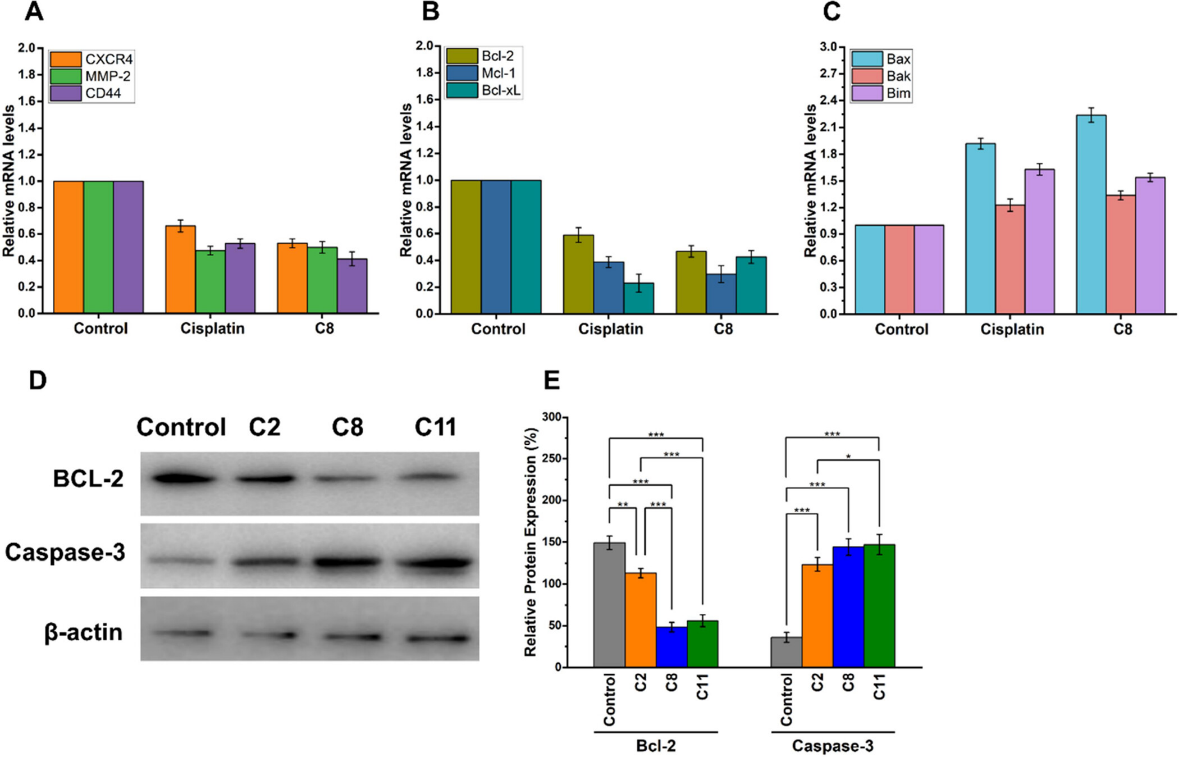
图8 Ru 细胞凋亡表达和细胞周期抑制
蛋白表达结果显示,C2、C8 和 C11 复合物处理的 4T1 乳腺癌细胞显着增加 caspase-3 表达,降低 Bcl-2 表达。C8 复合物表现出最显著的效果,表明C8可调节参与细胞凋亡和细胞周期调节的关键蛋白的表达从而抑制了癌细胞增殖。
琼脂糖凝胶电泳评估C2、C8和C11对质粒DNA跨凝胶迁移的抑制作用。发现C2、C8和C11诱导的DNA迁移率显著降低。阻滞的电泳迁移率证实了 DNA-金属相互作用导致癌细胞凋亡。
进一步在乳腺癌小鼠模型中,发现C8 显示出防止肿瘤迁移的能力。在减少肿瘤生长方面超过了已建立的化疗药物顺铂的肿瘤抑制作用。C8 治疗的小鼠存活率和体重高于其它组,肿瘤大小、体积和重量显著减少。强调了 C8 作为一种有效的抗肿瘤药物的治疗潜力,表明其作为癌症管理策略的前瞻性候选药物的可行性。
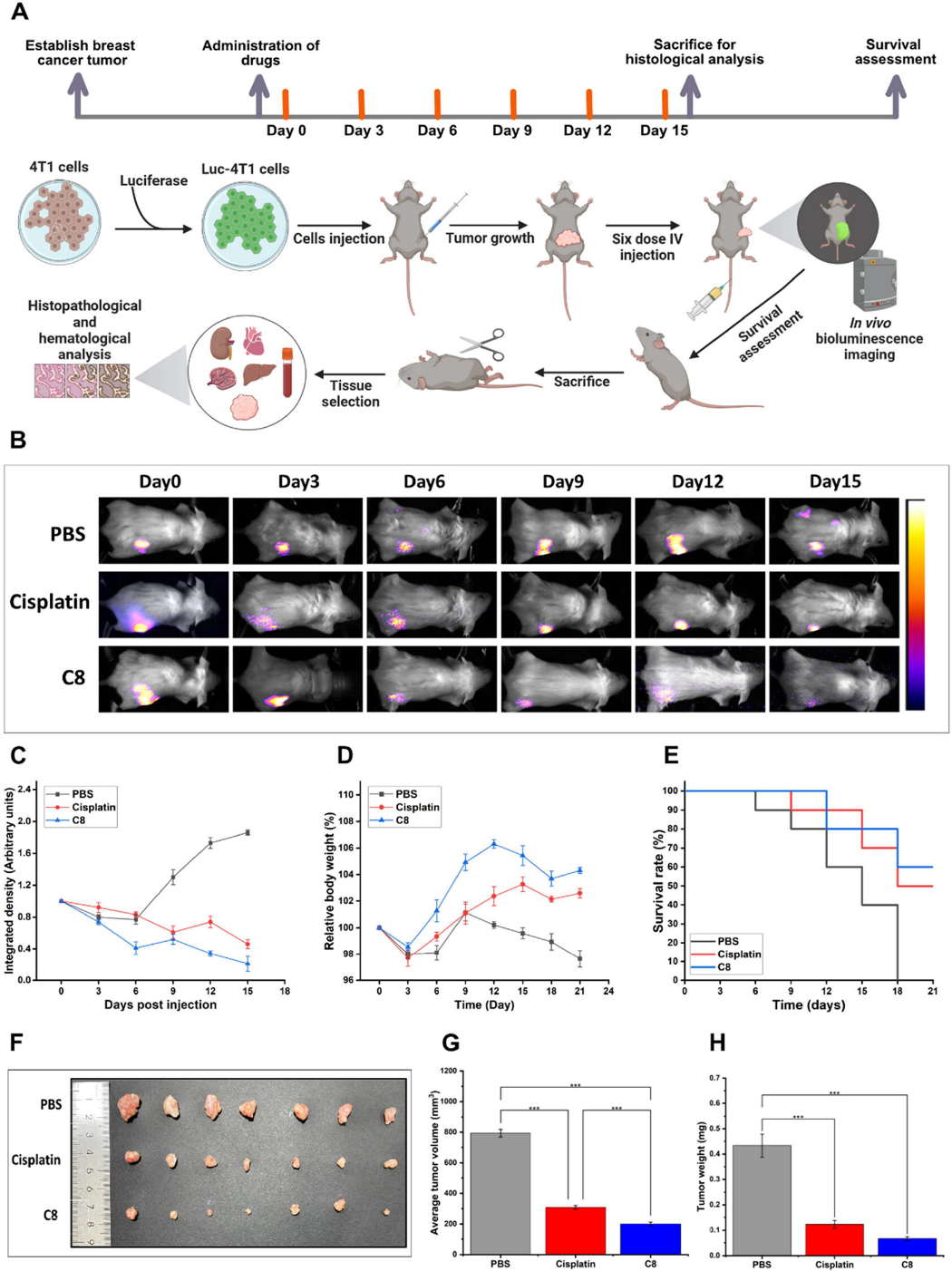
图10 原位4T1乳腺肿瘤小鼠中复合物 C8 的体内生物分布和癌症抑制评价
HE染色证实C8 处理组表现出更多的细胞凋亡。免疫印迹和IHC分析揭示了治疗显著提高了TNF-α、caspase-3、cleaved caspase-3水平,降低了Bcl-2 水平。表明C8治疗在诱导细胞死亡方面的有效性,调节炎症信号通路和凋亡信号传导的能力。
C8对4T1荷瘤小鼠各种生理参数的影响结果显示,C8治疗的小鼠脾脏大小和重量显著减少。表明化合物可能通过涉及肿瘤生长抑制和抑制脾转移的机制来调节炎症反应。HE结果表明C8治疗不会诱导心脏、肝脏或肾脏的病理变化。溶血实验表明C8可有效稳定红细胞膜。强调了C8较高的血液相容性及在安全治疗应用中的潜力。
总结
综上所述,作者合成了12种复合物C1-C12,C8复合物表现出良好的体内体外安全性,可高效抑制肿瘤生长,充分体现了它在癌症治疗中的治疗潜力。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn